பொட்டாசியம்: 19 ஆம் அணுவெண்ணைக் கொண்ட மூலகம்
பொட்டாசியம் (இலங்கை வழக்கு: பொற்றாசியம், Potassium) ஆவர்த்தன அட்டவணையில் உள்ள வேதியியல் தனிமங்களுள் ஒன்று.
இதன் குறியீடு K (L. kalium), இதன் அணுவெண் 19. முற்காலத்தில் பொட்டாசியம் காபனேட்டின் தூய்மையற்ற வடிவமான பொட்டாஷ் என்னும் கனிமத்திலிருந்தே பொட்டாசியம் பிரித்து எடுக்கப்பட்டது இதனாலேயே பொட்டாசியம் என்ற பெயரும் உண்டானது. பொட்டாசியம் ஒரு வெள்ளிபோன்ற வெண்ணிற உலோகமாகும். இது வேறு தனிமங்களுடன் சேர்ந்து கடல் நீரிலும், பல கனிமப் பொருட்களிலும் காணப்படுகின்றது. இது வளிமண்டலத்தில் விரைவாக ஒட்சியேற்றப்படக் கூடியது (oxidizes). சிறப்பாக நீருடன் மிகவும் தாக்கமுறக்கூடிய பொட்டாசியம் ஓரளவுக்கு சோடியத்தை ஒத்தது. பொட்டாசியம் எரிமலைப் பாறைகளில் சிலிகேட்டாக எங்கும் பரவலாகக் காணப்படுகின்றது. பூமியில் மேலோட்டுப் பகுதியில் இதுவும் சோடியமும் ஏறக்குறைய ஒரே செழுமையைப் பெற்றுள்ளன. பொட்டாசியத்தின் செழுமை எடையில் 2 .35 விழுக்காடு இது செழுமை வரிசையில் ஏழாவதாகும். கிரானைட் கற்களில் பொட்டாசியம் ஓரளவு சேர்ந்திருக்கிறது. கடல் நீரில் சிறிதளவு பொட்டாசியம் இருக்கிறது.)
| பொட்டாசியம் | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
19K | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||||||||
வெள்ளி போன்ற சாம்பல் பாரஃபின் எண்ணெயின் கீழே பொட்டாசியம் முத்துக்கள். பெரிய முத்து 0.5 செ.மீ. அளவுடையது. கீழே: பொட்டாசியத்தின் நிறமாலைக்கோடுகள் | |||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | பொட்டாசியம், K, 19 | ||||||||||||||||||||||||||||||
| உச்சரிப்பு | /p[invalid input: 'ɵ']ˈtæsiəm/ po-TAS-ee-əm | ||||||||||||||||||||||||||||||
| தனிம வகை | கார உலோகம் | ||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 1, 4, s | ||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) | 39.0983(1) | ||||||||||||||||||||||||||||||
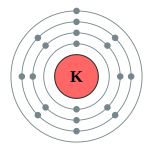
| இலத்திரன் அமைப்பு | [Ar] 4s1 2, 8, 8, 1 | ||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||||||||
| நிலை | திண்மம் | ||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | 0.862 g·cm−3 | ||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 0.828 g·cm−3 | ||||||||||||||||||||||||||||||
| உருகுநிலை | 336.53 K, 63.38 °C, 146.08 °F | ||||||||||||||||||||||||||||||
| கொதிநிலை | 1032 K, 759 °C, 1398 °F | ||||||||||||||||||||||||||||||
| மும்மைப் புள்ளி | 336.35 K (63°C), kPa | ||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | 2.33 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | 76.9 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 29.6 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 1 (வலிமையான கார ஒக்சைட்டு) | ||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 0.82 (பாலிங் அளவையில்) | ||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) | 1வது: 418.8 kJ·mol−1 | ||||||||||||||||||||||||||||||
| 2வது: 3052 kJ·mol−1 | |||||||||||||||||||||||||||||||
| 3வது: 4420 kJ·mol−1 | |||||||||||||||||||||||||||||||
| அணு ஆரம் | 227 பிமீ | ||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 203±12 pm | ||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 275 பிமீ | ||||||||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||||||||
| படிக அமைப்பு | body-centered cubic | ||||||||||||||||||||||||||||||
| காந்த சீரமைவு | paramagnetic | ||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) 72 nΩ·m | ||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | 102.5 W·m−1·K−1 | ||||||||||||||||||||||||||||||
| வெப்ப விரிவு | (25 °C) 83.3 µm·m−1·K−1 | ||||||||||||||||||||||||||||||
| ஒலியின் வேகம் (மெல்லிய கம்பி) | (20 °C) 2000 மீ.செ−1 | ||||||||||||||||||||||||||||||
| யங் தகைமை | 3.53 GPa | ||||||||||||||||||||||||||||||
| நழுவு தகைமை | 1.3 GPa | ||||||||||||||||||||||||||||||
| பரும தகைமை | 3.1 GPa | ||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) | 0.4 | ||||||||||||||||||||||||||||||
| பிரிநெல் கெட்டிமை | 0.363 MPa | ||||||||||||||||||||||||||||||
| CAS எண் | 7440-09-7 | ||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: பொட்டாசியம் இன் ஓரிடத்தான் | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||

வரலாறு
சோடியம் மற்றும் பொட்டாசியச் சேர்மங்களை மக்கள் தனிமங்களை அறிவதற்கு முன்பிருந்தே பயன்படுத்தி வந்துள்ளனர். இவற்றின் கார்போனேட்டுக்கள் பழங்காலத்தில் சலவைத் தொழிலில் பயன்படுத்தப்பட்டன. இந்த கார்போனேட்டுக்களைப் பொதுவாக காரங்கள் (alkali) என அழைத்தனர். சோடியம் காபோனேட்டை சோடா என்றும் பொட்டாசியம் கார்போனேட்டை பொட்டாஷ் என்றும் பெயரிட்டனர். 1807 ல் சர் ஹம்ப்ரி டேவி என்ற இங்கிலாந்து நாட்டு வேதியலாளர் பொட்டாஷ்ஷை உருக்கி நீர்மமாக்கி அதை மின்னாற் பகுத்து பொட்டாசியத்தை தனித்துப் பிரித்தெடுத்தார். பொட்டாசியம் எதிர் மின் வாயில் படிந்திருந்தது.மின்பகுப்பு மூலம் பிரித்தெடுக்கப்பட்ட முதல் உலோகம் பொட்டாசியம்.இது கடல் பாசியின் சாம்பலிலிருந்து பெறப்பட்டதால் பொட்டாசியம் என்ற பெயரைப் பெற்றது. லத்தீன் மொழியில் 'காலியம் ' என்று பெயர். இதன் முதல் எழுத்தான K என்பதே பொட்டாசியத்திற்கு வேதிக் குறியீடாக அமைந்தது.காலியம் என்றால் பொட்டாஷ் என்று அர்த்தம்.
பண்புகள்
இயற்பியல் பண்புகள்
பொட்டாசியம் இலேசான, மென்மையான வெள்ளி போன்று வெண்ணிறத்துடன் ஆனால் சற்று நீலம் பாய்ந்த பொலிவுடன் கூடிய உலோகமாகும். காற்று வெளியில் சட்டென மங்கி விடுகிறது. அறை வெப்ப நிலையில் மெழுகு போன்றிருக்கும். இதைக் கம்பியாக நீட்டவும், தகடாக அடிக்கவும் முடியும். இது நேர் மின் வாய் நாட்டமிக்கது. நீரை வெடிச் சத்தத்துடன் பகுத்து ஹைட்ரஜனை வெளியேற்றி பொட்டாசியம் ஹைட்ராக்சைடை உற்பத்தி செய்கிறது. இந்த வினையில் மிகுந்த அளவு வெப்பம் வெளிப்படுவதால் ஹைட்ரஜன் எரிகிறது. பொட்டாசியம் தீச்சுவாலையுடன் வெடிக்கிறது.
வேதிப்பண்புகள்
வேதி வினைகளின் அடிப்படையில் இது சோடியத்தை ஒத்தது என்றாலும் அதைவிட வினைதிறமிக்கது. பொட்டாசியம் கிளர்ச்சியுடன் ஹாலஜன்கள், கந்தகம் மற்றும் ஆக்சிஜனுடன் இணைகிறது. சூடுபடுத்தப்பட்ட பொட்டாசியம், ஆக்ஸிஜனைக் கொண்டுள்ள எல்லா வளிமங்களையும் பகுக்கின்றது. நிலையான போரான், சிலிகான் ஆக்சைடுகள் மற்றும் மக்னீசியம், அலுமினியத்தின் குளோரைடுகள்கூட விதி விலக்கில்லை. சோடியம் போல பொட்டாசியமும் மண்ணெண்னைக்குள் முக்கி பாதுகாக்கப்படுகிறது. நீரில் உடனடியாகத் தீப்பற்றி எரிகிறது. பொட்டசியத்தின் அணு எண் 19, அணு எடை 39.10. இதன் அடர்த்தி 860 கிகி/கமீ. இதன் உருகு நிலையும், கொதி நிலையும் முறையே 336.53 K(63.38 °C),1033 K(759 °C)ஆகும்.
காணப்படும் இடங்கள் மற்றும் உற்பத்தி
பொட்டசியத்தின் உப்புக்களான லாங்பினைட்,பாலிஹாலைட் மற்றும் சில்வைட் போன்றவை பண்டைய ஏரி மற்றும் கடல் படுகைகளில் பரவலாக காணப்படுவதால் வணிக ரீதியில் இதிலிருந்து பொட்டாசியம் உப்புக்கள் பிரித்தெடுக்கபடுகின்றன.பொட்டாசியமானது கனடா, ரஷ்யா, பெலாரஸ், ஜெர்மனி, இஸ்ரேல், அமெரிக்கா, ஜோர்டான், மற்றும் உலகின் மற்ற இடங்களில் வெட்டியெடுக்கப்படுகிறது.மேலும் கனடாவின் சாஸ்கட்சுவான் மாகாணத்தின் தரைக்கு கீழே 1000 மீட்டர் (3000 அடி) பொட்டசியம் அதிக அளவில் காணப்படுகின்றன.மேலும் சாக்கடல் நீரில் பொட்டாசியம் அதிக அளவில் காணப்படுவதால் இஸ்ரேல் மற்றும் ஜோர்டான் நாடுகள் அதிலுருந்து பொட்டசியத்தை தயாரிக்கின்றது.
உற்பத்தி

கார்னலைட்டு, லேங்பெய்னைட்டு, பாலி ஆலைட்டு சில்வைட்டு போன்ற பொட்டாசியம் உப்புகள் பண்டைய ஏரிகளின் அடிப்பகுதி மற்றும் ஆழ்கடல் கடல் கடல் பரப்புகளில் உப்புப்படர் பாறைப்படிவுகளாக உருவாகின்றன. இப்படிவுகள் பொட்டாசியம் உப்புகளை வர்த்தக முறையாக பிரித்தெடுத்து பயன்படுத்துவதை சாத்தியமாக்குகின்றன. பொட்டாசியம் கிடைப்பதற்கான முதன்மையான மூலமாக பொட்டாசு என்ற கனிமம் உதவுகிறது. இது கனடா, உருசியா, பெலாரசு, கசகிசுத்தான், செருமனி, இசுரேல், அமெரிக்கா, யோர்டான் மற்றும் உலகின் பிற பகுதிகளில் இது காணப்படுகிறது. செருமனி நாட்டுக்கு அருகில் முதலாவது பொட்டாசியம் சுரங்கங்க்கள் அமைக்கப்பட்டன. ஆனால் அந்த படிவுகள் இங்கிலாந்தில் தோற்றம் பெற்று செருமனி வழியாக போலந்து வரை அமைந்திருந்தன. சாசுகாட்செவான் என்ற கனடிய மாகாணத்தில் மிகப்பெரிய பொட்டாசு படிவுகள் பூமியில் 1000 மீட்டர்களுக்கு கீழே காணப்பட்டன. இந்த படிவுகள் புவியியல் காலமான மத்திய டெபோனியனில் இருந்த எல்க் பாயின்ட் குழுவில் அமைந்திருந்தன. 1960 களில் தொடங்கி பல பெரிய சுரங்கங்கள் இயங்கிய மேற்கு கனடாவின் சாசுகாட்செவான் மாகாணம் சுரங்கவாய் குழிகள் மூலம் அவற்றை இயக்குவதற்கு உதவும் ஈரமான மணலை உறைய வைக்கும் தொழில் நுட்பத்திற்கு முன்னோடியாக இருந்தது. சாசுகாட்செவான் மாகாணத்தின் பிரதானமான சுரங்கமாக சாசுகாட்செவான் பொட்டாசு நிறுவனம் திகழ்ந்தது. சாக்கடலின் நீரை இசுரேலும் யோர்டானும் பொட்டாசுக்கான ஆதார மூலமாகப் பயன்படுத்தின. அதே சமயம் சாதாரண கடலிலுள்ள பொட்டாசின் செறிவு தற்போதைய விலை நிலவரங்களின்படி வர்த்தக உற்பத்திக்காக இலாபம் தரும் அளவுக்கு போதுமானதாக இல்லை.
சோடியம் மற்றும் மக்னீசியம் சேர்மங்க்களில் இருந்து பொட்டாசியத்தை தனித்துப் பிரித்தெடுக்க பல செயல்முறைகள் பயன்படுத்தப்படுகின்றன. பல்வேறு வெப்ப நிலை வேறுபாடுகளில் அவ்வுப்புகளின் கரைதிறன் வேறுபாடுகளைப் பயன்படுத்திக் கொள்ளும் பகுதி விழ்படிவாக்கல் முறை மிக அதிகமாகப் பயன்படுத்தப்படுகிறது. சில சுரங்கங்க்களில் நிலப்பகுதியில் கிடைக்கும் உப்புக் கலவையிலிருந்து தயாரிக்கும் முறையான நிலைமின்னியல் பிரிப்பு முறையும் பயன்படுத்தப்படுகின்றன. கசடாக உருவாகும் சோடியம் மற்றும் மக்னீசியம் கழிவுகள் பூமிக்கு அடியில் சேமிக்கப்படுகின்றன அல்லது கழிவுக் குவியலாக குவிக்கப்படுகின்றன. இவ்வாறு தோண்டியெடுக்கப்படும் பொட்டாசியம் கனிமம் இறுதியாக செயல்முறைகளின் முடிவில் பொட்டாசியம் குளோரைடாக மாற்றப்பட்டு முடிவடைகிறது. தொழிற்துறையில் இப்பொட்டாசியம் குளோரைடு கனிமத்தை பொட்டாசு என்றும் பொட்டாசியத்தின் முறியேட்டு என்று அழைக்கிறார்கள்.
தூய்மையான பொட்டாசியம் உலோகத்தை மின்னாற்பகுப்பு முறையில் பிரித்தெடுக்க முடியும். 1807 ஆம் ஆண்டில் சர் அம்பரிடேவி பயன்படுத்திய அதே மின்னாற்பகுப்பு முறையே சிற்சில மாற்றங்களுடன் இப்போதும் பயன்படுத்தப்படுகிறது. 1920 களில் இம்மின்னாற்பகுப்பு முறை பொட்டாசியத்தை பெருமளவில் தயாரிக்கும் வகையில் மேம்படுத்தப்பட்டது. பொட்டாசியம் குளோரைடுடன் சோடியத்தை வினைபுரியச் செய்யும் இவ்வெப்பவியல் தொடர்புடைய வினை 1950 களில் பிரபலமாகியது
- Na + KCl → NaCl + K (வெப்பவியல் முறை)
- 2 KF + CaC
2 → 2 K + CaF
2 + 2 C (கிரைசீமர் செயல்முறை)
இவ்வினையின் நேரத்தை மாற்றியமைப்பதன் மூலமும், பயன்படுத்தும் சோடியத்தின் அளவை மாற்றிக் கொள்வதன் மூலமும் சோடியம் பொட்டாசியம் உலோகக் கலவைகள் தயாரிக்கும் வினையும் உடன் நிகழ்கிறது. கிரைசீமெர் செயல்முறையும் பொட்டாசியம் தயரிக்கப் பயன்படுத்தப்படுகிறது. இம்முறையில் பொட்டாசியம் புளோரைடுடன் கால்சியம் கார்பைடு சேர்த்து வினைப்படுத்தப்படுகிறது.
பயன்கள்

மின்னணுவியல்
மின்னணுவியல் துறையில் எலெக்ட்ரான் வால்வுகளை உண்டாக்கும் போது விளக்கினுள் சிறிதளவு பொட்டாசியத்தை இடுவார்கள். விளக்கை மூடிய பின் இது ஆக்சிஜனை எடுத்துக் கொள்வதால் உயரளவு வெற்றிடம் உள்ளே ஏற்படுகிறது.இதன் காரணமாகவே வால்வு வெள்ளிப் பூச்சிட்டது போலத் தோன்றுகிறது.
பொட்டாசியம் ஐதராக்சைடு
பொட்டாசியம் ஐதராக்சைடு என்பது பொட்டாசு. பொட்டாசியம் குளோரைடு கரைசலை மின்னாற்பகுக்கும் போதும் அல்லது பொட்டாசியம் கார்போனேட் மற்றும் சுண்ணாம்பு நீரிலிருந்தும் இதைத் தயாரிக்கலாம். இது மென்மையான சோப்பு தயாரிக்கவும், இதோடு வினை புரியாத வளிமங்களை வறட்சியூட்டவும் பயன்படுகிறது.
உரம்
விவசாயத்திற்குத் தேவையான உரங்களின் உற்பத்தி முறையில் பொட்டாஷ் முக்கியப் பங்கு வகிக்கிறது.
வெடிப்பொருட்கள்
இது ஒரு வலிமையான ஆக்சிஜனூட்டிப் பொருளாகும். பொட்டசியம் குளோரேட்டும், பாஸ்பரசும் கலந்த கலவை பலத்த ஓசையுடன் வெடிக்கிறது. குளோரேட்டை கந்தகத்துடன் கலக்க மோதும் போது வெடிக்கிறது. அடர் மிகு கந்தக அமிலத்துடன் வினை புரிந்து வெடிக்கக் கூடிய குளோரின் பெராக்சைடை விளைவிக்கின்றது. பொட்டசியம் குளோரேட், ஆக்சிஜன் உற்பத்தி முறையில் பயன் படுகின்றது. இது வான வேடிக்கைக்கான வெடிகள், தீக்குச்சிகள், ஒளிப் படத்திற்கான மின்னல் விளக்குகளுக்கான பொடிகள் போன்றவைகள் தயாரிக்கப் பயன்படுகிறது. தொண்டைக்கு தயாரிக்கவும் பயன்படுகின்றன
பிற பயன்கள்
- இயல்பான நரம்புத் தூண்டலுக்கு, நரம்பு செல் சவ்வுகளில் பொட்டாசியம் அயனிகள் கடத்தப்பட வேண்டும். பல்வேறு உடல் செயல்பாடுகள் நிகழ பொட்டாசியம்தான் காரணமாக உள்ளது.இதன் குறைபாட்டால் அதிக ரத்தஅழுத்தம், வழக்கத்துக்கு மாறான இதயத் துடிப்பு, இதயத் துடிப்புத் தூண்டல் கோளாறுகளை ஏற்படுத்தலாம்.
- பொட்டாசியம் குளோரைடு பொட்டாஷ் உற்பத்திக்கும், பொட்டாசியம் புரோமைடு ஒளிப்படச் சுருள்களுக்குத் தேவையான ஒளியுணர் வெள்ளி புரோமைடு உற்பத்திக்கும் பயன்படுகின்றன.
- பொட்டாசியம் புரோமைடு மருத்துவத் துறையில் மயக்க மூட்டியாகப் பயன்படுத்தப்படுகிறது.
- பொட்டாசியம் குளோரேட் குளிர் நீரில் குறைவாகவும் சுடு நீரில் உடனடியாகவும் கரைகிறது. சோடியமும், பொட்டாசியமும் சேர்ந்த கலப்பு உலோகம் வெப்பப் பரிமாற்று ஊடகமாகப் பயன்படுகிறது. ஈனுலைகளில் இதன் நீர்மத்தை குளிர்விப்பானாகப் பயன்படுத்துகின்றார்கள்.
மேற்கோளும் குறிப்புகளும்
புற இணைப்புகள்
- Potassium at The Periodic Table of Videos (University of Nottingham)
- பிரித்தானிக்கா கலைக்களஞ்சியத்தில் Potassium (K)
- https://tamil.thehindu.com/society/kids/article26444394.ece
This article uses material from the Wikipedia தமிழ் article பொட்டாசியம், which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). வேறுவகையாகக் குறிப்பிடப்பட்டிருந்தாலன்றி இவ்வுள்ளடக்கம் CC BY-SA 4.0 இல் கீழ் கிடைக்கும். Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki தமிழ் (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.