ატომი
ატომი (ძვ.
ბერძნ. ἄτομος [atomos] — „განუყოფელი“, „გაუჭრელი“) — ჩვეულებრივი მატერიის შემადგენელი უმცირესი ერთეული, რომელსაც ქიმიური ელემენტის თვისებები გააჩნია. ყოველი მყარი სხეული, სითხე, აირი და პლაზმა შედგება ნეიტრალური ან იონიზირებული ატომებისაგან. ატომები ძალიან მცირე ზომისაა, მათი ჩვეულებრივი ზომა, დაახლოებით, 100 პიკომეტრია (მეტრის ათმემილიარდედი მეტრულ სისტემაში), თუმცა ატომებს მკაფიოდ განსაზღვრული საზღვრები არ გააჩნიათ და არსებობს მათი ზომების განსაზღვრის სხვადასხვა მეთოდი, რომლებიც განსხვავებულ, თუმცა მსგავს შეფასებებს იძლევიან.
| ჰელიუმის ატომი | |
|---|---|
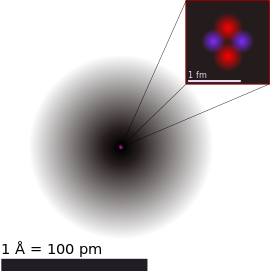 ჰელიუმის ატომის ილუსტრაცია წარმოადგენს ბირთვსა (ვარდისფერი) და ელექტრონული ღრუბლის განაწილებას (შავი). ბირთვი (ზედა მარჯვენა კუთხე) ჰელიუმ-4-ში რეალურად სფერულად სიმეტრიულია და მკვეთრად ჰგავს ელექტრონულ ღრუბელს, თუმცა უფრო რთული ბირთვი ყოველთვის ასეთი არაა. შავი ზოლი ერთი ანგსტრემია (10−10 ან 100 პმ). | |
| კლასიფიკაცია | |
| ქიმიური ელემენტის უმცირესი დადასტურებული ერთეული | |
| მახასიათებლები | |
| მასის არე | 1,67×10−27 კგ-დან 4,52×10−25 კგ-მდე |
| მუხტი | ნული (ნეიტრალური), ან იონური მუხტი |
| დიამეტრის არე | 62-დან (He) 520 პმ-მდე (Cs) |
| კომპონენტები | ელექტრონები და პროტონებისა და ნეიტრონებისაგან შემდგარი ბირთვი |
ატომები საკმარისად პატარებია საიმისოდ, რომ კლასიკურ ფიზიკოსებს თვალსაჩინოდ მცდარი შედეგები მისცეს. ფიზიკის განვითარებასთან ერთად, ატომური მოდელები გაერთიანდნენ კვანტურ პრინციპებში მათი ქცევის უკეთ ახსნისა და პროგნოზირებისათვის.
თითოეული ატომი შედგება ბირთვისა და მასთან დაკავშირებული ერთი ან მეტი ელექტრონისაგან. ბირთვი შედგება ერთი ან მეტი პროტონისა და ჩვეულებრივ, მსგავსი რაოდენობის ნეიტრონებისაგან (პროთიუმს ნეიტრონი არ გააჩნია). პროტონებსა და ნეიტრონებს ნუკლონებს უწოდებენ. ატომის მასის 99,94%-ზე მეტს ბირთვი იკავებს. პროტონებს აქვთ დადებითი მუხტი, ელექტრონებს — უარყოფითი, ხოლო ნეიტრონებს მუხტი არ გააჩნიათ. თუ პროტონებისა და ელექტრონების რაოდენობა ტოლია, მაშინ ატომი ელექტრონეიტრალურია, ხოლო თუ ატომს პროტონების რაოდენობაზე მეტი ან ნაკლები ელექტრონი გააჩნია, მაშინ მას, შესაბამისად, უარყოფითი ან დადებითი მუხტი აქვს. მუხტის მქონე ატომს იონი ეწოდება.
ატომის ელექტრონებს ბირთვში არსებული პროტონები ელექტრომაგნიტური ძალის საშუალებით იზიდავენ. ბირთვში პროტონები და ნეიტრონები ერთმანეთს განსხვავებული ძალებით იზიდავენ. ბირთვული ძალა, რომელიც, ჩვეულებრივ, ელექტრომაგნიტურზე ძლიერია, დადებითად დამუხტულ პროტონებს ერთმანეთისაგან აცალკევებს. გარკვეულ გარემოებებში, საწინააღმდეგო ელექტრომაგნიტური ძალა ბირთვულზე ძლიერი ხდება და შესაძლოა, ნუკლეონები ბირთვიდან გამოდევნოს, რაც ბირთვული გარდაქმნის შედეგად, ერთ ქიმიურ ელემენტს მეორედ აქცევს.
ბირთვში პროტონების რიცხვი განსაზღვრავს თუ რომელ ქიმიურ ელემენტს ეკუთვნის ატომი (მაგალითად, სპილენძის ყველა ატომი 29 პროტონს შეიცავს); ხოლო ნეიტრონთა რიცხვი — ელემენტის იზოტოპს. ელექტრონთა რაოდენობა გავლენას ახდენს ატომის მაგნიტურ თვისებებზე. ატომებს შეუძლიათ დაუკავშირდნენ ერთ ან მეტ ატომს ქიმიური ბმების საშუალებით და წარმოქმნან ისეთი ქიმიური ნაერთი, როგორიცაა მოლეკულა. ატომთა გაერთიანებისა და განცალკევების უნარი ბუნებაში არსებულ ფიზიკურ ცვლილებათა უმეტესობის მიზეზია და ქიმიის შესწავლის საგანს წარმოადგენს.
ატომური თეორიის ისტორია
ატომი ფილოსოფიაში
იდეა, რომ მატერია ცალკეული ნაწილაკებისაგან შედგება, ძალიან ძველია და ჩნდება ისეთ უძველეს კულტურებში, როგორებიცაა ბერძნული და ინდური. სიტყვა „ატომი“ ძველ ბერძენ ფილოსოფოსთაგან იღებს სათავეს, თუმცა იმის მაგივრად, რომ ეს იდეები მტკიცებულებებითა და ექსპერიმენტებით გაემყარებინათ, მათ ფილოსოფიურ და თეოლოგიურ მსჯელობებში იყენებდნენ, რის შედეგადაც მათი შეხედულებები იმის შესახებ თუ რას ჰგავდნენ ატომები და როგორ მოქმედებდნენ ისინი მცდარი იყო. მათ, ასევე, ამის შესახებ ყველას დარწმუნება არ შეეძლოთ, ამიტომაც ატომიზმი მატერიის ბუნების შესახებ არსებულ თეორიათაგან ერთ-ერთად რჩებოდა, სანამ XIX საუკუნეში არ მოხდა მეცნიერთა მიერ ამ იდეის გაზიარება და დახვეწა, როდესაც მეცნიერებისა და ქიმიის აღორძინებამ მრავალი ისეთი აღმოჩენა განაპირობა, რომელთა ახსნაც მხოლოდ ატომების არსებობით იყო შესაძლებელი.
პირველ მტკიცებულებებზე დაფუძნებული თეორია

ადრეულ 1800-იან წლებში, ჯონ დალტონმა ატომების კონცეფცია იმის ასახსნელად გამოიყენა, თუ რატომ რეაგირებენ ქიმიური ელემენტები ყოველთვის მცირე მთელი რიცხვების პროპორციებად (ჯერად ფარდობათა კანონი). მაგალითად, არსებობს ორი ტიპის კალის ოქსიდი: პირველი მათგანი შეიცავს 88,1% კალასა და 11,9% ჟანგბადს, ხოლო მეორე — 78,7% კალასა და 21,3% ჟანგბადს (შესაბამისად, კალა (II)-ის ოქსიდი და კალის დიოქსიდი). ეს ნიშნავს, რომ 100 გრამი კალა უერთდება 13,5 ან 27 გრამ ჟანგბადს. 13,5 და 27 1:2-ის შესაბამისი პროპორციაა, რაც მცირე მთელი რიცხვების თანაფარდობას წარმოადგენს. ქიმიისათვის საერთო ამ ნიმუშმა დალტონს მიანიშნა, რომ ელემენტები ერთმანეთთან შემადგენელი ნაწილების, სხვა სიტყვებით, ატომების მთელი რიცხვების ჯერადი რაოდენობებით რეაგირებდნენ. კალის ოქსიდების შემთხვევაში, კალის ერთი ატომი უერთდებოდა ჟანგბადის ერთ ან ორ ატომს.
დალტონს სჯეროდა, რომ ატომურ თეორიას შეეძლო აეხსნა თუ რატომ შთანთქავდა წყალი სხვადასხვა აირს სხვადასხვა პროპორციით. მაგალითად, მან დაადგინა, რომ წყალი გაცილებით უკეთ შთანთქავდა ნახშირორჟანგს, ვიდრე აზოტს. დალტონმა ივარაუდა, რომ ეს გამოწვეული იყო აირების შესაბამისი ნაწილაკების მასებსა და სირთულეებს შორის არსებული განსხვავებით. მართლაც, ნახშირორჟანგის მოლეკულები (CO2) უფრო დიდები და მძიმეებია, ვიდრე აზოტის მოლეკულები (N2).
ბროუნის მოძრაობა
1827 წელს, ბოტანიკოსმა რობერტ ბროუნმა, რომელიც მიკროსკოპის გამოყენებით წყალში მოტივტივე მტვრის მარცვლებს აკვირვებოდა, აღმოაჩინა, რომ მათი მოძრაობა თითქმის მთლიანად არაპროგნოზირებადი იყო. ეს ფენომენი „ბროუნის მოძრაობის“ სახელითაა ცნობილი. იფიქრეს, რომ ეს მარცვლებზე წყლის მოლეკულების მოქმედებით იყო გამოწვეული. 1905 წელს ალბერტ აინშტაინმა დაამტკიცა სიმართლე ამ მოლეკულებისა და მათი მოძრაობის შესახებ ბროუნის მოძრაობის პირველი სტატისტიკური ფიზიკის ანალიზის წარმოების შედეგად. ფრანგმა ფიზიკოსმა ჟან ბატისტ პერენმა ატომთა მასებისა და ზომების ექსპერიმენტალურად განსასაზღვრად აინშტაინის ნაშრომი გამოიყენა, რითაც საბოლოოდ დადასტურდა დალტონის ატომური თეორია.
ელექტრონის აღმოჩენა

მაღლა: მოსალოდნელი შედეგი: ალფა ნაწილაკი გადის ატომის ქიშმიშიანი პუდინგის მოდელში უმნიშვნელო გადახრით.
დაბლა: დაკვირვებული შედეგი: ნაწილაკთა მცირე ნაწილი გარდატყდა ბირთვის კონცენტრირებული დადებითი მუხტის მიერ.
ფიზიკოსმა ჯოზეფ ჯონ ტომსონმა გაზომა კათოდური სხივები, რამაც აჩვენა, რომ ისინი ნაწილაკებისაგან შედგებოდნენ, თუმცა ეს უკანასკნელი დაახლოებით 1800-ჯერ უფრო მსუბუქი იყო ვიდრე ყველაზე მსუბუქი, წყალბადის, ატომი. აქედან გამომდინარე, ის არა ატომს, არამედ ახალ ნაწილაკს წარმოადგენდა, პირველ აღმოჩენილ სუბატომურ ნაწილაკს, რომელსაც მან, თავდაპირველად, „უმცროსი ნაწილაკი“ (corpuscle) უწოდა, თუმცა მოგვიანებით მას ელექტრონი დაარქვეს მას შემდეგ, რაც 1874 წელს ჯორჯ ჯონსონ სტონიმ ნაწილაკები პოსტულატებად წარადგინა. მან, ასევე, ისიც აჩვენა, რომ ისინი ფოტოელექტრული და რადიოაქტიური მატერიალებიდან გამოვლენილი ნაწილაკების იდენტურები იყვნენ. მალევე დადგინდა, რომ ისინი ის ნაწილაკები იყვნენ, რომლებსაც მეტალის მავთულებში ელექტრული დენი გადაჰქონდათ და გააჩნდათ უარყოფითი მუხტი ატომის შიგნით. ტომსონმა ამ ნაშრომისათვის 1906 წელს ნობელის პრემია მიიღო ფიზიკის დარგში. ამდენად, მან შეცვალა წარმოდგენა იმის შესახებ, რომ ატომი მატერიის საბოლოო, განუყოფელი ნაწილაკი იყო. ტომსონმა არასწორად ჩამოაყალიბა მოსაზრება, რომ მცირე მასის, უარყოფითად დამუხტული ელექტრონები მთელ ატომში, დადებითი მუხტის ერთგვაროვან ზღვაში იყვნენ გადანაწილებულები. იგი ქიშმიშიანი პუდინგის მოდელის სახელით გახდა ცნობილი.
ბირთვის აღმოჩენა
1909 წელს, ჰანს გაიგერი და ერნესტ მარსდენი, ერნესტ რეზერფორდის ხელმძღვანელობით, მეტალის ფოლგას ალფა ნაწილაკებით „ბომბავდნენ“ იმაზე დაკვირვებისათვის, თუ როგორ გაიფანტებოდნენ ისინი. ისინი მოელოდნენ, რომ ყველა ალფა ნაწილაკი შეძლებდა მასში გავლას მცირედი გადახრით, რადგანაც ტომსონის მოდელის მიხედვით, მუხტები ატომში იმდენად დიფუზიური იყო, რომ მათ ელექტრულ ველებს არ შეეძლოთ ალფა ნაწილაკის მიმართულებაზე მნიშვნელოვანი გავლენის მოხდენა, თუმცა, გაიგერისა და მარსდენის საკვლევი ალფა ნაწილაკებიდან ზოგიერთი 90°-ზე მეტი კუთხით გადაიხარა საწყისი მიმართულებიდან, რაც ტომსონის მოდელის მიხედვით, შეუძლებელი უნდა ყოფილიყო. ამის ასახსნელად, რეზერფორდმა წამოაყენა ვარაუდი, რომ ატომის დადებითი მუხტი კონცენტრირებული უნდა ყოფილიყო მის ცენტრში მდებარე პატარა ბირთვში.
იზოტოპების აღმოჩენა
რადიოაქტიური დაშლის პროდუქტებზე ექსპერიმენტებისას, 1913 წელს რადიოქიმიკოსმა ფრედერიკ სოდიმ აღმოაჩინა, რომ პერიოდული ცხრილის თითოეულ განყოფილებაში ერთზე მეტი ტიპის ატომი არსებობდა. ტერმინი „იზოტოპი“ შეიმუშავა მარგარეტ ტოდმა, როგორც შესაბამისი სახელი ერთი ელემენტის განსხვავებული ატომებისათვის. ჯოზეფ ჯონ ტომსონმა შექმნა ტექნიკა იონიზირებულ აირებზე მისი მუშაობისას ატომთა ტიპების განსაცალკევებლად, რამაც სტაბილური იზოტოპის აღმოჩენის საფუძველი შექმნა.
ბორის მოდელი

1913 წელს ფიზიკოსმა ნილს ბორმა წარმოადგინა მოდელი, რომელშიც ატომის ელექტრონები ბირთვის ორბიტალებზე მოძრაობდნენ, თუმცა ეს მხოლოდ ორბიტალთა განსაზღვრულ რაოდენობაში შეიძლებოდა. მათ ერთი ორბიტალიდან მეორეზე გადახტომაც შეეძლოთ, თუმცა მხოლოდ ნაწილაკალური ენერგიის სათანადო ცვლილებით, ფოტონის შთანთქმით ან გამოსხივებით. ეს კვანტირება გამოყენებულ იქნა იმის ასახსნელად, თუ რატომაა ელექტრონების ორბიტალები სტაბილური (იმის გათვალისწინებით, რომ მუხტები აჩქარებისას, წრიული მოძრაობის ჩათვლით, კარგავენ კინეტიკურ ენერგიას, რომელიც ელექტრომაგნიტური რადიაციის სახით გამოსხივდება) და რატომ შთანთქავენ და ასხივებენ ელემენტები ელექტრომაგნიტურ რადიაციას ცალკეულ სპექტრში.
მოგვიანებით, იმავე წელს ჰენრი მოზლიმ დამატებითი ექსპერიმენტული მტკიცებულებები წარადგინა ბორის თეორიის სასარგებლოდ. ამ შედეგებით დაიხვეწა ერნესტ რეზერფორდისა და ანტონიუს ვან დენ ბრუკის მოდელი, რომლის მიხედვითაც, ატომი თავის ბირთვში შეიცავს დადებითი ბირთვის მუხტის რიცხვს, რომელიც მისი (ატომური) ნომრის ტოლია პერიოდულ ცხრილში. ამ ექსპერიმენტებამდე, ატომური ნომერი ცნობილი არ იყო, როგორც ფიზიკური და ექსპერიმენტალური რაოდენობა. ის, რომ ატომური ნომერი ატომის ბირთვის მუხტის ტოლია, დღეს აღიარებულ ატომურ მოდელად რჩება.
ქიმიური ბმის ახსნა
ქიმიური ბმები ატომებს შორის 1916 წელს გილბერტ ნიუტონ ლევისის მიერ უკვე ახსნილი იყო, როგორც ურთიერთმოქმედება მათ შემადგენელ ელექტრონებს შორის. რადგანაც ცნობილი იყო, რომ ელემენტთა ქიმიური თვისებები დიდწილად მეორდებოდა პერიოდულობის კანონის მიხედვით, 1919 წელს ამერიკელმა ქიმიკოსმა ირვინგ ლენგმიურმა ივარაუდა, რომ ეს შესაძლოა ახსნილიყო იმ შემთხვევაში, თუ ატომში ელექტრონები დაკავშირებული ან დაჯგუფებულები იქნებოდნენ გარკვეული წესით. ფიქრობდნენ, რომ ელექტრონთა ჯგუფებს ეკავათ ელექტრონული გარსი ბირთვის მახლობლად.
შემდგომი განვითარება კვანტურ ფიზიკაში
1922 წელს ჩატარებულმა შტერნ-გერლახის ექსპერიმენტმა კიდევ უფრო სიღრმისეული მტკიცებულებები გამოავლინა ატომის კვანტური ბუნების დასასაბუთებლად. როდესაც ვერცხლის ატომთა სხივი სპეციალური ფორმის მაგნიტურ ველში გაატარეს, სხივი ატომის კუთხური მომენტის, სპინის, მიმართულების საფუძველზე გაიყო. რადგანაც ეს მიმართულება შემთხვევითია, შესაძლოა მოსალოდნელი ყოფილიყო, რომ სხივი სწორხაზოვნად გავრცელდებოდა, თუმცა იგი ორ ნაწილად გაიყო, იმის მიხედვით, ზემოთ იყო ორიენტირებული ატომის სპინი თუ ქვემოთ.
1924 წელს, ლუი დე ბროილმა გამოთქვა მოსაზრება, რომ ყველა ნაწილაკს ტალღური ბუნება გააჩნდა. 1926 წელს, ერვინ შრედინგერმა ეს იდეა ატომის მათემატიკური მოდელის განსავითარებლად გამოიყენა, რომელიც ელექტრონებს სამგანზომილებიან ტალღის ფორმებად აღწერდა და არა წერტილოვან ნაწილაკებად. ნაწილაკთა აღსაწერად ტალღის ფორმების გამოყენების შედეგია ის, რომ ნაწილაკის პოზიციისა და იმპულსის ზუსტი მნიშვნელობების დროულად მიღება მოცემულ წერტილში მათემატიკურად შეუძლებელია. ეს განუზღვრელობის პრინციპის სახელით გახდა ცნობილი, რომლის ფორმულირებაც 1926 წელს ვერნერ ჰაიზენბერგმა მოახდინა. ეს კონცეფცია, პოზოციის გაზომვაში მოცემული სიზუსტით მხოლოდ იმპულსის შესაძლო მნიშვნელობის არეალის მიღების შესაძლებლობას იძლევა და პირიქით. წინა მოდელებისაგან განსხვავებით, ამ უკანასკნელმა შეძლო აეხსნა ატომის ქცევის დაკვირვებები, როგორიცაა წყალბადზე დიდი ატომების გარკვეული სტრუქტურული და სპექტრალური ნიმუშები. აქედან გამომდინარე, ატომის პლანეტარული მოდელი დაიწუნეს მის სასარგებლოდ, რომელიც აღწერდა ატომური ორბიტალების ზონებს ბირთვის გარშემო, სადაც მოცემული ელექტრონის ყოფნის მეტი ალბათობა არსებობდა.
ნეიტრონის აღმოჩენა
მას-სპექტრომეტრის განვითარებამ შექმნა შესაძლებლობა, რომ ატომთა მასები გაზრდილი სიზუსტით შეფასებულიყო. ეს ხელსაწყო იყენებს მაგნიტს იონთა სხივის ტრაექტორიის შესაცვლელად და გარდატეხის რაოდენობა აიხსნება ატომის მასის შეფარდებით მის მუხტთან. ქიმიკოსმა ფრენსის ასტონმა ეს ინსტრუმენტი იმის საჩვენებლად გამოიყენა, რომ იზოტოპებს განსხვავებული მასები ჰქონდათ. ამ იზოტოპთა ატომური მასები მერყეობდნენ მთელ რიცხვით რაოდენობებს შორის, რასაც მთელ რიცხვთა წესი უწოდეს. იზოტოპებს შორის არსებული ამ სხვაობის ახსნა ვერ მოხერხდა 1932 წელს ფიზიკოს ჯეიმზ ჩედვიკის მიერ ნეიტრონის, ელექტრონეიტრალური ნაწილაკის აღმოჩენამდე, რომელსაც პროტონის მსგავსი მასა აქვს. შემდგომ იზოტოპები განმარტეს, როგორც ელემენტები ერთი რაოდენობის პროტონებითა და ნეიტრონთა განსხვავებული რიცხვით ბირთვში.
გახლეჩა, მაღალენერგიული ფიზიკა და კონდენსირებული მატერია
1938 წელს, გერმანელმა ქიმიკოსმა ოტო ჰანმა, რეზერფორდის მოსწავლემ, ტრანსურანული ელემენტის მიღების მოლოდინით, ნეიტრონები ურანის ატომზე მიმართა, თუმცა, ამის ნაცვლად, მისმა ქიმიურმა ექსპერიმენტმა პროდუქტად ბარიუმი გამოავლინა. ერთი წლის შემდეგ, ლიზა მაიტნერმა და მისმა დისშვილმა ოტო ფრიშმა დაადგინეს, რომ ჰანის შედეგი წარმოადგენდა პირველ ექსპერიმენტალურ ბირთვულ გახლეჩას. 1944 წელს ჰანმა ქიმიაში ნობელის პრემია მიიღო. მიუხედავად მისი მცდელობისა, მაიტნერისა და ფრიშის წვლილი არ უღიარებიათ.
1950-იან წლებში, გაუმჯობესებული ნაწილაკთა ამაჩქარებლებისა და ნაწილაკთა დეტექტორების განვითარებამ მეცნიერებს საშუალება მისცა შეესწავლათ მაღალი ენერგიით მოძრავი ატომების ზემოქმედება. აღმოჩნდა, რომ ნეიტრონები და პროტონები ჰადრონები იყვნენ ან უფრო მცირე ნაწილაკებისაგან, კვარკებისაგან, შემდგარ კომპოზიტებს წარმოადგენდნენ. ნაწილაკალური ფიზიკის სტანდარტული მოდელი იმდენად განვითარდა, რომ წარმატებით ახსნა ბირთვის მახასიათებლები, იმ სუბატომური ნაწილაკებისა და ძალების საზღვრებში, რომლებიც მათ ურთიერთქმედებას განაპირობებდნენ.
სტრუქტურა

სუბატომური ნაწილაკები
მიუხედავად იმისა, რომ სიტყვა „ატომი“, თავდაპირველად, აღნიშნავდა ნაწილაკს, რომლის გაყოფაც უფრო მცირე ნაწილაკებად შეუძლებელია, თანამედროვე სამეცნიერო გამოყენებაში ატომი შედგება სხვადასხვა სუბატომური ნაწილაკისაგან. ატომის შემადგენელი ნაწილაკებია ელექტრონი, პროტონი და ნეიტრონი; სამივე მათგანი ფერმიონს წარმოადგენს, თუმცა წყალბად-1-ის ატომს არ გააჩნია ნეიტრონი, ჰიდრონის იონს კი — ელექტრონი.
ამ ნაწილაკებიდან ელექტრონი ყველაზე ნაკლებად მასიურია. მისი მასა 9,11−31 კგ-ია; გააჩნია უარყოფითი ელექტრული მუხტი, ხოლო მისი ზომა იმდენად მცირეა, რომ თანამედროვეობაში ხელმისაწვდომი ტექნოლოგიებით მისი გაზომვა შეუძლებელია. იგი წარმოადგენს ყველაზე მსუბუქ ნაწილაკს დადებითად გაზომილი უძრაობის მასით. ჩვეულებრივ პირობებში, ელექტრონი დადებითად დამუხტულ ბირთვთან საპირისპირო მუხტების ქონის გამო წარმოქმნილი მიზიდულობითაა დაკავშირებული. თუ ატომს მის ატომურ ნომერზე მეტი ან ნაკლები ელექტრონი გააჩნია, მაშინ იგი, მთლიანობაში, შესაბამისად, უარყოფით ან დადებით მუხტს იძენს. დამუხტულ ატომს იონი ეწოდება. ელექტრონი გვიანდელი XIX საუკუნიდანაა ცნობილი, რაც, მეტწილად, ჯოზეფ ჯონ ტომსონის დამსახურებაა (დეტალებისათვის იხილეთ სუბატომური ფიზიკის ისტორია).
პროტონს გააჩნია დადებითი მუხტი და ელექტრონისაზე 1 836-ჯერ მეტი მასა, რაც 1,6726−27 კგ-ს შეადგენს. პროტონთა რიცხვს ატომში მისი ატომური ნომერი ეწოდება. ერნესტ რეზერფორდმა (1919 წ.) აღმოაჩინა, რომ ალფა ნაწილაკებით „დაბომბვის“ პირობებში, აზოტი გამოდევნის რაღაცას, რაც, როგორც დადგინდა, წყალბადის ბირთვი იყო. 1920 წლისათვის მან გააცნობიერა, რომ წყალბადის ბირთვი ატომის შემადგენელ ნაწილაკს წარმოადგენდა და მას პროტონი უწოდა.
ნეიტრონს ელექტრული მუხტი არ გააჩნია, მისი მასა კი ელექტრონისაზე 1 839-ჯერ მეტია და 1,6929−27 კგ-ს შეადგენს. იგი ატომის შემადგენელ სამ ნაწილაკს შორის ყველაზე მძიმეა, თუმცა, შესაძლოა, შემცირდეს ბირთვული დამაკავშირებელი ძალის მიერ. ნეიტრონსა და პროტონს (ერთობლივად ნუკლოები) გააჩნიათ შედარებითი განზომილებები (2,5−15 მ-ის ფარგლებში), თუმცა ამ ნაწილაკთა „ზედაპირი“ ზუსტად გარკვეული არ არის. ნეიტრონი 1932 წელს ინგლისელმა ფიზიკოსმა ჯეიმზ ჩედვიკმა აღმოაჩინა.
ფიზიკის სტანდარტულ მოდელში ელექტრონი ჭეშმარიტად ელემენტარული ნაწილაკია შიდა სტრუქტურის გარეშე, თუმცა, როგორც პროტონი, ასევე, ნეიტრონი შედგენილ ნაწილაკებს წარმოადგენენ, რომლებიც კვარკის სახელით ცნობილი ელემენტარული ნაწილაკებით არიან აგებულნი. ატომში ორი სახის კვარკი არსებობს, თითოეულ მათგანს დანაწევრებული ელექტრული მუხტი გააჩნია. პროტონი შედგენილია ორი U-კვარკისა (თითოეულის მუხტია +⅔) და ერთი D-კვარკისაგან (მუხტი — -⅓), ხოლო ნეიტრონი — ერთი U-კვარკისა და ორი D-კვარკისაგან. ეს სხვაობა მოითვლება ამ ორი ნაწილაკის მასებსა და მუხტებს შორის არსებული განსხვავებისათვის.
კვარკები ერთმანეთთან დაკავშირებულია ძლიერი ურთიერთქმედებით (ან ძლიერი ძალით), რომლის შუამავლების როლსაც გლიუონები ასრულებენ. პროტონი და ნეიტრონი, თავის მხრივ, ბირთვში ერთმანეთთან ბირთვული ძალით არიან დაკავშირებულნი, რომელიც ძლიერი ძალის ნარჩენს წარმოადგენს და ახასიათებს რაღაც განსხვავება მოქმედების რადიუსის თვისებების თვალსაზრისით. გლიუონი მიეკუთვნება კალიბრული ბოზონების ოჯახს, რომლებიც ფიზიკურ ძალათა შუამავალ ელემენტარულ ნაწილაკებს წარმოადგენენ.
ბირთვი
ატომში არსებული ყველა შეკავშირებული პროტონი და ნეიტრონი ქმნის უმცირეს ატომბირთვს. მათ მთლიანობაში, ნუკლონებს უწოდებენ. ბირთვის რადიუსი, დაახლოებით, 1,07 3√A ფმ-ის ტოლია, სადაც A ნუკლონთა საერთო რაოდენობაა. იგი გაცილებით მცირეა, ვიდრე ატომის რადიუსი, რომელიც 105 ფმ-ის ფარგლებშია. ნუკლონები ნარჩენი ძლიერი ძალის სახელით ცნობილი მცირე დისტანციაზე მოქმედი მიზიდულობის პოტენციალით არიან ერთად შეკავშირებულნი. 2,5 ფმ-ზე მცირე მანძილზე ეს ძალა ელექტროსტატიკურ ძალაზე ბევრად ძლიერია, რაც იწვევს დადებითად დამუხტული პროტონების ურთიერთგანზიდვას.
ერთი ელემენტის ატომებს პროტონთა ერთნაირი რაოდენობა აქვთ, რასაც ატომური ნომერი ეწოდება, თუმცა, იმავე ელემენტის ატომებში ნეიტრონთა რიცხვი, შესაძლოა, განსხვავდებოდეს, რაც ელემენტის იზოტოპის განმსაზღვრელია. პროტონთა და ნეიტრონთა მთლიანი რიცხვი ნუკლიდის განმსაზღვრელია. პროტონების რაოდენობასთან მიახლოვებული ნეიტრონთა რიცხვი ბირთვის სტაბილურობას განსაზღვრავს. გარკვეული იზოტოპები რადიოაქტიურ დაშლას განიცდიან.
პროტონი, ელექტრონი და ნეიტრონი კლასიფიცირდებიან, როგორც ფერმიონები. ფერმიონები ემორჩილებიან პაულის აკრძალვის პრინციპს, რომელიც კრძალავს იდენტური ფერმიონების მიერ, როგორებიცაა მრავალრიცხოვანი პროტონები, ერთსა და იმავე დროს ერთი და იგივე კვანტური მდგომარეობის დაკავებას. ამდენად, ბირთვის ყველა პროტონმა უნდა დაიკავოს ყველა სხვა პროტონისაგან განსხვავებული კვანტური მდგომარეობა. იგივე ეხება ბირთვის ყველა ნეიტრონსა და ელექტრონული ღრუბლის ყველა ელექტრონს, თუმცა პროტონსა და ნეიტრონს შეუძლიათ ერთნაირი კვანტური მდგომარეობის დაკავება.
დაბალი ატომური ნომრის მქონე ატომების ბირთვები, რომელთაც პროტონებზე მეტი ნეიტრონები გააჩნიათ, მიდრეკილნი არიან დაეცნენ ენერგიის ქვედა დონეზე რადიოაქტიური დაშლის საშუალებით, რათა მათი პროტონ-ნეიტრონული თანაფარდობა ერთს მიუახლოვდეს. თუმცა, ატომური ნომრის ზრდასთან ერთად, პროტონთა ორმხრივი განზიდვის დასაკომპენსირებლად, ნეიტრონთა მაღალი თანაფარდობაა საჭირო. აქედან გამომდინარე, არ არსებობს 20-ზე მაღალი ატომური ნომრის მქონე (Z = 20, კალციუმი) სტაბილური იზოტოპი პროტონებისა და ნეიტრონების თანაბარი რაოდენობით. Z-ის ზრდასთან ერთად, სტაბილური იზოტოპის პროტონ-ნეიტრონული თანაფარდობაც იზრდება. უმაღლესი პროტონ-ნეიტრონული თანაფარდობის მქონე სტაბილური იზოტოპია ტყვია-208 (დაახლოებით 1,5).

ატომბირთვში პროტონებისა და ნეიტრონების რაოდენობის შეცვლა შესაძლებელია, თუმცა ძლიერი ძალის არსებობის გამო, ამას ძალიან დიდი ენერგია სჭირდება. ბირთვული შეერთება ხდება მაშინ, როდესაც მრავალი ატომური ნაწილაკი ერთიანდება უფრო მძიმე ბირთვის შესაქმნელად, როგორიცაა, ორი ბირთვის ენერგეტიკული შეჯახება. მაგალითად, მზის ბირთვთან პროტონები საჭიროებენ 3-10 კილოელექტრონვოლტ ენერგიას მათი საზიარო განზიდვის დასაძლევად (კულონის ბარიერი) და ერწყმიან ერთმანეთს ბირთვის წარმოქმნით. ბირთვული გახლეჩა საწინააღმდეგო პროცესს წარმოადგენს, იგი ბირთვის ორ უფრო მცირე ბირთვად გაყოფას იწვევს, ჩვეულებრივ, რადიოაქტიური დაშლისას. ბირთვი, ასევე, შესაძლოა, შეიცვალოს დიდი ენერგიის მქონე სუბატომური ნაწილაკებით ან ფოტონებით „დაბომბვით“. თუ ეს იწვევს პროტონთა რიცხვის ცვლილებას ბირთვში, ატომი სხვა ქიმიურ ელემენტად გადაიქცევა.
თუ შეერთების რეაქციის შემდეგ ბირთვის მასა ნაკლებია ცალკეული ნაწილაკების მასათა ჯამისა, მაშინ ამ ორ მნიშვნელობას შორის არსებული სხვაობა, შესაძლოა, გამოსხივდეს გამოყენებადი ენერგიის სახით (როგორიცაა გამა-გამოსხივება ან ბეტა ნაწილაკის კინეტიკური ენერგია), რასაც აღწერს ალბერტ აინშტაინის მასა-ენერგიის ეკვივალენტობის ფორმულა E = mc2, სადაც m მასის სხვაობაა, ხოლო c — სინათლის სიჩქარე. ეს დეფიციტი ახალი ბირთვის შემაკავებელი ენერგიის ნაწილია და ის ენერგიის აუნაზღაურებელ დანაკარგს წარმოადგენს, რომლის შედეგიცაა შერწყმული ნაწილაკების მთლიანობის შენარჩუნება იმ მდგომარეობაში, რომელიც საჭიროებს ამ ენერგიის გამოყოფას.
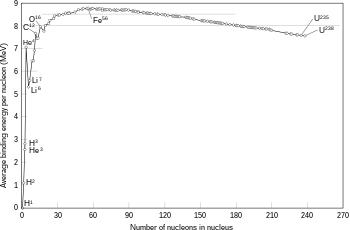
ორი ბირთვის შეერთება, რომელიც წარმოქმნის უფრო დიდ ბირთვს უფრო მცირე ატომური ნომრით ვიდრე რკინა და ნიკელია (ნოკლონთა მთლიანი რიცხვი, დაახლოებით 60), ჩვეულებრივ, ეგზოთერმული პროცესია, რომელიც გამოათავისუფლებს უფრო მეტ ენერგიას, ვიდრე ეს მათ ერთად შესაკრებადაა საჭირო. სწორედ ეს ენერგოგამომყოფი პროცესია ის, რაც ვარსკვლავებში ბირთვულ შეერთებას თვითწარმმართველ რეაქციად აქცევს. უფრო მძიმე ბირთვისათვის, შემაკავებელი ენერგია თითოეულ ნუკლონზე ბირთვში შემცირებას იწყებს. ეს ნიშნავს, რომ შეერთების რეაქცია, რომელიც წარმოქმნის ბირთვს, რომელსაც, დაახლოებით, 26-ზე მაღალი ატომური ნომერი და დაახლოებით, 60-ზე მაღალი ატომური მასა გააჩნია, ენდოთერმულ პროცესს წარმოადგენს. ამ ბევრად მასიურმა ბირთვმა არ შეიძლება არ განიცადოს ენერგოწარმომქმნელი შეერთების რეაქცია, რომელმაც, შესაძლოა გააძლიეროს ვარსკვლავის ჰიდროსტატიკური წონასწორობა.
ელექტრონული ღრუბელი
ატომში ელექტრონები ბირთვში არსებულ პროტონებთან ელექტრომაგნიტური ძალით არიან მიზიდულები. ეს ძალა ელექტრონებს ელექტროსტატიკურ პოტენციალის ორმოში აკავებს, რომელიც უფრო მცირე ზომის ბირთვს აკრავს გარს, რაც ნიშნავს, რომ ელექტრონს აქედან გასაღწევად ენერგიის გარე წყარო სჭირდება. რაც უფრო ახლოსაა ელექტრონი ბირთვთან, მით უფრო დიდია მიზიდულობის ძალა. აქედან გამომდინარე, ელექტრონს, რომელიც პოტენციალის ორმოს ცენტრის ახლოსაა, თავის დასაღწევად უფრო მეტი ენერგია სჭირდება, ვიდრე მათ, რომლებიც მეტად არიან დაშორებულნი.
სხვა ნაწილაკების მსგავსად, ელექტრონსაც ახასიათებს როგორც ნაწილაკის, ასევე, ტალღის თვისებები. ელექტრონული ღრუბელი არის რეგიონი პოტენციურ ორმოში, სადაც თითოეული ელექტრონი ქმნის სამგანზომილებიანი მდგრადი ტალღის ტიპს — ტალღის ფორმას, რომელიც არ მოძრობს ბირთვის მიმართ. ეს ქცევა განისაზღვრება ატომური ორბიტალის, მათემატიკური ფუქნციის მიერ, რომელიც ახასიათებს იმის ალბათობას, რომ ელექტრონი, როგორც ჩანს, უნდა იყოს კონკრეტულ წერტილში, როდესაც მისი პოზიცია გაზომილია. ბირთვის ირგვლივ ამ ორბიტალთა მხოლოდ დისკრეტული (ან კვანტიზებული) ნაკრები არსებობს, რამდენადაც სხვა შესაძლო ტალღური ნიმუშები სწრაფად იშლებიან უდრო სტაბილურ ფორმებად. ორბიტალებს, შესაძლოა, ჰქონდეთ ერთი ან მეტი რკალური ან კვანძური სტრუქტურა. ისინი ერთმანეთისაგან ზომით, ფორმითა და ორიენტაციით განსხვავდებიან.

თითოეულ ატომური ორბიტალი შეესაბამება ელექტრონის კონკრეტულ ენერგეტიკულ დონეს. ელექტრონს შეუძლია შეიცვალოს მდგომარეობა ფოტონის შთანთქმით, რაც წარმოადგენს საკმარის ენერგიას მის ახალ კვანტურ მდგომარეობამდე გასაზრდელად. აგრეთვე, სპონტანური გამოფრქვევისას მაღალ ენერგეტიკულ დონეზე მყოფ ელექტრონს შეუძლია უფრო დაბალ დონეზე ჩავარდნა, რის დროსაც ასხივებს ჭარბ ენერგიას ფოტონის სახით. ეს დამახასიათებელი ენერგეტიკული მნიშვნელობები, რომლებიც კვანტური მდგომარეობის ენერგიებს შორის არსებული სხვაობებითაა განსაზღვრული, პასუხისმგებელნი არიან ატომის სპექტრულ ხაზებზე.
ელექტრონის მოსაშორებლად ან დასამატებლად საჭიროა ელექტრონის შემაკავებელი ენერგია, რომელიც ბევრად ნაკლებია ნუკლონთა შემაკავებელ ენერგიაზე. მაგალითად, წყალბადის ატომისაგან არააღგზნებული ელექტრონის მოსაწყვეტად 13,6 ევ-ია საჭირო, ხოლო დეიტერიუმის ბირთვის გასახლეჩად — 2,23 მილიონი ევ. ატომი ელექტრულად ნეიტრალურია, თუ მას პროტონებისა და ნეიტრონების თანაბარი რაოდენობა აქვს. ატომს, რომელსაც ელექტრონის მეტი ან ნაკლები რიცხვი გააჩნია, იონი ეწოდება. ბირთვიდან ყველაზე მეტად დაშორებულმა ელექტრონმა, შესაძლოა, რომელიმე ახლოს მყოფი ატომის ორბიტალზე გადაინაცვლოს ან გახდეს საზიარო მათ შორის. ამ მექანიზმის საშუალებით, ატომებს შეუძლიათ დაამყარონ ქიმიური ბმა და შექმნან მოლეკულები და ქიმიურ ნივთიერებათა სხვა ტიპები, როგორებიცაა კრისტალების იონური და კოვალენტური ქსელი.
მახასიათებლები
ბირთვული მახასიათებლები
განსაზღვრების მიხედვით, ნებისმიერი ორი ატომი პროტონთა იდენტური რიცხვით ბირთვში ერთ ქიმიურ ელემენტს მიეკუთვნება. ატომები პროტონთა ტოლი რიცხვით, მაგრამ ნეიტრონთა განსხვავებული რაოდენობით, ერთი ქიმიური ელემენტის სხვადასხვა იზოტოპებს წარმოადგენენ. მაგალითად, წყალბადის ყველა ატომს ზუსტად ერთი პროტონი აქვს, თუმცა არსებობენ იზოტოპები ნეიტრონის გარეშე (წყალბად-1, ყველაზე გავრცელებული ფორმაა, ასევევ, პროთიუმსაც უწოდებენ), ერთი ნეიტრონით (დეიტერიუმი), ორი ნეიტრონით (ტრითიუმი) და ორზე მეტი ნეიტრონით. დღეისათვის ცნობილი ელემენტები ქმნიან ატომურ ნომერთა ნაკრებებს ერთპროტონიანი ელემენტიდან (წყალბადი) 118 პროტონიან ელემენტამდე (უნუნოქტიუმი). ყველა ცნობილი იზოტოპი იმ ელემენტებისა, რომელთა ატომური ნომერი 82-ზე მეტია, რადიოაქტიურია.
დედამიწაზე, ბუნებრივად, დაახლოებით 339 იზოტოპი გვხვდება, რომელთაგან 254-ს (დაახლოებით 75 %) დაშლა არ აღენიშნება და განიხილავენ, როგორც „სტაბილურ იზოტოპებს“, თუმცა მხოლო 90 მათგანია სტაბილური ყველა დაშლის მიმართ თეორიულადაც კი. დანარჩენი 164-ს (254-დან) დაშლა არ აღენიშნება, თუმცა თეორიულად ამის მაღალი შესაძლებლობა არსებობს. ოფიციალურად, მათაც „სტაბილურ“ კატეგორიას მიაკუთვნებენ. დამატებით 34 ელემენტის ნახევრად დაშლის პერიოდი 80 მილიონ წელზე მეტია და საკმარისად დიდი ხანია არსებობენ, რომ მზის სისტემის შექმნიდან დღემდე მოეღწიათ. ეს, საერთო ჯამში, 288 იზოტოპიან კომპლექტს ქმნის, რომლებიც პრიმორიდიული იზოტოპების სახელით არიან ცნობილნი. კიდევ 51 ხანმოკლედ არსებული იზოტოპი მიიჩნევა, რომ ბუნებრივად არსებობენ, როგორც შვილეული პროდუქტები პრიმორდიალური იზოტოპების დაშლისა (როგორიცაა რადიუმი ურანიდან) ან როგორც დედამიწაზე მიმდინარე ბუნებრივი ენერგეტიკული პროცესების პროდუქტები, როგორიცაა კოსმოსური გამოსხივებით „დაბომბვა“ (მაგალითად, ნახშირბად-14).
80 ქიმიურ ელემენტს, სულ ცოტა, ერთი სტაბილური იზოტოპი მაინც გააჩნია. როგორც წესი, თითოეული ასეთი ელემენტისათვის მხოლოდ რამდენიმე სტაბილური ელემენტი არსებობს, რაც, საშუალოდ, 3,2 სტაბილურ იზოტოპს შეადგენს თითეული ელემენტზე. 26 ელემენტს მხოლოდ ერთი სტაბილური ელემენტი გააჩნია. ყველაზე მეტი სტაბილური იზოტოპის რაოდენობა, რომელიც ერთ ელემენტს აქვს, ათს შეადგენს და ისინი კალის იზოტოპებს წარმოადგენენ. ელემენტებს, ატომური ნომრით 43, 61 და 83 ან მეტი, სტაბილური იზოტოპები არ გააჩნიათ.
იზოტოპის სტაბილურობას განაპირობებს პროტონებისა და ნეიტრონების რაოდენობათა შეფარდება, ასევე, პროტონების ან ნეიტრონების განსაზღვრული „მაგიური რიცხვის“ არსებობა, რომელიც წარმოადგენს დახურულ ან შევსებულ კვანტურ შრეებს. ეს კვანტური შრეები შეესაბამებიან ენერგიის დონეების ნაკრებს ბირთვის შრეოვან მოდელში. შევსებული შრეები, როგორიცაა 50 პროტონიანი შევსებული შრე კალისათვის, ნუკლიდს უჩვეულო სტაბილურობას ანიჭებს. 254 სტაბილური ნუკლიდიდან მხოლოდ ოთხს აქვს როგორც პროტონთა, ასევე, ნეიტრონთა კენტი რიცხვი (წყალბად-2 (დეიტერიუმი), ლითიუმ-6, ბორ-10 და აზოტ-14). აგრეთვე, მხოლოდ 4 ბუნებრივად არსებულ რადიოაქტიურ კენტ-კენტ ნუკლიდებს აქვთ მილიარდ წელზე მეტი ხანგრძლივობის ნახევრად დაშლის პერიოდი (კალიუმ-40, ვანადიუმ-50, ლანთან-138 და ტანტალ-180). კენტ-კენტი ბირთვთა უმეტესობა ბეტა დაშლის მიმართ მაღალი არასტაბილურობით ხასიათდება, რადგანაც ამ უკანასკნელის პროდუქტები ლუწ-ლუწია და შესაბამისად, უფრო მტკიცედ არიან დაკავშირებულნი ბირთვული დაწყვილების ეფექტის წყალობით.
მასა
ატომის მასის უდიდესი ნაწილი მისი შემადგენელი პროტონებისა და ნეიტრონების მასათა ჯამს წარმოადგენს. ამ ნაწილაკების („ნუკლონები“) საერთო რაოდენობას მოცემულ ატომში მასურ რიცხვს უწოდებენ. იგი დადებითი მთელი რიცხვია და განზომილება არ გააჩნია (იმის ნაცვლად, რომ მასის განზომილება ჰქონდეს), რადგანაც რაოდენობას გამოხატავს. მასური რიცხვის გამოყენების ნიმუშს წარმოადგენს „ნახშირბად-12“, რომელსაც 12 ნუკლონი გააჩნია (ექვსი პროტონი და ექვსი ნეიტრონი).
ატომის ფაქტობრივი მასა ხშირად გამოისახება მასის ატომური ერთეულის (u) გამოყენებით, მას, ასევე, დალტონსაც (Da) უწოდებენ. ეს ერთეული განისაზღვრება, როგორც ნახშირბად-12-ის ნეიტრალური ატომის მასის 1/12, რაც, დაახლოებით, 1,66×10−27 კგ-ია. წყალბად-1-ის (წყალბადის ყველაზე მსუბუქი იზოტოპი, რომელიც, ასევე, ყველაზე მცირე მასის ნუკლიდს წარმოადგენს) მასა შეადგენს 1,007825 u-ს. ამ რიცხვის მნიშვნელობას ატომურ მასას უწოდებენ. მოცემული ატომის ატომური მასა თითქმის ტოლია (სხვაობა 1%-ის ფარგლებში) მის მასურ რიცხვჯერ მასის ატომური ერთეულისა (მაგალითად, აზოტ-14-ის მასა, დაახლოებით 1414 u-ს ტოლია). თუმცა, ეს რიცხვი ნახშირბად-12-ის შემთხვევაში ზუსტი მთელი რიცხვი არ იქნება. ყველაზე მძიმე სტაბილური ატომია ტყვია-208, რომლის მასაც 207,9766521 u-ს შეადგენს.
ყველაზე მასიური ატომებიც კი ზედმეტად მსუბუქებია პირდაპირ მათზე სამუშაოდ, ამიტომაც ქიმიკოსები სანაცვლოდ მოლის ერთეულს იყენებენ. ნებისმიერი ელემენტის ატომის ერთი მოლი ყოველთვის ატომთა ერთსა და იმავე რაოდენობას შეიცავს (დაახლოებით 6,022×1023). ეს რიცხვი იმგვარად შეირჩა, რომ თუ ელემენტს აქვს 1 u-ს ტოლი ატომური მასა, ამ ელემენტის ატომების ერთი მოლის მასა უახლოვდება 1 გრამს. მასის ატომური ერთეულის განმარტებიდან გამომდინარე, თითოეულ ნახშირბად-12-ის ატომს გააჩნია ატომური მასა ზუსტად 12 u, ამდენად, ნახშირბად-12-ის ერთი მოლი იწონის ზუსტად 0,012 კგ-ს.
ფორმა და ზომა
ატომებს არ გააჩნიათ მკაფიოდ გამოხატული გარე საზღვრები, ამიტომაც მათი განზომილებები აღიწერება ტერმინით ატომის რადიუსი. იგი წარმოადგენს მანძილს ატომის ბირთვსა და ელექტრონული გარსის ყველაზე შორს მდებარე ელექტრონის სტაბილურ ორბიტალს შორის, თუმცა ეს ატომის სფერულ ფორმას გულისხმობს, რაც მხოლოდ ვაკუუმში ან თავისუფალ სივრცეში მიიღწევა. ატომური რადიუსი შეიძლება მიღებულ იქნას ორ ბირთვს შორის არსებული მანძილიდან, როდესაც ორი ატომი ქიმიური ბმითაა დაკავშირებული ერთმანეთთან. რადიუსი მერყეობს ატომურ ცხრილზე ატომის მდებარეობის, ქიმიური ბმის ტიპის, მეზობელი ატომების რაოდენობისა (საკოორდინაციო რიცხვი) და სპინის სახელით ცნობილი კვანტური მექანიკის ხარისხის მიხედვით. ელემენტთა პერიოდულ ცხრილში ჯგუფებში, ზევიდან ქვევით ატომთა ზომა იზრდება, ხოლო რიგებში, მარცხნიდან მარჯვნივ — მცირდება. აქედან გამომდინარე, ყველაზე პატარა ატომია ჰელიუმი 32 პმ-იანი რადიუსით, ხოლო ერთ-ერთი უდიდესია ცეზიუმი, რომლის რადიუსი 225 პმ-ს შეადგენს.
ელექტრული ველის მსგავსი გარე ძალების ზემოქმედებით, ატომის ფორმა შეიძლება განსხვავდებოდეს სფერული სიმეტრიისაგან. დეფორმაცია დამოკიდებულია ველის სიდიდესა და ელექტრონის ორბიტალის გარე შრის ტიპზე, როგორც ნაჩვენებია კიდეც ჯგუფთა თეორიის განხილვით. ასფერული გადახრები შესაძლოა გამოვლინდეს, მაგალითად, კრისტალებში, სადაც შესაძლოა ადგილი ჰქონდეთ დიდ კრისტალურ-ელექტრულ ველებს დაბალსიმეტრიულ სტრუქტურულ ერთეულებში. უკანასკნელ პერიოდში გამოვლინდა, რომ გოგირდისა და ჰალკოგენის იონებს პირიტის მსგავს ნაერთებში, შესაძლოა, მნიშვნელოვანი ელიფსური დეფორმაციები ახასიათებდეთ.
ატომის განზომილებები სინათლის ტალღის სიგრძეზე (400-700 ნმ) რამდენიმე ათასეულჯერ მცირეა, ასე რომ, მათი დანახვა ოპტიკური მიკროსკოპით შეუძლებელია, თუმცა ცალკეულ ატომებზე დაკვირვება გვირაბული სკანირების მიკროსკოპითაა შესაძლებელი. ატომის სიმცირის თვალსაჩინოებისათვის, განიხილავენ შემდეგ მაგალითებს: ადამიანის ჩვეულებრივი თმის ღერი სიგანეში 1 მილიონი ნახშირბადის ატომის ტოლია; წყლის უბრალო წვეთი ჟანგბადის, დაახლოებით, 2 სექსტილიონსა (2×1021) და ორჯერ მეტ წყალბადის ატომს შეიცავს; ალმასის ერთი კარატი, რომლის მასაც 2×10−4 კგ-ის ტოლია, დაახლოებით, 10 სექსტილიონ (1022) ნახშირბადის ატომს შეიცავს; თუ ვაშლს დედამიწის ზომამდე გავადიდებთ, მაშინ ვაშლში არსებული ატომი, დაახლოებით, ვაშლის საწყისი ზომისა გახდება.
რადიოაქტიური დაშლა

ყველა ელემენტს გააჩნია ერთი ან მეტი იზოტოპი, რომელთაც არასტაბილური ბირთვი აქვთ და რადიოაქტიურ დაშლას ექვემდებარებიან, რაც იწვევს ბირთვის მიერ ნაწილაკების ან ელექტრომაგნიტური რადიაციის გამოსხივებას. რადიოაქტივობა, შეიძლება, გამოვლინდეს მაშინ, როდესაც ბირთვის რადიუსი ბევრად აღემატება ძლიერი ძალის რადიუსს, რომელიც მხოლოდ 1 ფმ-ის მანძილზე მოქმედებს.
რადიოაქტიური დაშლის ყველაზე გავრცელებული ფორმებია:
- ალფა დაშლა: ეს პროცესი გამოწვეულია ბირთვის მიერ ალფა ნაწილაკის გამოსხივებით, რომელიც ორი პროტონისა და ორი ნეიტრონის შემცველ ჰელიუმის ბირთვს წარმოადგენს. ამ გამოსხივების შედეგია ახალი ელემენტი უფრო მცირე ატომური ნომრით.
- ბეტა დაშლა (და ელექტრონის მიტაცება): ეს პროცესები რეგულირდება სუსტი ურთიერთქმედების მიერ და იწვევს ნეიტრონის პროტონად ან პროტონის ნეიტრონად ტრანსფორმაციას. ნეიტრონის პროტონად გარდაქმნას თან ახლავს ელექტრონისა და ანტინეიტრინოს გამოყოფა, ხოლო პროტონის ნეიტრონად გარდაქმნა (ელექტრონის მიტაცების შემთხვევის გარდა) იწვევს პოზიტრონისა და ნეიტრინოს გამოყოფას. ელექტრონის ან პოზიტრონის გამოყოფას ბეტა ნაწილაკებს უწოდებენ. ბეტა დაშლა ბირთვის ატომურ ნომერს ერთით ზრდის ან ამცირებს. ელექტრონის მიტაცება პოზიტრონის გამოყოფაზე უფრო გავრცელებულია, რადგანაც ნაკლებ ენერგიას საჭიროებს. ამ ტიპის დაშლაში, ბირთვის მიერ პოზიტრონის გამოსხივებაზე მეტად, ბირთვის მიერ ელექტრონის შთანთქმა ხდება. პროცესში ნეიტრინო კვლავ გამოსხივდება და პროტონი ნეიტრონად გარდაიქმნება.
- გამა დაშლა: ეს პროცესი წარმოადგენს ბირთვის ენერგიის დონეში ქვედა მდგომარეობისაკენ ცვლილების შედეგს და იწვევს ელექტრომაგნიტური რადიაციის გამოსხივებას. ბირთვის აღგზნებული მდგომარეობა, რომელიც გამა გამოსხივების შედეგია, ჩვეულებრივ, ალფა ან ბეტა ნაწილაკის გამოსხივებას მოსდევს. ამგვარად, გამა დაშლა, ჩვეულებრივ, ალფა ან ბეტა დაშლას მოჰყვება ხოლმე.
რადიოაქტიური დაშლის სხვა უფრო იშვიათი ტიპები მოიცავს ბირთვიდან ნეიტრონის, პროტონის, ნუკლონის გროვების ან ერთზე მეტი ბეტა ნაწილაკის ამოვარდნას. გამა გამოსხივების ანალოგს, რომელიც აღგზნებულ ბირთვს ენერგიის სხვადასხვა გზით დაკარგვის საშუალებას აძლევს, შიდა კონვერსია წარმოადგენს — პროცესს, რომელიც ქმნის მაღალი სიჩქარის მქონე ელექტრონებს, რომლებიც ბეტა სხივები არ არიან, რასაც მოჰყვება მაღალი ენერგიის მქონე ფოტონების წარმოქმნა, რომლებიც გამა სხივები არაა. დაშლაში რამდენიმე დიდი ბირთვის აფეთქებას ორ ან მეტ სხვადასხვა მასის მქონე დამუხტულ ფრაგმენტში, პლუს რამდენიმე ნეიტრონს, სპონტანური ბირთვული გახლეჩა ეწოდება.
თითოეულ რადიოაქტიური იზოტოპი ხასიათდება დაშლის დროის პერიოდით, ნახევრად დაშლის პერიოდით, რომელიც ნიმუშის ნახევრის დასაშლელად საჭირო დროის რაოდენობით განისაზღვრება. დაშლის მუდმივას პროცესი ყოველ ნახევრად დაშლის პერიოდში დარჩენილი იზოტოპის პროპორციას მუდმივად ამცირებს 50%-ით, აქედან გამომდინარე, ორი ნახევრად დაშლის პერიოდის შემდეგ, რჩება საწყისი იზოტოპის 25% და ა. შ.
მაგნიტური მომენტი
ელემენტარულ ნაწილაკებს გააჩნიათ სპინის სახელით ცნობილი კვანტური მექანიკის თვისება. იგი წარმოადგენს იმ ობიექტის იმპულსის მომენტის ანალოგს, რომელიც საკუთარი მასის ცენტრის ირგვლივ ბრუნავს, მიუხედავად ლაპარაკისა იმის შესახებ, რომ ეს ნაწილაკები მიჩნეულნი არიან წერტილისებრებად და არ შეიძლება ითქვას, რომ ბრუნავენ. სპინი იზომება პლანკის მუდმივას შემცირებულ ერთეულებში (ħ). ელექტრონებს, პროტონებსა და ნეიტრონებს, ყველას, გააჩნია სპინი ½ ħ, ან „სპინ-½“. ატომში, ბირთვის გარშემო მოძრავი ელექტრონები საკუთარი სპინის გარდა, ფლობენ იმპულსის მომენტსაც, როდესაც თვად ბირთვს გააჩნია იმპულსის მომენტი მისი ბირთვული სპინის გამო.
ატომის მიერ შექმნილი მაგნიტური ველი, მისი მაგნიტური მომენტი, განისაზღვრება იმპულსის მომენტის სხვადასხვა ფორმით, ისევე, როგორც მბრუნავი დამუხტული ობიექტი, კლასიკურად, ქმნის მაგნიტურ ველს, თუმცა ძირითადი წვლილი ელექტრონის სპინიდან მოდის. ელექტრონის ბუნების გამო, დაემორჩილოს პაულის აკრძალვის პრინციპს, რომლის მიხედვითაც არ შეიძლება ორი ელექტრონის ერთსა და იმავე კვანტურ მდგომარეობაში არსებობა, დაკავშირებული ელექტრონები წყვილდებიან ერთმანეთთან, რომელთაგან ერთს მაღლა, ხოლო მეორეს დაბლა მიმართული სპინი გააჩნია. აქედან გამომდინარე, ეს სპინები აბათილებენ ერთმანეთს და ზოგიერთ ატომში, მთლიან მაგნიტურ დიპოლურ მომენტს ნულამდე ამცირებენ ელექტრონთა ლუწი რაოდენობით.
რკინის, კობალტისა და ნიკელის მაგავსი ფერომაგნიტური ელემენტების ელექტრონთა კენტი რიცხვი იწვევს გაუწყვილებელი ელექტრონისა და სუფთა საერთო მაგნიტური მომენტის არსეობას. მეზობელი ატომების ორბიტალები გადაფარავენ ერთმანეთს და მიიღწევა ენერგიის დაბალი დონე, როდესაც გაუწყვილებელი ელექტრონების სპინები ერთმანეთთან არიან განლაგებულნი, გაცვლითი ურთიერთქმედების სახელით ცნობილი სპონტანური პროცესისას. როდესაც ფერომაგნიტური ატომების მაგნიტური მომენტები ჩამწკრივებულია, მატერიას შეუძლია წარმოქმნას გაზომვადი მაკროსკოპული ველი. პარამაგნიტურ მატერიებს გააჩნიათ ატომები მაგნიტური მომენტებით, რომლებიც ქმნიან მწკრივს შემთხვევითი მიმართულებით, რა დროსაც მაგნიტური ველი არ წარმოიქმნება, მაგრამ ცალკეული ატომების მაგნიტური მომენტები მწკრივდებიან ველის არსებობით.
ატმბირთვს არ აქვს სპინი, როდესაც მას როგორც ნეიტრონების, ისე პროტონების ლუწი რაოდენობა გააჩნია, თუმცა კენტი რაოდენობის სხვა შემთხვევებში, ბირთვს, შესაძლოა, ჰქონდეს სპინი. ჩვეულებრივ, თერმული წონასწორობის გამო, სპინის მქონე ბირთვები შემთხვევითი მიმართულებებით არიან განლაგებულნი, თუმცა განსაზღვრული ელემენტებისათვის (როგორიცაა ქსენონ-129) შესაძლებელია, ბირთვული სპინების მდგომარეობის მნიშვნელოვანი პროპორციის პოლარიზება, ისე, რომ ისინი განლაგდნენ ერთი მიმართულებით, ჰიპერპოლარიზაციის სახელით ცნობილ გარემოში. მას გააჩნია მნიშვნელოვანი გამოყენება მაგნიტურ-რეზონანსულ ტომოგრაფიაში.
ენერგიის დონეები

ატომში ელექტრონის პოტენციური ენერგია უარყოფითია, მისი დამოკიდებულება მის პოზიციაზე მინიმუმს (ყველაზე აბსოლუტური მნიშვნელობა) ბირთვის შიგნით აღწევს და ქრება, როდესაც ბირთვიდან დაშორება უსასრულობაში მიდის, უხეშად რომ ვთქვათ, დაშორების უკუპროპორციულად. კვანტურ-მექანიკურ მოდელში ჩაჭერილ ელექტრონს მდგომარეობათა მხოლოდ გარკვეული რაოდენობის დაკავება შეუძლია, რომელთა ცენტრშიც ბირთვი იგულისხმება. თითოეული მდგომარეობა შეესაბამება კონკრეტულ ენერგიის დონეს. ენერგიის დონე შეიძლება გაიზომოს იმ ენერგიის რაოდენობით, რომელიც ელექტრონის ატომისაგან მოსაწყვეტადაა საჭირო. მას, ჩვეულებრივ, ელექტრონვოლტებში გამოსახავენ. ჩაჭერილი ელექტრონის ყველაზე დაბალ ენერგო მდგომარეობას სტაციონარულ მდგომარეობას უწოდებენ, ხოლო მაღალ დონეზე გადასვლისას ელექტრონი აღგზნებულ მდგომარეობაში გადადის. ელექტრონის ენერგია იზრდება, როდესაც მთავარი კვანტური რიცხვი იზრდება რადგანაც იზრდება (საშუალო) დაშორება ბირთვამდე. ენერგიის ორბიტალურ კვანტურ რიცხვზე დამოკიდებულება გამოწვეულია არა ელექტროსტატიკური პოტენციალით, არამედ ელექტრონებს შორის ურთიერთქმედებით.
იმისათვის, რომ ელექტრონი გადაადგილდეს ორ განსხვავებულ მდგომარეობას შორის, მაგალითად, სტაციონალური მდგომარეობიდან პირველ აღგზნებულ დონემდე (იონიზაცია), ნილს ბორის მოდელის თანახმად, მან უნდა შთანთქოს ან გამოსახივოს იმ რაოდენობის ენერგია ფოტონის სახით, რომელიც შეესაბამება ამ დონეების პოტენციურ ენერგიებს შორის არსებულ სხვაობას, რომლის ზუსტად გამოთვლაც შესაძლებელია შრედინგერის განტოლების საშუალებით. ელექტრონის გადახტომა ორბიტალებს შორის ხდება ნაწილაკის მსგავსი სტილით. მაგალითად, თუ ელექტრონებს ერთი ფოტონი შეეჯახება, მხოლოდ ერთი ელექტრონი შეიცვლის მდგომარეობას ფოტონის საპასუხოდ.
გამოყოფილი ფოტონის ენერგია მისი სიხშირის პროპორციულია, ამდენად, ეს სპეციფიკური ენერგიის დონეები გვევლინებიან, როგორც მკაფიო ინტერვალები ელექტრომაგნიტურ სპექტრში. თითოეულ ელემენტს გააჩნია მისთვის დამახასიათებელი სპექტრი, რომელიც, შეიძლება, დამოკიდებული იყოს ბირთვის მუხტზე, ელექტრონებით შევსებულ ქვედონეებზე, ელექტრონებს შორის ელექტრომაგნიტურ ურთიერთქმედებასა და სხვა ფაქტორებზე.

როდესაც ენერგიის უწყვეტი სპექტრი გადის აირში ან პლაზმაში, მის ზოგიერთ ფოტონს ატომები შთანთქავენ, რაც ელექტრონებს აიძულებთ შეიცვალონ მათი ენერგიის დონე. ეს აღგზნებული ელექტრონები, რომლებიც ინარჩუნებენ კავშირს თავიანთ ატომებთან, სპონტანურად გამოყოფენ ენერგიას ფოტონების სახით, მოძრაობენ შემთხვევითი მიმართულებით და უბრუნდებიან ენერგიის დაბალ დონეებს. ამგვარად, ატომები ფილტრის მსგავსად მოქმედებენ, რომელიც ენერგიის წარმოებისას აყალიბებს ბნელი შთანთქმის ინტერვალთა სერიებს (დამკვირვებელი ატომებს იმ ხედიდან ათვალიერებს, რომელიც ფონში არ შეიცავს უწყვეტ სპექტრს. მათ ნაცვლად იგი ხედავს ატომთა მიერ გამოსხივებული ფოტონებიდან გამოყოფილ ხაზთა სერიებს). ატომური სპექტრის ხაზების ძალისა და სიგანის სპექტროსკოპიული გაზომვები ნივთიერების შემადგენლობისა და ფიზიკური თვისებების განსაზღვრის საშუალებას იძლევა.
Close examination of the spectral lines reveals that some display a fine structure splitting. This occurs because of spin–orbit coupling, which is an interaction between the spin and motion of the outermost electron. When an atom is in an external magnetic field, spectral lines become split into three or more components; a phenomenon called the Zeeman effect. This is caused by the interaction of the magnetic field with the magnetic moment of the atom and its electrons. Some atoms can have multiple electron configurations with the same energy level, which thus appear as a single spectral line. The interaction of the magnetic field with the atom shifts these electron configurations to slightly different energy levels, resulting in multiple spectral lines. The presence of an external electric field can cause a comparable splitting and shifting of spectral lines by modifying the electron energy levels, a phenomenon called the Stark effect.
If a bound electron is in an excited state, an interacting photon with the proper energy can cause stimulated emission of a photon with a matching energy level. For this to occur, the electron must drop to a lower energy state that has an energy difference matching the energy of the interacting photon. The emitted photon and the interacting photon then move off in parallel and with matching phases. That is, the wave patterns of the two photons are synchronized. This physical property is used to make lasers, which can emit a coherent beam of light energy in a narrow frequency band.
ვალენტობა და საკავშირო ქცევა
ვალენტობა ელემენტის კომბინაციის ძალას წარმოადგენს და იდენტურია იმ წყალბადატომთა რაოდენობისა, რომელთა დაკავშირება ან ჩანაცვლებაც შეუძლია ატომს ნაერთის წარმოქმნისას. ატომის ყველაზე გარე ელექტრონული შრე მის არაკომბინირებულ მდგომარეობაში სავალენტო შრის სახელითაა ცნობილი, ხოლო ამ შრეში მდებარე ელექტრონს სავალენტო ელექტრონს უწოდებენ. სავალენტო ელექტრონთა რიცხვი განსაზღვრავს ატომის ქცევას სხვა ატომებთან ქიმიური ბმის წარმოქმნისას. როგორც წესი, ატომები ქიმიურ რეაქციას იმგვარად ამყარებენ, რომ შეივსოს (ან დაცარიელდეს) მათი გარე სავალენტო შრე. მაგალითად, ატომთა შორის ერთი ელექტრონის გაცვლა ხელსაყრელია ატომთა ისეთი ფორმებისათვის, რომელთაგან ერთს სრულ შრეზე ერთით მეტი ელექტრონი გააჩნია, ხოლო მეორეს შრის დასასრულებლად, ასევე, ერთი აკლია, რისი მაგალითებიცაა ნატრიუმის ქლორიდისა და სხვა იონური მარილების ნაერთები, თუმცა მრავალ ელემენტს ახასიათებს განსხვავებული ვალენტობა ან მიდრეკია სხვადასხვა ნაერთში სხვადასხვა რაოდენობის ელექტრონების გაზიარებისაკენ. ამგვარად, ქიმიური ბმა ასეთ ელემენტებს შორის იღებს ელექტრონის გაზიარების მრავალ ფორმას, რაც უბრალოდ ელექტრონის გადაცემაზე მეტია. ამის მაგალითებია ელემენტი ნახშირბადი და ორგანული ნაერთები.
ქიმიური ელემენტები ხშირად პერიოდული ცხრილში არიან წარმოდგენილნი, რომელიც ქიმიური თვისებების განმეორებადობას წარმოაჩენს. ელემენტები სავალენტო ელექტრონთა ერთნაირი რიცხვით ქმნიან ჯგუფს, რომელიც ცხრილის იგივე სვეტშია წარმოდგენილი (ჰორიზონტალური რიგები ელემენტთა კვანტური შრის შევსებას შეესაბამებიან). ცხრილის უკიდურესად მარჯვნივ განლაგებულ ელემენტებს მათი გარე შრე ელექტრონებით სრულად აქვთ შევსებული, რაც მათ ქიმიურ ინერტულობას განაპირობებს. ეს ელემენტები კეთილშობილი აირების სახელით არიან ცნობილნი.
მდგომარეობები
ატომები არსებობენ ნივთიერების სხვადასხვა აგრეგატულ მდგომარეობაში, რაც ისეთ ფიზიკურ პირობებზეა დამოკიდებული, როგორებიცაა ტემპერატურა და წნევა. პირობების ცვლილებებიდან გამომდინარე, ნივთიერებას შეუძლია გადავიდეს მყარ, თხევად, აირად და პლზმურ მდგომარეობაში. კონკრეტულ აგრეგატულ მდგომარეობაშიც, ნივთიერება შეიძლება არსებობდეს სხვადასხვა ალოტროპიული სახეცვლილების სახით, რის მაგალითსაც წარმოადგენს მყარი ნახშირბადი, რომელიც შეიძლება არსებობდეს როგორც გრაფიტის, ასევე, ალმასის სახით. აირებში არსებული ალოტროპიების მაგალითს წარმოადგენს ორატომიანი ჟანგბადი და ოზონი.
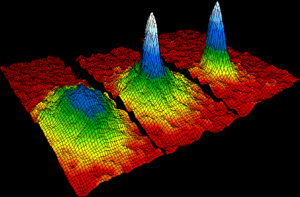
აბსოლუტურ ნულთან მიახლოვებული ტემპერატურის პირობებში, ატომებს შეუძლიათ წარმოქმნან ბოზე-აინშტაინის კონდენსატი, რომლის დროსაც, კვანტური მექანიკის ეფექტები, რომლებზე დაკვირვებაც, ჩვეულებრივ, მხოლოდ ატომურ მასშტაბებშია შესაძლებელი, აშკარა ხდება მაკროსკოპულ მასშტაბებში. შემდგომ, ატომთა ეს სუპერ ცივი ნაკრები, ცალკეული სუპერ ატომივით იქცევა, რომელმაც, შესაძლოა, კვანტური მექანიკის ქცევის ფუნდამენტური შემოწმების საშუალება წარმოქმნას.
იდენტიფიკაცია

გვირაბული სკანირების მიკროსკოპი წარმოადგენს ზედაპირის ატომურ დონეზე დასათვალიერებელ ხელსაწყოს. იგი იყენებს კვანტური გვირაბის ფენომენს, რომელიც ნაწილაკებს საშუალებას აძლევს გაიარონ ისეთ ბარიერში, რომელიც, ჩვეულებრივ, გადაულახავია. ელექტრონები გვირაბის გავლით გადიან ვაკუუმში ორ ბრტყელ მეტალის ელექტროდს შორის, რომელთაგან თითოეულზე განთავსებულია ადსორბირებული ატომი, რომლებიც უზრუნველყოფენ გაზომვად გვირაბულ-ამჟამინდელ სიხშირეს. Scanning one atom (taken as the tip) as it moves past the other (the sample) permits plotting of tip displacement versus lateral separation for a constant current. გამოთვლა აჩვენებს იმ ზომას, რომლისთვისაც გვირაბული სკანირების მიკროსკოპის ინდივიდუალური ატომების გამოსახულებები ხილვადია. It confirms that for low bias, the microscope images the space-averaged dimensions of the electron orbitals across closely packed energy levels—the Fermi level local density of states.
ატომი შესაძლებელია იონიზირდეს მისთვის ელექტრონის მოშორებით. ელექტრული მუხტი იწვევს ატომის ტრაექტორიის ცვლილებას ელექტრულ ველში გავლისას. რადიუსს, რომლითაც მაგნიტური ველი ცვლის მოძრავი იონის ტრაექტორიას, ატომის მასა განსაზღვრავს. მას-სპექტრომეტრი იყენებს ამ პრინციპს იონის მასა-მუხტის თანაფარდობის განსასაზღვრად. თუ ნიმუში შეიცავს მრავალ იზოტოპს, მას-სპექტრომეტრს შეუძლია განსაზღვროს თითოეული მათგანის წილი ნიმუშში იონთა განსხვავებული სხივების ინტენსივობის გაზომვის საშუალებით. ატომთა აორთქლების ტექნოლოგიები მოიცავს ინდუქციურად დაწყვილებული პლაზმის ატომური გამოყოფის სპექტროსკოპიასა და ინდუქციურად დაწყვილებული პლაზმის მასის სპექტროსკოპიას, რომელთაგან ორივე იყენებს პლაზმას ანალიზისათვის ნიმუშთა ასაორთქლებლად.
უფრო მეტად არეაშერჩევით მეთოდს წარმოადგენს ელექტრონის ენერგიის დანაკარგის სპექტროსკოპია, რომელიც ზომავს ელექტრონული სხივის ენერგიის დანაკარგს გადატანის ელექტრონულ მიკროსკოპში, როდესაც იგი ურთიერთქმედებს ნიმუშის ნაწილთან. ატომ-ზონდის ტომოგრაფს გააჩნია სუბ-ნანომეტრული გაფართოება 3-D-ში და შეუძლია ქიმიურად მოახდინოს ცალკეულ ატომთა იდენტიფიკაცია ფრენის დროის მას-სპექტრომეტრის გამოყენებით.
აღგზნებული მდგომარეობის სპექტრი შეიძლება გამოყენებულ იქნას შორეული ვარსკვლავების ატომური შემადგენლობის ანალიზისათვის. ვარსკვლავებიდან წამოსულ სინათლეში არსებულ კონკრეტულ სინათლის ტალღის სიგრძეებს შეუძლიათ განცალკევდნენ და დაუკავშირდნენ აირთა თავისუფალ ატომებში არსებულ კვანტიზირებულ გადასვლებს. ეს ფერები შეიძლება განმეორებულ იქნან აირშემცველი ნათურის გამოყენებით, რომელიც იგივე ელემენტს შეიცავს. ჰელიუმი სწორედ ამ გზით აღმოაჩინეს მზის სპექტრში მის დედამიწაზე აღმოჩენამდე 23 წლით ადრე.
წარმომავლობა და ამჟამინდელი მდგომარეობა
ატომები ქმნიან ხილული სამყაროს მთლიანი ენერგიის სიმკვრივის, დაახლოებით, 4%-ს საშუალო სიმკვრივით 0,25 ატომი/მ3. ირმის ნახტომის მსგავს გალაქტიკაში, ატომებს გააჩნიათ გაცილებით მაღალი კონცენტრაცია — ვარსკვლავთშორის სივრცეში (ვშს) მატერიის სიმკვრივე მერყეობს 105-დან 109 ატომი/მ3-მდე. მიჩნეულია, რომ მზე ადგილობრივ ბუშტში, მაღალიონიზირებულ აირის რეგიონში, მდებარეობს, ასე რომ, სიმჭიდროვე მზის სამეზობლოში მხოლოდ, დაახლოებით 103 ატომი/მ3-ს შეადგენს. ვარსკვლავები ქმნიან მკვრივ ღრუბლებს ვშს-ში და ვარსკვლავთა ევოლუციური პროცესები იწვევენ მის მდგრადად გამდიდრებას წყალბადსა და ჰელიუმზე მასიური ელემენტებით. ირმის ნახტომის ატომების 95%-მდე ვარსკვლავებშია კონცენტრირებული, ატომთა მთლიანი მასა კი გალაქტიკის მასის, დაახლოებით, 10%-ს ქმნის (მასის დანარჩენ ნაწილს უცნობი ბნელი მატერია იკავებს).
ჩამოყალიბება
ფიქრობენ, რომ ელექტრონები სამყაროში ჯერ კიდევ დიდი აფეთქების ადრეული ეტაპებიდან არსებობენ. ატომის ბირთვი ყალიბდება ნუკლეოსინთეზის რეაქციებში. დაახლოებით, სამ წუთში, დიდი აფეთქების ნუკლესინთეზმა შექმნა სამყაროში არსებული ჰელიუმის, ლითიუმისა და დეიტერიუმის უმეტესობა და შესაძლოა, ბერილიუმისა და ბორის გარკვეული ნაწილიც.
ატომების უნივერსალურობა და სტაბილურობა დამოკიდებულია მათ შემაკავებელ ენერგიაზე, რაც ნიშნავს, რომ ატომს გააჩნია უფრო ნაკლები ენერგია, ვიდრე ბირთვისა და ელექტრონების დაუკავშირებელ სისტემას. სადაც ტემპერატურა იონიზაციის ენერგიაზე ბევრად მაღალია, მატერია არსებობს პლაზმის, დადებითად დამუხტული იონებისა (შესაძლოა, შიშველი ბირთვების) და ელექტრონების აირის, მდგომარეობაში. როდესაც ტემპერატურა იონიზაციის ენერგიაზე დაბლა ეცემა, ატომი სტატისტიკურად ხელსაყრელი ხდება. ატომებმა (დაკავშირებული ელექტრონებით დასრულებული) დამუხტულ ნაწილაკებზე დომინირება დიდი აფეთქებიდან 380 000 წლის შემდეგ დაიწყეს, რეკომბინაციის სახელით ცნობილ ეპოქაში, როდესაც გაფართოების პროცესში მყოფი სამყარო საკმარისად გაგრილდა რომ ელექტრონებისათვის საშუალება მიეცა ბირთვს დაკავშირებოდნენ.
დიდი აფეთქების შემდეგ, რომელსაც ნახშირბადი ან უფრო მძიმე ელემენტები არ შეუქმნია, ატბირთვები კომბინირდნენ ვარსკვლავებში თერმობირთვული რეაქციის შედეგად, რათა წარმოექმნათ კიდევ უფრო მეტი ჰელიუმი და ალფა პროცესის შედეგად, ელემენტთა რიგი ნახშირბადიდან რკინამდე.
იზოტოპები, როგორიცაა ლითიუმ-6, ისევე, როგორც, ბერილიუმისა და ბორის ნაწილი, კოსმოსშია წარმოქმნილი კოსმოსური სხივების ზემოქმედებით. ეს მაშინ ხდება, როდესაც დიდი ენერგიის მქონე ფოტონი ეჯახება ატომბირთვს და ნუკლონების დიდი რაოდენობის გამოდევნას იწვევს.
რკინაზე მძიმე ელემენტები წარმოიქმნენ ზეახალ ვარსკვლავში R-პროცესის შედეგად და AGB ვარსკვლავებში S-პროცესის შედეგად, რომელთაგან ორივემ ჩაითრია ატომბირთვების მიერ ნეიტრონების ჩაჭერა. ისეთი ელემენტები, როგორიცაა ტყვია, უფრო მძიმე ელემენტების რადიოაქტიური დაშლის შედეგად წარმოიქმნა.
დედამიწა
დედამიწისა და მის მცხოვრებთა შემადგენელ ატომთა უმრავლესობა მათი ამჟამინდელი ფორმით წარმოდგენილნი იყვნენ ნისლეულში, რომელიც მოლეკულურ ღრუბლად დაიშალა, რათა მზის სისტემა შეექმნა. დანარჩენები კი რადიოაქტიური დაშლის შედეგს წარმოადგენენ და მათი შეფარდება, შესაძლოა, გამოყენებულ იქნას დედამიწის ასაკის დასადგენად რადიომეტრული დათარიღების საშუალებით. დედამიწის ქერქში არსებული ჰელიუმის უმეტესობა ალფა დაშლის პროდუქტს წარმოადგენს.
დედამიწაზე არსებობს ატომთა მცირე ჯგუფი, რომლებიც არც თავდაპირველად არსებობდნენ (ე. ი. არაპირვანდელი) და არც რადიოაქტიური დაშლის შედეგს წარმოადგენენ. ნახშირბად-14 განუწყვეტლად გამომუშავდება ატმოსფეროში კოსმოსური სხივების მიერ. ზოგიერთი ატომი დედამიწაზე ხელოვნურადაა წარმოქმნილი შეგნებულად ან როგორც ბირთვული რეაქტორების ან აფეთქებების პროდუქტები. ტრანსურანული ელემენტებიდან (ელემენტები, რომელთა ატომური ნომერი 92-ზე მეტია) მხოლოდ პლუტონიუმი და ნეპტუნიუმი არსებობენ დედამიწაზე ბუნებრივად. ტრანსურანულ ელემენტებს დედამიწის ამჟამინდელ ასაკზე ხანმოკლე რადიოაქტიური სიცოცხლის ხანგრძლივობა გააჩნიათ ამიტომაც, ამ ელემენტთა ამოცნობადი რაოდენობა დიდი ხნის დაშლილია. გამონაკლისია პლუტონიუმ-244-ის კვალი, რომელიც, შესაძლოა, კოსმოსური მტვრისაგან დეპონირდა. პლუტონიუმისა და ნეპტუნიუმის ბუნებრივი საბადოები წარმოიქმნებიან ურანის მადნის მიერ ნეიტრონის ჩაჭერის შედეგად.
დედამიწა შეიცავს, დაახლოებით, 1,33×1050 ატომს. მიუხედავად იმისა, რომ ატმოსფეროს 99% მოლეკულების ფორმებშია შეკავებული, რის მაგალითებსაც წარმოადგენს ნახშირორჟანგი, ორატომიანი ჟანგბადი და აზოტი, არსებობს კეთილშობილ აირთა დამოუკიდებელი ატომების მცირერიცხოვანი ჯგუფები, როგორებიცაა არგონი, ნეონი და ჰელიუმი. დედამიწის ზედაპირზე ატომთა აბსოლუტური უმრავლესობა გაერთიანებულია სხვადასხვა ნაერთის წარმოსაქმნელად წყლის, სუფრის მარილის, სილიკატებისა და ოქსიდების ჩათვლით. ატომებს, ასევე, შეუძლიათ შეერთდნენ ისეთი მატერიალების შესაქმნელად, რომლებიც არ შედგებიან ცალკეული მოლეკულებისაგან, როგორებიცაა კრისტალები და თხევადი ან მყარი მეტალები. ეს ატომური მატერია ქმნის ქსელურ განლაგებას, რაც არ ახასიათებს მოლეკულურ მატერიასთან ასოცირებულ მცირე მასშტაბის შუალედებიანი წესრიგის განსაკუთრებულ ტიპს.
იშვიათი და თეორიული ფორმები
სუპერმძიმე ელემენტები
მიუხედავად იმისა, რომ ტყვიაზე (82) მაღალი ატომური ნომრის მქონე იზოტოპები რადიოაქტიურია, ზოგიერთი ელემენტისათვის, 103-ზე მაღალი ატომური ნომრით, წამოყენებულია „სტაბილურობის კუნძულის“ იდეა. ამ სუპერმძიმე ელემენტებს, შესაძლოა, გააჩნდეთ ბირთვები, რომლებიც შედარებით სტაბილურებია რადიოაქტიური დაშლის წინააღმდეგ. სტაბილური სუპერმძიმე ატომის ყველაზე სავარაუდო კანდიდატს, ანბიჰექსიუმს, 126 პროტონი და 184 ნეიტრონი აქვს.
ეგზოტიკური მატერია
მატერიის თითოეულ ნაწილაკს გააჩნია შესაბამისი ანტიმატერიული ნაწილაკი საპირისპირო ელექტრული მუხტით, ამდენად, პოზიტრონი დადებითად დამუხტული ანტიელექტრონია, ხოლო ანტიპროტონი პროტონის უარყოფითად დამუხტული ექვივალენტია. როდესაც მატერიისა და ანტიმატერიის შესაბამისი ნაწილაკები ხვდებიან, ისინი ერთმანეთს ანადგურებენ. ამის გამო, მატერიისა და ანტიმატერიის ნაწილაკებს შორის არსებულ შეუსაბამობასთან ერთად, ეს უკანასკნელები სამყაროში იშვიათობას წარმოადგენენ. ამ შეუსაბამობის პირველადი მიზეზები ჯერ ბოლომდე გასაგები არაა, თუმცა ბარიოგენეზისის თეორიებმა, შესაძლოა, შემოგვთავაზონ მისი ახსნა. შედეგად, ანტიმატერიის ატომები ბუნებაში აღმოჩენილი არ არის. თუმცა, 1996 წელს, ჟენევაში, ატომური კვლევების ევროპული ორგანიზაციის ლაბორატორიაში მოხერხდა წყალბადის ატომის ანტიმატერიული ასლის (ანტიწყალბადი) სინთეზირება.
სხვა ეგზოტიკური ატომები ერთ-ერთი პროტონის, ნეიტრონის ან ელექტრონის იგივე მუხტის მქონე სხვა ნაწილაკებით ჩანაცვლების გზით შეიქმნა. მაგალითად, ელექტრონი შეიძლება ჩანაცვლდეს უფრო მასიური მიუონით მიუონური ატომის შესაქმნელად. ამ ტიპის ატომები შეიძლება გამოყენებულ იქნან ფიზიკის ფუნდამენტური პროგნოზების გამოსაცდელად.
ლიტერატურა
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 0-306-46562-0. OCLC 228374906.
რეკომენდებული ლიტერატურა
- Dalton, J. (1808). A New System of Chemical Philosophy, Part 1. London and Manchester: S. Russell.
- Gangopadhyaya, Mrinalkanti (1981). Indian Atomism: History and Sources. Atlantic Highlands, New Jersey: Humanities Press. ISBN 0-391-02177-X. OCLC 10916778.
- Harrison, Edward Robert (2003). Masks of the Universe: Changing Ideas on the Nature of the Cosmos. Cambridge University Press. ISBN 0-521-77351-2. OCLC 50441595.
- Iannone, A. Pablo (2001). Dictionary of World Philosophy. Routledge. ISBN 0-415-17995-5. OCLC 44541769.
- King, Richard (1999). Indian philosophy: an introduction to Hindu and Buddhist thought. Edinburgh University Press. ISBN 0-7486-0954-7.
- Levere, Trevor, H. (2001). Transforming Matter – A History of Chemistry for Alchemy to the Buckyball. The Johns Hopkins University Press. ISBN 0-8018-6610-3.
- Liddell, Henry George; Scott, Robert. A Greek-English Lexicon. Perseus Digital Library.
- Liddell, Henry George; Scott, Robert. ἄτομος. A Greek-English Lexicon. Perseus Digital Library. ციტირების თარიღი: 21 ივნისი, 2010.
- McEvilley, Thomas (2002). The shape of ancient thought: comparative studies in Greek and Indian philosophies. Allworth Press. ISBN 1-58115-203-5.
- Moran, Bruce T. (2005). Distilling Knowledge: Alchemy, Chemistry, and the Scientific Revolution. Harvard University Press. ISBN 0-674-01495-2.
- Ponomarev, Leonid Ivanovich (1993). The Quantum Dice. CRC Press. ISBN 0-7503-0251-8. OCLC 26853108.
- Roscoe, Henry Enfield (1895). John Dalton and the Rise of Modern Chemistry, Century science series. New York: Macmillan. ციტირების თარიღი: 3 აპრილი, 2011.
- Siegfried, Robert (2002). From Elements to Atoms: A History of Chemical Composition. DIANE. ISBN 0-87169-924-9. OCLC 186607849.
- Teresi, Dick (2003). Lost Discoveries: The Ancient Roots of Modern Science. Simon & Schuster, გვ. 213–214. ISBN 0-7432-4379-X.
- Various (2002). რედ. Lide, David R.: Handbook of Chemistry & Physics, 88th, CRC. ISBN 0-8493-0486-5. OCLC 179976746. ციტირების თარიღი: 23 მაისი, 2008. დაარქივებული 2017-07-24 საიტზე Wayback Machine.
- Wurtz, Charles Adolphe (1881). The Atomic Theory. New York: D. Appleton and company. ISBN 0-559-43636-X.
- ქართული საბჭოთა ენციკლოპედია, ტ. 1, თბ., 1975.
- ქართული საბჭოთა ენციკლოპედია, ტ. 4, თბ., 1979.
- ქართული საბჭოთა ენციკლოპედია, ტ. 7, თბ., 1984.
- ქართული საბჭოთა ენციკლოპედია, ტ. 8, თბ., 1984.
რესურსები ინტერნეტში
- „კვანტური მექანიკა და ატომის სტრუქტურა“ YouTube-ზე (ინგლისური)
- Freudenrich, Craig C.. How Atoms Work. How Stuff Works. დაარქივებულია ორიგინალიდან — 8 იანვარი, 2007. ციტირების თარიღი: 9 იანვარი, 2007. (ინგლისური)
- The Atom. Free High School Science Texts: Physics. Wikibooks. ციტირების თარიღი: 10 ივლისი, 2010. (ინგლისური)
- Anonymous. (2007)The atom. Science aid+. ციტირების თარიღი: 10 ივლისი, 2010.—a guide to the atom for teens. (ინგლისური)
- Anonymous. (3 იანვარი, 2006) Atoms and Atomic Structure. BBC. დაარქივებულია ორიგინალიდან — 2 იანვარი, 2007. ციტირების თარიღი: 11 იანვარი, 2007. (ინგლისური)
- Various. (3 იანვარი, 2006) Physics 2000, Table of Contents. University of Colorado. დაარქივებულია ორიგინალიდან — 14 იანვარი, 2008. ციტირების თარიღი: 11 იანვარი, 2008. (ინგლისური)
- Various. (3 თებერვალი, 2006) What does an atom look like?. University of Karlsruhe. დაარქივებულია ორიგინალიდან — 2010-04-17. ციტირების თარიღი: 12 მაისი, 2008. (ინგლისური)
- ატომი. ციტირების თარიღი: 29 იანვარი, 2016. (ქართული ენა)
- ბორის ატომი. ციტირების თარიღი: 29 იანვარი, 2016. (ქართული ენა)
- ატომის ბირთვის აგებულება. ციტირების თარიღი: 29 იანვარი, 2016. (ქართული ენა)
კომენტარები
სქოლიო
This article uses material from the Wikipedia ქართული article ატომი, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). შინაარსი წარმოდგენილია შემდეგი ლიცენზიით (თუ სხვა არ არის მითითებული): CC BY-SA 4.0. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki ქართული (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.
