Atomas
Atomas (gr.
| Atomas | |
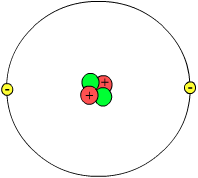
 Helio atomo iliustracija | |
| Klasifikacija | |
|---|---|
| Mažiausia pripažinta cheminio elemento dalelė | |
| Savybės | |
| Atominė masė | nuo 1,67×10−27 iki 4,52×10−25 kg |
| Elektros krūvis | nulis (neutralus) arba jonų krūvis |
| Skersmuo | nuo 62 pm (He) iki 520 pm (Cs) |
| Sudėtis | Elektronai ir vientisas protonų bei neutronų branduolys |
Atomo dydis svyruoja tarp 1,1 angstremo (H) ir 3,43 angstremo (Cs). Viename kubiniame metre telpa kiek mažiau nei 1030 vandenilio atomų. Edingtono skaičius nurodo, kiek atomų yra stebimojoje Visatoje - apytiksliai 1080.
Atomo sąvoką dar V a. pr. m. e. įvedė graikų filosofas Demokritas Abderietis. Pagal jo teoriją, visa medžiaga susideda iš įvairių tipų smulkių dalelių, besiskiriančių savo forma ir dydžiu, kurių nebeįmanoma dar labiau suskaidyti bei sunaikinti.
Atomas buvo laikomas elementariausia medžiagos dalele iki pat 1897 m., kai anglų fizikas Dž. Dž. Tomsonas įrodė, kad egzistuoja smulkesnės už atomą dalelės – elektronai. Chemijoje atomas apibrėžiamas kaip mažiausia chemiškai nedaloma medžiagos dalelė. Chemijai sudėtinga sistema yra molekulė. Tuo tarpu kai fizika smulkiai nagrinėja atomo struktūrą, molekulė fizikos moksle – tai elementari sistema.
Atomo sandara ir kilmė
 | Šiam straipsniui ar jo daliai reikia daugiau nuorodų į patikimus šaltinius. Jūs galite padėti Vikipedijai įrašydami tinkamas išnašas ar nuorodas į patikimus šaltinius. |
Atomas – mažiausia elemento dalelė, kurios spindulys svyruoja nuo 0,53 x 10-10 m. (vandenilio) iki 2,7 x 10-10 m. (urano atomo). Didžioji atomo masės dalis (99,94 %) – 10 -14 – 10-15 m spindulio branduolyje, kurį sudaro teigiami protonai ir neutralaus krūvio neutronai, o aplink branduolį skrieja neigiamo krūvio dalelės – elektronai.
Neutraliame atome branduolio protonų skaičius yra lygus elektronų skaičiui ir atitinka cheminio elemento atominį numerį. Atomui netekus vieno ar daugiau elektronų, atomas tampa teigiamu jonu, kadangi krūvis dėl didesnio protono skaičiaus tampa teigiamu. Kai prisijungiami papildomi elektronai, atomas virsta neigiamu jonu. To paties cheminio elemento atomai, turintys skirtingą neutronų skaičių branduolyje, vadinami izotopais. Šiuo metu žinomi 118 cheminių elementų atomai.
Manoma, kad elektronai egzistavo jau ankstyviausiose Didžiojo Sprogimo stadijose. Atomo branduoliai susidaro branduolinės sintezės reakcijų metu. Skaičiuojama, kad per tris minutes trukusias Didžiojo sprogimo branduolių sintezės reakcijas susidarė didžioji dalis Visatos helio, ličio ir deuterio, tikėtina, kad ir dalis berilio ir boro.
Atomų paplitimas ir stabilumas priklauso nuo jų jungties energijos, o tai reiškia, kad atomo energija yra mažesnė nei paskiros branduolio ir elektronų sistemos. Temperatūrai esant daug aukštesnei už jonizacijos potencialą, medžiaga egzistuoja plazmos pavidalu, t. y., teigiamai įkrautų jonų (numanoma, kad vienų branduolių) ir elektronų dujų. Kai temperatūra nukrenta žemiau jonizacijos potencialo, sąlygos tampa statistiškai palankios atomams. Atomai (su susietais elektronais) pradėjo dominuoti prieš krūvį turinčias paskiras daleles praėjus 380 000 m. po Didžiojo Sprogimo. Ši Visatos formavimosi epocha vadinama rekombinacija - jos metu besiplečianti Visata atvėso pakankamai, kad elektronai galėtų prisijungti prie branduolių.
Didžiojo Sprogimo metu susidarė tik lengvesni už anglį atomai. Anglies ar sunkesnių elementų atomų branduoliai jungėsi žvaigždėse branduolių sąlajos proceso metu; taip susidarė daugiau helio ir (per trijų alfa dalelių procesą) visi elementai tarp anglies ir geležies.
Izotopai litis-6, kai kurie berilio ir boro izotopai kosmose susidarė dėl kosminių spindulių spaliacijos reiškinio. Šis reiškinys vyksta, kai didelės energijos protonas atsitrenkia į atomo branduolį, išmušdamas daug nukleonų.
Elementai, sunkesni už geležį, susiformavo supernovose ir besijungiančiose neutroninėse žvaigždėse vykstant r procesui, o AGB žvaigždėse – s procesui. Abiejų procesų metu neutronai pagaunami atomo branduolio. Elementai, tokie kaip švinas, susidarė daugiausia dėl sunkesnių elementų radioaktyvaus skilimo.
Atomą sudarančių elementariųjų dalelių savybės
| Dalelė | Krūvis | Masė | ||
|---|---|---|---|---|
| C (kulonas) | sąl.vnt. | kg | a.m.v. (atominis masės vienetas) 1 a.m.v. = 1,6605655 × 10-24 g | |
| Elektronas | -1,6021892 × 10-19 | -1 | 9,109534 × 10-31 | 0,00055 |
| Protonas | 1,6021892 × 10-19 | +1 | 1,672648 × 10-27 | 1,00759 |
| Neutronas | 0 | 0 | 1,674954 × 10-27 | 1,008665 |
Šaltiniai
This article uses material from the Wikipedia Lietuvių article Atomas, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Turinys pateikiamas pagal CC BY-SA 4.0 jei nėra nurodyta kitaip. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Lietuvių (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.