Carbonio
15
| Iste articlo ye en proceso de cambio enta la ortografía oficial de Biquipedia (la Ortografía de l'aragonés de l'Academia Aragonesa d'a Luenga). Puez aduyar a completar este proceso revisando l'articlo, fendo-ie los cambios ortograficos necesarios y sacando dimpués ista plantilla. |
| Carbonio | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||||||||
| Información cheneral | |||||||||||||||||||||||||
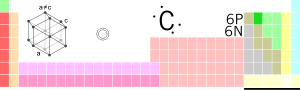
| Nombre, simbolo, numero | Carbonio, C, 6 | ||||||||||||||||||||||||
| Serie quimica | No metal | ||||||||||||||||||||||||
| Grupo, periodo, bloque | 14, 2, p | ||||||||||||||||||||||||
| Color | Negro (grafito) Incoloro (diamant)  | ||||||||||||||||||||||||
| Peso atomico | 12.0107(8) g·mol−1 | ||||||||||||||||||||||||
| Configuración electronica | 1s2 2s2 2p2 | ||||||||||||||||||||||||
| Electrons por capa | 2, 4 | ||||||||||||||||||||||||
| Propiedaz fisicas | |||||||||||||||||||||||||
| Fase | Solido | ||||||||||||||||||||||||
| Densidat (a t.a.) | (Grafito) 1.9-2.3 g·cm−3 | ||||||||||||||||||||||||
| Punto de fusión | 3925 K (3652 °C, 6605 °F) | ||||||||||||||||||||||||
| Entalpía de fusión | (Grafito) ? 100 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpía de fusión | (Diamant) ? 120 kJ·mol−1 | ||||||||||||||||||||||||
| Entalpía de vaporización | 7kJ·mol−1 | ||||||||||||||||||||||||
| Calor especifica | (25 °C) (Grafito) 8.517 J·mol−1·K−1 | ||||||||||||||||||||||||
| Calor especifica | (25 °C) (Diamant) 6.1J·mol−1·K−1 | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Propiedaz atomicas | |||||||||||||||||||||||||
| Estructura cristalina | (Grafito) hexagonal | ||||||||||||||||||||||||
| Estatos d'oxidación | 4, 3 , 2, 1, 0, -1, -2, -3, -4 | ||||||||||||||||||||||||
| Electronegatividat | 2.55 (escala de Pauling) | ||||||||||||||||||||||||
| Enerchías d'ionización (mas) | 1ª: 1086.5 kJ·mol−1 | ||||||||||||||||||||||||
| 2ª: 2352.6 kJ·mol−1 | |||||||||||||||||||||||||
| 3ª: 4620.5 kJ·mol−1 | |||||||||||||||||||||||||
| Radio atomico | 70 pm | ||||||||||||||||||||||||
| Radio atomico (calc.) | 67 pm | ||||||||||||||||||||||||
| Radio covalent | 77 pm | ||||||||||||||||||||||||
| Radio de van der Waals | 170 pm | ||||||||||||||||||||||||
| Atra información | |||||||||||||||||||||||||
| Ordenación magnetica | Diamagnetico | ||||||||||||||||||||||||
| Resistividat electrica | (Grafito) 1.375*10-5Ω·m | ||||||||||||||||||||||||
| Conductividat termal | (300 K) (Grafito) (80–230) W·m−1·K−1 | ||||||||||||||||||||||||
| Conductividat termal | (300 K) (Diamant) (900–2320) W·m−1·K−1 | ||||||||||||||||||||||||
| Difusividat termica | (300 K) (Diamant) (503–1300) mm²/s | ||||||||||||||||||||||||
| Dureza Mohs | (Grafito) 1-2 | ||||||||||||||||||||||||
| Dureza Mohs | (Diamant) 10.0 | ||||||||||||||||||||||||
| Numero CAS | 7440-44-0 | ||||||||||||||||||||||||
| Isotopos mas estables | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
O carbonio ye un elemento quimico de numero atomico 6. Ye un elemento, por un regular, tetravalent, no metalico y solido a temperatura ambient.
Ye l'elemento quimico base en a vida organica, y ye a base d'a quimica organica. Totas as formas de vida conoixidas son formatas de moleculas composatas prencipalment por carbonio, hidrocheno, nitrocheno y oxicheno (amás de muitos atros elementos en menos proporción). Iste elemento no metalico tien a intresant propiedat de poder enlazar-se con él mesmo y con una ampla variedat d'atros elementos. Se conoix cuasi 10 millons de compuestos organicos composaus por estructuras de carbonio.
Caracteristicas prencipals
O carbonio ye un elemento important por diversas razons:
- O carbonio no fue creyato mientres o Big Bang, ya que requiere ta a suya cheneración una colisión triple de particlas alfa (nuclios d'helio). L'universo en primerías s'expandió y enfrío a escape ta fer ixo posible. Pero en l'interior d'as estrelas se troba una concentración suficient d'helio ta transformar bels nuclios d'iste elemento en carbonio a traviés d'o dito proceso triple alfa.
- En l'interior d'as estrelas, o ciclo d'o carbonio y o nitrocheno proporciona parti d'a enerchía producita por o Sol y atras estrelas.
- As suyas diferents estructuras incluyen una d'as sustancias mas tovas conoixitas (o grafito) y una d'as mas duras (o diamant). (se veiga escala de Dureza Mohs)
- Amás, tien una gran afinidat ta enlazar-se quimicament con atros atomos chicoz, y a suya chicota mida le permite a formación d'enlaces multiples. Istas propiedaz permiten a o carbonio formar cuasi 10 millons de compuestos organicos diferents. Istos compuestos de carbonio son a base de toda a vida en a Tierra.
- Con l'oxicheno, forma o dioxido de carbonio, vital ta lo creiximiento d'as plantas y atros autotrofos (se veiga o ciclo d'o carbonio).
- Con o hidrocheno forma numerosos compuestos, ditos chenericament hidrocarburos, esencials ta la industria y o transportes actuals, en forma de combustibles fosils.
- Con hidrocheno y oxicheno, forma una gran variedat de compuestos, como por eixemplo os acidos grasos, esencials ta la vida, y os ésters que dan o suyo gusto caracteristico a las fruitas.
Aplicacions
O carbonio ye un component vital de toz os sers vivos, y sin o cual a vida, tal como a conoixemos, no podría existir. L'actividat economica mas gran relativa a o carbonio (en l'actualidat) ye en forma d'hidrocarburos, os ditos combustibles fosils, gas metano y crudo. O crudo ye emplegato por a industria petroquimica ta producir mas que mas petrolio, benzina, gasolio y queroseno a traviés d'un proceso de destilación en as ditas refinerías. O crudo ye a materia primera ta muitas sustancias sinteticas, entre ellas os omnipresents plasticos.

Atros usos:
- O isotopo 14C, descubierto o 27 de febrero de 1940 se fa servir en a datación radioactiva.
- O grafito ye combinato con archilas ta formar as minas emplegatas en os lapiceros.
- O diamant s'emplega como piedra preciosa con finalidaz decorativas debito a o suyo brillo, y tamién s'emplega ta fabricar esmoladeras de perforación, gracias a la suya dureza.
- O carbonio s'adhibe a o fierro ta fabricar acero.
- O carbonio ye emplegato ta fabricar barras de control en reactors nucleyars
- Os polvos de grafito cuetos s'emplegan como carbón ta fer cocer piezas d'arte y ta atros usos.
- O carbón en pindolas u en polvo s'emplega ta absorber toxinas u verenos en l'aparato dichestivo
As propiedaz quimicas y estructurals d'os fulerenos, en a forma de nanotubos de carbonio, tienen un futuro prometedor en o naixient campo d'a nanotecnolochía.
Historia

O carbonio (l'orichen latín d'a parola proviene d'o carbón), fue descubierto en a prehistoria, y se creyaba cremando material organico (lenya) en manca d'oxicheno. L'obchectivo de l'oficio de carbonero yera a obtención de carbón.
Os diamants, tamién conoixitos dende fa muito tiempo, son consideratos a piedra preciosa por excelencia, debito a la suya gran dureza y brillo.
Os fulerenos, descubiertos en a decada de 1980, tienen un futuro prometedor en o campo d'a nanotecnolochía.
En a naturaleza

O carbonio no se creyó mientres o Big Bang ya que hese amenistato a triple colisión de particlas alfa (nuclios atomicos d'helio) y l'universo s'expandió y enfrió prou a escape ta que a probabilidat de que ixo pasase fuese significativa. A on sí ocurre iste proceso ye en l'interior d'as estrelas (en a fase «RH (Branca horizontal)») a on iste elemento ye abundant, trobando-se amás en atros cuerpos celestes como as estrelas y en as atmosferas d'as planetas. Bels meteoritos contienen diamants microscopicos que se formoron cuan o sistema solar yera encara un disco protoplanetario.
En combinación con atros elementos, o carbonio se troba en l'atmosfera terrestre y disuelto en l'augua, y acompanyato de menors cantidaz de calcio, magnesio y fierro forma masas granizas de roca (calcaria, dolomia, marbre, etc.).
O grafito se troba en grans cantidaz en Estaus Unius, Rusia, Mexico, Groenlandia y India.
Os diamants naturals se troban asociatos a rocas vulcanicas (kimberlita y lamproita). Os mayors depositos de diamants se troban en o continent africano (Sudafrica, Namibia, Botsuana, Republica d'o Congo y Sierra Leona. Existe amás depositos importants en Canadá, Rusia, Brasil y Australia.
Precaucions
Os compuestos de carbonio tienen una gran variedat d'efectos toxicos. O monoixido de carbonio (CO), present en os gases d'escape d'os motors de combustión, y o cianuro (CN-), que a vegadas contamina as menas, son extremadament toxicos ta os mamifers. Muitos atros compuestos no son toxicos, sino esencials ta la vida, pero presentan atros periglos. Gases organicos como o etileno (CH2=CH2), l'acetileno (HC≡CH), y o metano (CH4) son explosivos y inflamables si se mezclan con l'aire.
Se veiga tamién
- Carbonio-14.
Referencias
Vinclos externos
 Se veigan as imáchens de Commons sobre Carbonio.
Se veigan as imáchens de Commons sobre Carbonio.- (en) Información d'o Carbonio en webelements.com.
- (en) Información d'o Carbonio en chemicool.com
This article uses material from the Wikipedia Aragonés article Carbonio, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). O texto ye disponible baixo a Creative Commons Attribution/Share-Alike License; puede que sigan d'aplicación atros termins. Se veiga as Condicions d'uso ta más detalles. Wikipedia ye una marca rechistrada d'a Wiki Du học, una organización sin animo de lucro. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Aragonés (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.