Molibden: Hemijski element sa simbolom Mo i atomskim brojem 42
Molibden je hemijski element sa simbolom Mo i atomskim brojem 42.
Njegovo ime je izvedeno iz novolatinskog molybdaenum, odnosno iz grčkog Μόλυβδος (molybdos) u značenju olovo, jer se za njegove rude često mislilo da su olovne. Minerali molibdena su bili poznati još iz prahistorije, ali je element otkriven (u smislu da je izdiferenciran kao nepoznata supstanca iz mineralnih soli drugih metala) tek 1778. Otkrio ga je Carl Wilhelm Scheele, ali ga je u elementarnom obliku prvi izdvojio Peter Jacob Hjelm 1781. godine.
 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molibden u periodnom sistemu | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Hemijski element, Simbol, Atomski broj | Molibden, Mo, 42 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serija | Prelazni metali | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupa, Perioda, Blok | 6, 5, d | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izgled | sivi metal | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Zastupljenost | 1,4 · 10−3 % | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomska masa | 95,95(1) u | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Atomski radijus (izračunat) | 145 (190) pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kovalentni radijus | 154 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Van der Waalsov radijus | pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronska konfiguracija | [Kr] 5s14d5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Broj elektrona u energetskom nivou | 2, 8, 18, 13, 1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. energija ionizacije | 684,3 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. energija ionizacije | 1560 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. energija ionizacije | 2618 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. energija ionizacije | 4480 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Fizikalne osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Mohsova skala tvrdoće | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Kristalna struktura | kubna prostorno centrirana | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gustoća | 10280 kg/m3 pri 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Magnetizam | paramagnetičan ( = 1,2 · 10−4) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka topljenja | 2896 K (2623 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tačka ključanja | 4885 K (4612 °C) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Molarni volumen | 9,38 · 10-6 m3/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota isparavanja | 617 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplota topljenja | 36 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pritisak pare | 10 Pa pri 2994 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Brzina zvuka | 6190 m/s | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična toplota | 250 J/(kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Specifična električna provodljivost | 18,2 · 106 S/m | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Toplotna provodljivost | 139 W/(m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Hemijske osobine | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oksidacioni broj | 2, 3, 4, 5, 6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektrodni potencijal | -0,152 V (MoO2 + 4e− + 4 H+ → Mo + 2 H2O) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Elektronegativnost | 2,16 (Pauling-skala) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Izotopi | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Sigurnosno obavještenje | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Oznake upozorenja
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Obavještenja o riziku i sigurnosti | R: nema oznaka upozorenja R S: nema oznake upozorenja S | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Ako je moguće i u upotrebi, koriste se osnovne SI jedinice. Ako nije drugačije označeno, svi podaci dobijeni su mjerenjima u normalnim uvjetima. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Molibden se ne javlja u prirodi u slobodnom (elementarnom) obliku na Zemlji. Umjesto toga, on se javlja u mineralima u raznim oksidacijskim stanjima. Elementarni molibden, izgledom sivi srebrenasti metal, ima šestu najvišu tačku topljenja od svih poznatih elemenata. On vrlo lahko gradi tvrde, stabilne karbide u legurama, pa se iz tog razloga najveći dio svjetske proizvodnje elementa (približno 80%) koristi za dobijanje raznih vrsta čelika i legura, uključujući legure izrazito velike čvrstoće te superlegure.
Većina spojeva molibdena je slabo rastvorljiva u vodi, ali je ion molibdata MoO2−
4 rastvorljiv, a formira se kada minerali koji sadrže molibden dođu u kontakt sa kisikom i vodom. U industrijskim količinama, spojevi molibdena (oko 14% svjetske proizvodnje elementa) koriste se u visokotemperaturnim i visokotlačnim aplikacijama, te kao pigmenti i katalizatori.
Enzimi koji sadrže ovaj element su ubjedljivo najčešći katalizatori koje koriste neke bakterije za razbijanje hemijskih veza u atmosferskom molekularnom dušiku, omogućavajući biološko fiksiranje dušika. Poznato je najmanje 50 enzima koji sadrže molibden u bakterijama i životinjama, mada su samo bakterijski i cijanobakterijski enzimi uključeni u fiksiranje dušika. Ove nitrogenaze sadrže molibden u različitim oblicima, koji se razlikuju od drugih molibdenskih enzima. Svi oni sadrže potpuno oksidirani molibden inkorporiran u molibdenski koenzim. Molibden je esencijalni element za život za sve više eukariotske organizme, ali ne i za sve bakterije, najviše zbog toga što ima raznolike funkcije u različitim enzimima molibdenskih kofaktora.
Historija
Molibdenit, osnovna ruda iz koje se danas dobija molibden, ranije je bio poznat kao molibdena. On se često pogrešno zamjenjivao sa grafitom, a često se i kao grafit upotrebljavao. Kao i on, molibdenit se također može koristiti za zatamnjivanje površina ili kao čvrsto sredstvo za podmazivanje (lubrikant). Čak i kada su ljudi počeli razlikovati molibdenu od grafita, i dalje su je zamjenjivali sa običnom olovnom rudom PbS (danas se ona naziva galena). Pojam molibdena potječe od grčki: Μόλυβδος (molybdos), što znači olovo. Međutim, sama grčka riječ je, po nekim mišljenjima, posuđenica iz anatolskog, luvijskog i lidijskog jezika.
Iako postoje naznake da je svjesno legiranje čelika molibdenom korišteno u Japanu u 14. vijeku (približno oko 1330) pri izradi poznatih japanskih mačeva, ta vještina nikad nije zaživjela niti se raširila, pa je kasnije i zaboravljena. Na Zapadu, tek je 1754. godine Bengt Andersson Qvist proučavajući molibdenit otkrio da on ne sadrži olovo, te ne može biti isto što i galena.
Do 1778. godine švedski hemičar Carl Wilhelm Scheele pružio je čvrste dokaze da "molibdena" zaista nije niti galena niti grafit. Umjesto toga, Scheele je u istraživanjima otišao i dalje te tačno zaključio da je "molibdena" zapravo ruda sasvim novog elementa, kojeg je nazvao molibden prema mineralu u čijem je sastavu pronađen i iz kojeg je kasnije i izdvojen. Peter Jacob Hjelm je uspio izolirati metalni molibden 1781. koristeći ugljik i ulje iz lanenog sjemena.
Gotovo cijeli vijek nakon izoliranja, molibden i dalje nije imao nikakve industrijske primjene, uglavnom zbog svoje relativne rijetkosti, poteškoća oko dobijanja čistog metala ali i nerazvijenosti pogodnih metalurških tehnika. Prvobitne čelične legure sa molibdenom bile su obećavajućih osobina u pogledu povećanja tvrdoće, ali trud oko njihove masovne proizvodnje je opao zbog nekonzistentnih rezultata i njihove tendencije ka rekristalizaciji i krhkoći. William D. Coolidge je 1906. prijavio patent za dobijanje duktilnog molibdena. To je dovelo do korištenja ovog metala za izradu grijnih elemenata za visokotemperaturne peći i kao podrška za volframove niti u sijalicama, mada je formiranje oksida i njegova degradacija zahtijevala da se molibden fizički zapečati ili drži u intertnom gasu. Frank E. Elmore je 1913. razvio proces flotacije pjenom kako bi izdvojio molibdenit iz ruda. Do danas je flotacija ostala osnovni proces njegovog izdvajanja.
Tokom Prvog svjetskog rata potražnja za molibdenom je snažno porasla. On se koristio za oklopljavanje vozila te kao zamjena za volfram u brzoreznim čelicima. Neki britanski tenkovi bili su zaštićeni oplatom od manganskog čelika debelog 75 mm, ali je ona bila neefikasna. Te ploče od manganskog čelika zamijenjene su pločama od molibdenovog čelika debelim 25 mm, što je omogućilo veću brzinu tenkova, bolje manevrisanje i zaštitu. Nijemci su također koristili čelik ojačan molibdenom za tešku artiljeriju, kao što je to bio slučaj kod superteške haubice zvane "Debela Bertha". Ovo je bilo iz razloga što se tradicionalni čelik topio pri temperaturama koje je razvijao barut pri ispaljivanju granate teške jednu tonu. Nakon rata, potražnja je opala sve do vremena kada je napredak u metalurgiji omogućio veći razvitak mirnodopskih aplikacija. Tokom Drugog svjetskog rata, molibden je ponovno postao strateška sirovina kao zamjena za volfram u čeličnim legurama.
Osobine
Fizičke
U svom elementarnom, čistom obliku, molibden je srebreno-sivi metal, koji po Mohsovoj skali ima tvrdoću od 5,5. Njegova tačka topljenja iznosi 2623 °C. Među svim elementima u prirodi, samo tantal, osmij, renij, volfram i ugljik imaju višu tačku topljenja od njega. Slaba oksidacija molibdena počinje već pri 300 °C. On ima jedan od najnižih koeficijenata toplotnog širenja (ekspanzije) među svim komercijalno korištenim metalima. Čvrstoća zatezanja molibdenovih žica povećava se oko tri puta, sa oko 10 na 30 GPa, ako se njen promjer smanji sa približno ~50–100 nm na 10 nm.
Hemijske
| Oksidacijsko stanje | Primjer |
|---|---|
| −2 | Na2[Mo2(CO)10] |
| 0 | Mo(CO)6 |
| +1 | Na[C6H6Mo] |
| +2 | MoCl2 |
| +3 | Na3[Mo(CN)]6 |
| +4 | MoS2 |
| +5 | MoCl5 |
| +6 | MoF6 |

Molibden je prelazni metal koji ima elektronegativnost 2,16 na Paulingovoj skali te standardnu atomsku težinu od 95,95 g/mol. Ne reagira vidljivo sa kisikom ili vodom na sobnoj temperaturi, a vidljiva oksidacija se dešava pri temperaturama iznad 600 °C stvarajući molibden-trioksid:
- 2 Mo + 3 O2 → 2 MoO3
Trioksid je volatilan (isparljiv) i sublimira pri visokim temperaturama. Time se onemogućava formiranje neprekinutog zaštitnog sloja oksida, koji bi mogao zaustaviti oksidaciju metala. Molibden ima nekoliko oksidacijskih stanja, među kojima su +4 i +6 najstabilnija. Hemija i spojevi molibdena pokazuju više sličnosti volframu nego hromu. Primjer toga je nestabilnost spojeva molibdena(III) i volframa(III) u usporedbi sa stabilnošću spojeva hroma(III). Najviše oksidacijsko stanje javlja se u spoju molibden(VI)-oksidu (MoO3), dok je uobičajenih spoj sa sumporom molibden-disulfid MoS2.
Molibden(VI)-oksid je rastvorljiv u snažnom alkalnom rastvoru, dajući molibdate (MoO42−). Molibdati su slabiji oksidansi od hromata, ali i oni pokazuju sličnu sklonost da grade kompleksne oksianione pri kondenzaciji pri nižim pH vrijednostima, kao naprimjer [Mo7O24]6− i [Mo8O26]4−. Polimolibdati mogu inkorporirati druge ione u svoju strukturu dajući polioksometalate. Tamno plavi heteropolimolibdati koji sadrže fosfor P[Mo12O40]3− koriste se u spektroskopskoj detekciji fosfora. Široki spektar oksidacijskih stanja molibdena se reflektira kroz različitost hlorida koje gradi:
- Molibden(II)-hlorid MoCl2 (žut)
- Molibden(III)-hlorid MoCl3 (tamno crven)
- Molibden(IV)-hlorid MoCl4 (crn)
- Molibden(V)-hlorid MoCl5 (tamno zelen)
- Molibden(VI)-hlorid MoCl6 (smeđ)
Struktura MoCl2 sastoji se iz klastera Mo6Cl84+ sa četiri hloridna iona zbog kompenzacije naboja.
Poput hroma i nekih drugih prelaznih metala, molibden ima sposobnost formiranja četvorostrukih veza, kao što je to slučaj u spoju Mo2(CH3COO)4. Taj spoj se može transformirati u Mo2Cl84−, koji također ima četvorostruku vezu.
Oksidacijsko stanje 0 (nula) moguće je sa ugljik-monoksidom kao ligandom, u molibden-heksakarbonilu, Mo(CO)6.
Izotopi
Postoji 35 poznatih izotopa molibdena, čije se atomske mase kreću od 83 do 117, kao i četiri metastabilna nuklearna izomera. Sedam izotopa se javlja u prirodi sa atomskim masama: 92, 94, 95, 96, 97, 98 i 100. Od ovih prirodnih izotopa, samo je molibden-100 nestabilan (slabo radioaktivan). Molibden-98 je najrasprostranjeniji izotop, čineći 24,14% udjela. Molibden-100 ima vrijeme poluraspada od oko 1019 godina te se raspada dvostrukim beta raspadom na rutenij-100. Svi izotopi molibdena sa masenim brojevima od 111 do 117 imaju vremena poluraspada od približno 150 ns. Svi nestabilni Mo izotopi raspadaju se na izotope niobija, tehnecija i rutenija.
Najčešće izotopske aplikacije molibdena bazirane se na molibdenu-99, koji je proizvod fisije. On je radioizotopski prethodnik kratkoživućeg nuklearnog izomera tehnecija-99m, koji emitira gama zrake. 99m-Tc se koristi u različitim medicinskim aplikacijama. Na Tehnološkom univerzitetu Delft u Holandiji je 2008. prijavljen patent za proizvodnju molibdena-99 zasnovanu na izotopu molibdena-98.
Rasprostranjenost

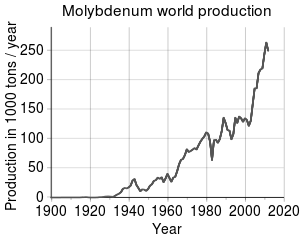
Molibden je 54. element po rasprostranjenosti u Zemljinoj kori, te 25. po rasprostranjenosti u njenim okeanima, uz prosječni udio od 10 ppb (dijelova na milijardu). U svemiru je 42. po rasprostranjenosti. Ruska misija Luna 24 otkrila je zrnca koja sadrže molibden (1 x 0,6 µm) u piroksenskim fragmentima uzetim sa mjesečevog Mare Cristium. Komparativna rijetkost molibdena u Zemljinoj kori u kontrastu je sa njegovom koncentracijom u brojnim rudama rastvorljivim u vodi, često u kombinaciji sa sumporom na isti način kao i bakar, sa kojim se također često i nalazi. Iako je molibden nađen u mineralima poput vulfenita (PbMoO4) i powellita (CaMoO4), njegov osnovni komercijalni izvor i dalje je molibdenit (MoS2). Molibden se kopa kao osnovna ruda ali se izdvaja i kao sporedni proizvod u rudarenju bakra i volframa.
Svjetska proizvodnja molibdena 2011. godine iznosila je 250 hiljada tona. Najveći proizvođači bili su Kina (94.000 t), Sjedinjene Američke Države (64.000 t), Čile (38.000 t), Peru (18.000 t) i Meksiko (12.000 t). Ukupne rezerve ovog metala procjenjuju se na oko 10 miliona tona, a pretežno su koncentrirane na Kinu (4,3 miliona t), SAD (2,7 miliona t) i Čile (1,2 miliona t). Po kontinentima, oko 93% svjetske proizvodnje molibdena je približno ravnomjerno raspoređeno između Sjeverne i Južne Amerike te Kine. Evropa i ostatak Azije (uglavnom Armenija, Rusija, Iran i Mongolija) proizvode ostatak.
Pri obradi molibdenita, ruda se prvo prži na zraku pri temperaturi od oko 700 °C. Pri tome nastaje gasoviti sumpor-dioksid i molibden(VI)-oksid:
- 2 MoS2 + 7 O2 → 2 MoO3 + 4 SO2
Oksidirana ruda se zatim obično izdvaja sa tečnim amonijakom dajući amonij-molibdat:
- MoO3 + 2 NH3 + H2O → (NH4)2(MoO4) + H2O
Bakar, kao nečistoća u molibdenitu, je slabije rastvorljiv u amonijaku. Da bi se on u potpunosti uklonio iz rastvora, taloži se pomoću vodik-sulfida. Amonij-molibdat se prevodi u amonij-dimolibdat, koji se izdvaja kao čvrsta tvar. Njegovim zagrijavanjem dobija se molibden-trioksid:
- (NH4)2Mo2O7 → 2 MoO3 + 2 NH3 + H2O
Sirovi trioksid se dalje može pročišćavati sublimiranjem pri 1100 °C.
Metalni molibden se dobija redukcijom oksida sa vodikom:
- MoO3 + 3 H2 → Mo + 3 H2O
Molibden koji se koristi u industriji čelika reducira se aluminotermijskom reakcijom sa dodatkom željeza kako bi se dobio feromolibden. Uobičajni oblik feromolibdena sadrži oko 60% molibdena.
Molibden na Londonskoj berzi metala ima cijenu od oko 12.000 US$ po toni (stanje: april 2016). U periodu od 1997. do 2003. cijena se održavala na nivou od oko 10.000 US$ po toni. Međutim, zbog porasta potražnje, ona je u junu 2005. dostigla vrhunac od 103.000 US$ po toni. Londonska berza metala je 2008. objavila da će se molibdenom moći regularno trgovati na berzi počev od druge polovine 2009.
Historija rudarenja
Historijski, rudnik Knaben u južnoj Norveškoj, otvoren 1885, bio je prvi rudnik u kojem se namjenski kopala ruda molibdena. Bio je zatvoren u periodu 1973-2007. ali je opet otvoren krajem 2007. godine. Veliki rudnici u američkoj saveznoj državi Colorado (poput rudnika Henderson i Climax) te u kanadskoj provinciji Britanska Kolumbija kopaju molibdenit kao svoj osnovni proizvod, dok mnogi porifirni depoziti bakra poput rudnika Bingham Canyon u Utahu i rudnika Chuquicamata u Čileu proizvode molibden kao sporedni proizvod pri dobijanju bakra.
Upotreba
Legure


Oko 86% proizvedenog molibdena koristi se u metalurškim aplikacijama poput legura, dok se ostatak koristi u vidu spojeva za razne hemijske aplikacije. Procjena udjela industrijske upotrebe molibdena u globalnim razmjerama izgleda približno ovako: 35% za proizvodnju strukturalnog čelika, 25% za nehrđajuće čelike, 14% za razne hemikalije, 9% za alatne i brzorezne čelike, 6% za liveno gvožđe, 6% kao elementarni metalni molibden te 5% za superlegure. Sposobnost molibdena da izdrži ekstremne temperature bez ikakvog značajnijeg širenja ili omekšavanja čini ga izuzetno korisnim u aplikacijama koje podrazumijevaju visoku temperaturu, kao što je proizvodnja oklopnih vozila, dijelova aviona, električnih kontakta, industrijskih motora i niti u sijalicama.
Neke od najčvršćih čeličnih legura (naprimjer čelici 41xx) sadrže od 0,25% do 8% molibdena. I pored tako malehnog udjela, više od 43 hiljade tona molibdena se svake godine potroši kao sredstvo za legiranje nehrđajućih čelika, alatnih čelika, livenog gvožđa i visokotemperaturnih superlegura.
Molibden se također koristi i u čeličnim legurama zbog svoje velike otpornosti na koroziju i lahke zavarivosti. On dopirnosi većoj otpornosti na koroziju nehrđajućih čelika tipa 300 (naročito tip 316) kao i takozvanih super-austenitnih nehrđajućih čelika (poput legura AL-6XN, 254SMO ili 1925hMo). Molibden djeluje tako što povećava naprezanje rešetke, pa time i povećava energiju potrebnu da se rastvore atomi željeza sa površine. On se može koristiti i za poboljšanje otpornosti na koroziju feritskih (naprimjer stepena 444) i martenzitskih (naprimjer 1,4122 i 1,4418) nehrđajućih čelika.
Zbog njegove manje gustoće (u odnosu na volfram) i relativno stabilne cijene, molibden se ponekad koristi umjesto volframa. Takav primjer su M serije brzoreznih čelika kao što su M2, M4 i M42 kao zamjena za T serije čelika, koji sadrže volfram. Molibden se može upotrijebiti i kao legirno sredstvo i zaštitni sloj protiv vatre za druge metale. Iako je njegova tačka topljenja na 2623 °C, on se vrlo brzo oksidira na temperaturi iznad 760 °C, pa je njegova upotreba pogodnija u vakuumskom okruženju.
TZM (Mo (~99%), Ti (~0,5%), Zr (~0,08%) i nešto C) je superlegura molibdena otporna na koroziju kao i na istopljene fluoridne soli pri temperaturama iznad 1300 °C. Ona je gotovo dvostruko snažnija od čistog molibdena, više je duktilna i bolje se zavariva. U testovima vršenim 1100 sati pokazala je takvu otpornost prema koroziji od djelovanja standardnih eutektičnih soli (FLiBe) i para soli korištenih u reaktorima sa istopljenim solima, da je nastalo tako malo korozije koju gotovo nije bilo moguće ni izmjeriti. Druge legure na bazi ovog metala, a koje ne sadrže željezo, nemaju značajniji vid primjene. Naprimjer, zbog otpornosti na koroziju protiv istopljenog cinka, čisti molibden kao i legura Mo/W (70%/30%) se koriste za pravljenje pumpi, cijevi i uređaja za miješanje koji dolaze u dodir s istopljenim cinkom.
Druge aplikacije čistog elementa
- Prah molibdena se koristi u sastavu vještačkih đubriva za neke biljke, kao što je karfiol.
- Elementarni molibden se koristi u analizatorima dušikovih oksida NO, NO2, NOx u električnim centralama za kontrolu zagađivanja. Pri temperaturi od 350 °C element reagira kao katalizator za NO2/NOx gradeći samo NO molekule za konzistentna očitanja pomoću infracrvene svjetlosti.
- Anode od molibdena zamjenjuju volfram u određenim izvorima x-zraka niskog napona, a specijalizirane su za upotrebu u mamografiji.
- Radioaktivni izotop molibden-99 se koristi za dobijanje tehnecija-99m, važnog nuklearnog izomera korištenog u medicinskoj dijagnostici.
Spojevi
- Molibden-disulfid (MoS2) koristi se kao čvrsto sredstvo za podmazivanje (lubrikant) i sredstvo protiv habanja pri visokim temperaturama i pritiscima. On sačinjava veoma snažne slojeve na metalnim površinama te je uobičajen dodatak u HPHT podmazivačima. Čak i u slučaju da takvi podmazivači "zakažu", tanki sloj molibdena bi spriječio kontakt podmazanih dijelova. On također ima i poluprovodničke osobine sa posebnim prednostima u odnosu na tradicionalni silicij ili grafen u elektroničkim aplikacijama. MoS2 se upotrebljava i kao katalizator pri hidrokrekiranju frakcija nafte koje sadrže dušik, sumpor i kisik.
- Molibden-disilicid (MoSi2) je električno provodljiva keramika, koja se prvenstveno koristi u grijačim elementima pri radnim temperaturama iznad 1500 °C u kontaktu sa zrakom.
- Molibden-trioksid (MoO3) se koristi kao adheziv između emajliranih predmeta i metala. Olovo-molibdat (vulfenit) istaložen zajedno sa olovo-hromatom i olovo-sulfatom sačinjava svijetlo narandžasti pigment korišten za keramiku i plastiku.
- Mješoviti oksidi na bazi molibdena su raznovrsno upotrebljivi katalizatori u hemijskoj industriji. Neki od tih primjera su katalizatori za selektivnu oksidaciju propilena u akrolein i akrilsku kiselinu te amoksidacija propilena do akrilonitrila. Pogodni katalizatori i procesi za direktnu selektivnu oksidaciju propana u akrilsku kiselinu još uvijek su u fazi istraživanja.
- Amonij-heptamolibdat se koristi u biološkim procedurama bojenja.
- Krečno-natronsko staklo obloženo molibdenom korišteno je za proizvodnju CIGS solarnih ćelija.
- Fosfomolibdenska kiselina se koristi u tankoslojnoj hromatografiji za bojenje uzoraka.
- Izotop molibdena-99 je roditeljski radioizotop tehnecija-99m, koji se koristi u mnogim medicinskim procedurama. Izotop se prodaje i skladišti u vidu molibdata.
Biološki značaj
Nitrogenaze

Najznačajnija uloga molibdena u živim organizmima je u vidu metalnog heteroatoma na aktivnom mjestu u određenim enzimima. Pri fiksiranju dušika kod nekih bakterija, enzim nitrogenaza, a koji je uključen u krajnji korak reduciranja molekularnog dušika, obično sadrži molibden na aktivnom mjestu (mada su poznati slučajevi zamjene molibdena sa željezom ili vanadijem). Struktura katalitičkog centra enzima je slična onoj kod željezo-sumpornih bjelančevina: ona inkorporira Fe4S3 i veći broj MoFe3S3 klastera.
Reakcija koju izvode enzimi nitrogenaze je sljedeća:
Sa protonima i elektronima iz transportnog lanca elektrona, dušik se reducira do amonijaka i slobodnog gasovitog vodika. Ovaj proces troši energiju, tako što mu je neophodna hidroliza ATP-a do ADP-a plus slobodni fosfat (Pi).
Godine 2008. objavljen je dokaz o "nedostatku" molibdena u prvobitnim okeanima na Zemlji, a predstavljao je ograničavajući faktor tokom gotovo dvije milijarde godina kasnije evolucije eukariotskog života (koji uključuje gotovo sve životinje i biljke) iz razloga što eukarioti ne mogu fiksirati dušik pa zato većinu pogodno oksidiranog dušika za dobijanje organskih dušikovih spojeva (između ostalih i bjelančevina) dobijaju od prokariotskih bakterija. Nedostatak molibdena rezultat je relativnog nedostatka kisika u prvobitnim okeanima. Većina molibdenovih spojeva ima slabu rastvorljivost u vodi, ali je molibdatni ion MoO42− rastvorljiv i nastaje kada su molibdenovi minerali u kontaktu sa kisikom i vodom. Kada su prvi životni oblici počeli otpuštati kisik u okeane, on je pomogao rastvarati molibden u rastvorljive molibdate, uzimajući ga iz minerala sa dna mora, i čineći ga po prvi put dostupnim bakterijama koje fiksiraju dušik, što im je omogućilo da višim formama života pruže više korisnih dušikovih spojeva. Godine 2013. iznesena je teorija da su bor i molibden katalizirali proizvodnju RNK na Marsu, a tako nastali život je prenesen na Zemlju pomoću meteorita prije 3 milijarde godine.
Iako je kisik omogućio fiksiranje dušika tako što je učinio molibden dostupnim u vodi, on je također i direktno zatrovao enzime nitrogenaze. Zbog toga, u prahistoriji Zemljine atmosfere, nakon što se kisik pojavio u velikim količinama u zraku i vodi, organizmima koji su nastavili fiksirati dušik u aerobskim uslovima bilo je neophodno da izdvoje i zaštite njihove enzime za fiksiranje u heterocistama ili sličnim strukturama od suviška kisika. Takve reakcije strukturne izolacije fiksacije dušika od utjecaja viška kisika u aerobnim organizmima odvija se i danas.
Kofaktorski enzim
Iako molibden gradi spojeve sa mnogim organskim molekulama, uključujući i ugljikohidrate i aminokiseline, on se također transporuje kroz ljudski organizam u vidu MoO42−. Do 2002. pronađeno je i proučeno najmanje 50 enzima koji sadrže molibden, uglavnom u bakterijama, a broj novootkrivenih raste svake godine; ti enzimi uključuju aldehid oksidazu, sulfit oksidazu i ksantin oksidazu. Kod nekih životinja, kao i kod ljudi, oksidacija ksantina od urinske kiseline, koja predstavlja proces purinskog katabolizma, katalizirana je ksantin oksidazom, enzimom koji u svom sastavu sadrži molibden. Aktivnost ksantin oksidaze je direktno proporcionalna količini molibdena u tijelu. Ipak, ekstremno visoke koncentracije molibdena djeluju suprotno ovom trendu, te mogu djelovati kao inhibitor i za purinski katabolizam i za druge procese. Smatra se da koncentracija molibdena može utjecati na sintezu bjelančevina, metabolizam i rast.
Kod životinja i biljaka, triciklični spoj zvani molibdopterin (koji ne sadrži molibden), reagira sa molibdatom te gradi potpuni koenzim koji sadrži molibden nazvan molibdenski kofaktor. Pored ranije navedenih filogenetski prastarih molibdenskih nitrogenaza, koje fiksiraju dušik kod nekih bakterija i cijanobakterija, svi enzimi koji koriste molibden a koji su pronađeni u prirodi, koriste molibdenski kofaktor, gdje je molibden u oksidacijskom stanju VI, slično kao i molibdati. Molibdenski enzimi kod biljaka i životinja kataliziraju oksidaciju, a ponekad i redukciju određenih malih molekula, kao dio regulacije ciklusâ dušika, sumpora i ugljika.
Reference
Vanjski linkovi
 Molibden na Wiki Commonsu
Molibden na Wiki Commonsu
This article uses material from the Wikipedia Bosanski article Molibden, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Sadržaj je dostupan pod licencom CC BY-SA 4.0 osim ako nije drugačije navedeno. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Bosanski (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.


