Darmštatij
Darmštatij, tudi darmstadtij, je kemični element s simbolom Ds in atomskim številom 110.
Je izredno radioaktivni sintetični element. Najbolj stabilni znani izotop, darmštatij-281, ima razpolovni čas približno 12,7 sekund. Darmštatij je leta 1994 prvič ustvaril GSI Helmholtz Center za raziskave težkih ionov v bližini mesta Darmstadt v Nemčiji, po katerem je tudi dobil ime.
| Darmštatij | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Izgovarjava | IPA: [darmštatij] | |||||||||||||||||||
| Masno število | [281] | |||||||||||||||||||
| Darmštatij v periodnem sistemu | ||||||||||||||||||||
| ||||||||||||||||||||
| Vrstno število (Z) | 110 | |||||||||||||||||||
| Skupina | skupina 10 | |||||||||||||||||||
| Perioda | perioda 7 | |||||||||||||||||||
| Blok | blok d | |||||||||||||||||||
| Razporeditev elektronov | [Rn] 5f14 6d8 7s2 (napovedano) | |||||||||||||||||||
| Razporeditev elektronov po lupini | 2, 8, 18, 32, 32, 16, 2 (predvideno) | |||||||||||||||||||
| Fizikalne lastnosti | ||||||||||||||||||||
| Faza snovi pri STP | solid (predvideno) | |||||||||||||||||||
| Gostota (blizu s.t.) | 26–27 g/cm3 (predvideno) | |||||||||||||||||||
| Lastnosti atoma | ||||||||||||||||||||
| Oksidacijska stanja | (0), (+2), (+4), (+6), (+8) (napovedano) | |||||||||||||||||||
| Ionizacijske energije |
| |||||||||||||||||||
| Atomski polmer | empirično: 132 pm (predvideno) | |||||||||||||||||||
| Kovalentni polmer | 128 pm (ocena) | |||||||||||||||||||
| Druge lastnosti | ||||||||||||||||||||
| Pojavljanje v naravi | umetno | |||||||||||||||||||
| Kristalna struktura | telesno centrirana kubična (tck) (predvideno) | |||||||||||||||||||
| Številka CAS | 54083-77-1 | |||||||||||||||||||
| Zgodovina | ||||||||||||||||||||
| Poimenovanje | po Darmstadtu v Nemčiji, kjer so ga odkrili | |||||||||||||||||||
| Odkritje | Gesellschaft für Schwerionenforschung (1994) | |||||||||||||||||||
| Najpomembnejši izotopi darmštatija | ||||||||||||||||||||
| ||||||||||||||||||||
V periodnem sistemu je transaktinoidni element v d-bloku. Je član sedme periode in je uvrščen v 10. skupino elementov, čeprav še niso bili izvedeni nobeni kemični poskusi, ki bi potrdili, da se obnaša kot težji homolog platine ali kot osmi član 6d serije prehodnih kovin. Izračunano je, da ima darmštatij podobne lastnosti kot njegovi lažji homologi, nikelj, paladij in platina.
Uvod
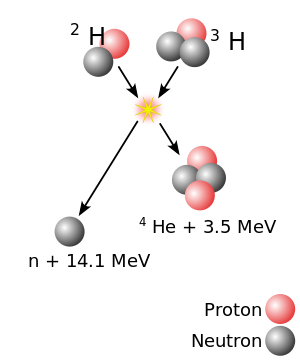
Najtežja jedra nastanejo v jedrskih reakcijah, ki združijo dve drugi jedri neenake velikosti v eno; v grobem velja, da bolj, kot sta jedri glede na maso neenaki, večja je možnost, da bosta reagirali. Iz materiala iz težjih jeder se naredi tarča, ki jo nato bombardira snop lažjih jeder. Dve jedri se lahko združita v eno samo, če se dovolj približata; normalno se jedra (vsa pozitivno nabita) med seboj odbijajo zaradi elektrostatičnega odbijanja. Močna interakcija lahko to odbojnost premaga, vendar le na zelo kratki razdalji od jedra; jedra žarka se tako močno pospeši, da postane taka odbojnost nepomembna v primerjavi s hitrostjo jedra v snopu. Samo približevanje ni dovolj, da se dve jedri zlijeta: ko se dve jedri približata, običajno ostaneta skupaj približno 10−20 sekunde in se nato ločita (ne nujno v isti sestavi kot pred reakcijo), namesto da tvorita eno jedro. Če pride do fuzije, je začasna združitev, imenovana sestavljeno jedro, vzbujeno stanje. Da bi izgubilo energijo vzbujenja in doseglo stabilnejše stanje, se sestavljeno jedro razcepi ali izvrže enega ali več nevtronov, ki odnesejo odvečno energijo.
Žarek prehaja skozi tarčo in doseže naslednjo komoro – separator; če novo jedro nastane, potuje skupaj s tem žarkom. V separatorju se novo nastalo jedro loči od drugih nuklidov (prvotnega žarka in vseh drugih reakcijskih produktov) in prenese v pregradno-površinski detektor, ki jedro ustavi. Tam je zaznana natančna lokacija prihajajočega udarca na detektor; prav tako tudi njegova energija in čas prihoda. Prenos traja približno 10−6 sekunde; da jo lahko zazna, jedro med tem ne sme razpasti. Jedro se ponovno zabeleži, ko se zabeleži njegovo razpadanje in izmeri lokacija, energija in čas razpada.
Stabilnost jedra zagotavlja močna interakcija, vendar je njegov obseg zelo kratek; ko jedra povečamo, vpliv močne interakcije na najbolj oddaljene nukleone (protone in nevtrone) oslabi. Prav tako jedro raztrga elektrostatično odbijanje med protoni, saj ima neomejen domet. Za jedra najtežjih elementov je tako teoretično napovedan in doslej opazovan predvsem propad z razpadnimi načini, ki jih povzroča takšna odbijanje: alfa razpad in spontana cepitev; ti načini prevladujejo za jedra supertežkih elementov. Alfa razpadi so zaznani z oddajanjem alfa delcev, produkte razpada pa je enostavno določiti pred dejanskim razpadom; če takšno razpadanje ali niz zaporednih razpadov ustvari znano jedro, lahko prvotni produkt reakcije aritmetično določimo. Spontana cepitev proizvaja različna jedra kot produkte, zato prvotnega nuklida ni mogoče določiti od njegovih produktov.
Informacije, ki so na voljo fizikom, katerih namen je sintetizirati enega najtežjih elementov, so torej informacije, zbrane na detektorjih: lokacija, energija in čas prihoda delca na detektor ter podatki o njegovem razpadu. Fiziki analizirajo te podatke in skušajo ugotoviti ali jih je dejansko povzročil nov element in ali jih ni mogel povzročiti drugačen nuklid od tistega, katerega so iskali. Pridobljeni podatki pogosto ne zadoščajo za sklep, da je bil nov element vsekakor ustvarjen in če za opažene učinke ni druge razlage, so bile narejene napake pri interpretaciji podatkov.
Zgodovina

Odkritje
Darmštatij je bil prvič ustvarjen 9. novembra 1994, na Inštitutu za raziskave težkih ionov (Gesellschaft für Schwerionenforschung, GSI) v Darmstadtu, Nemčija. Ustvarila sta ga Peter Armbruster in Gottfried Münzenberg, pod vodstvom Sigurda Hofmanna. Skupina je v pospeševalniku težkih ionov bombardirala svinec-208 s pospešenimi jedri niklja-62 in zaznala en atom izotopa darmštatija-269:
- 208
82Pb + 62
28Ni → 269
110Ds + 1
0Nt
V isti seriji poskusov je ista ekipa izvedla tudi reakcijo z uporabo težjih ionov niklja-64. Med dvema potekoma je bilo s korelacijo z znanimi lastnostmi razpada njegovega produkta prepričljivo zaznanih 9 atomov 271Ds:
- 208
82Pb + 64
28Ni → 271
110Ds + 1
0Nt
Pred tem so bili izvedeni neuspešni poskusi sinteze v letih 1986–87 na Združenem inštitutu za jedrske raziskave v Dubni (takrat v Sovjetski zvezi) in leta 1990 na GSI. Poskus leta 1995 v Narodnem laboratoriju Lawrence Berkeley je pokazal znake, ki kažejo (vendar ne dokončno), na odkritje novega izotopa 267Ds, ki je nastal pri bombardiranju 209Bi s 59Co. Podoben neprepričljiv poskus je leta 1994 na JINR pokazal znake proizvodnje 273Ds iz 244Pu in 34S. Vsaka ekipa je predlagala svoje ime za element 110: ameriška ekipa je predlagala hahnij po Ottu Hahnu, da bi rešila situacijo glede elementa 105 (za kar so že dolgo predlagali to ime), ruska ekipa je predlagala bekerelij po Henriju Becquerelu in nemška ekipa je predlagala darmštatij po Darmstadtu, kraju njihovega inštituta. Skupna delovna skupina IUPAC / IUPAP (JWP) je skupino GSI v svojem poročilu za leto 2001 prepoznala kot odkritelje in jim dodelila pravico predlagati ime elementa.
Poimenovanje
Z uporabo Mendelejeve nomenklature za neimenovane in neodkrite elemente bi moral biti darmštatij znan kot eka-platina. Leta 1979 je IUPAC objavil priporočila, v skladu s katerimi naj bi se element imenoval ununnilij (z ustreznim simbolom Uun), tj. sistematično ime elementa kot začasno ime, dokler element ni odkrit (in odkritje nato potrjeno) ter določeno stalno ime. Čeprav so se priporočila pogosto uporabljajo v kemijski skupnosti na vseh ravneh, od učilnic kemije do poglobljenih učbenikov, so bila med znanstveniki s tega področja večinoma prezrta, ki so ga imenovali "element 110" s simbolom E110, (110) ali celo preprosto 110.
Leta 1996 je ruska ekipa predlagala ime bekerelij po Henriju Becquerelu. Ameriška ekipa je leta 1997 predlagala ime hahnij po Ottu Hahnu (prej je bilo to ime uporabljeno za element 105).
Ime darmštatij (Ds) je skupina GSI predlagala v čast mestu Darmstadt, kjer je bil element odkrit. Skupina GSI je prvotno razmišljala tudi o poimenovanju elementa vikshavsij po predmestju Darmstadta, znanem kot Wixhausen, kjer je bil element odkrit, vendar se je na koncu odločila za darmštatij. Policij je bil predlagan tudi za šalo, saj je bila telefonska številka v sili v Nemčiji 1-1-0. Novo ime darmštatij je uradno priporočil IUPAC 16. avgusta 2003.
Izotopi
Darmštatij nima stabilnih ali naravnih izotopov. V laboratoriju je bilo sintetiziranih več radioaktivnih izotopov, bodisi z zlivanjem dveh atomov bodisi z opazovanjem razpada težjih elementov. Poročali so o devetih različnih izotopov darmštatija z atomskimi masami 267, 269–271, 273, 277 in 279–281, čeprav darmštatij-267 ni potrjen. Trije izotopi darmštatija, darmštatij-270, darmštatij-271 in darmštatij-281, imajo tudi metastabilna stanja, čeprav stanje darmštatija-281 ni potrjeno. Večina teh razpada pretežno z alfa razpadom, nekateri pa s spontano cepitvijo.
Stabilnost in razpolovni časi
Vsi izotopi darmštatija so izredno nestabilni in radioaktivni; na splošno so težji izotopi stabilnejši od lažjih. Najstabilnejši znani izotop darmštatija, 281Ds, je tudi najtežji znani izotop darmštatija; njegova razpolovna doba je 12,7 sekund. Izotop 279Ds ima razpolovno dobo 0,18 sekund in nepotrjeni 281mDs pa ima razpolovno doba 0,9 sekund. Preostalih sedem izotopov in dve metastabilni stanji imajo razpolovni čas med 1 mikrosekundo in 70 milisekundami. Nekateri še neodkriti izotopi darmštatija bi lahko imeli lahko daljši razpolovni čas.
Teoretični izračun v modelu kvantnega tuneliranja reproducira eksperimentalne podatke o razpolovni dobi alfa razpada za znane izotope darmštatija. Prav tako se napoveduje, da bi imel neodkriti izotop 294Ds, ki ima magično število nevtronov (184), razpolovni čas alfa razpada približno 311 let; popolnoma enak pristop pa napoveduje ~3500-letni razpolovni čas alfa razpada za nemagični izotop 293Ds.
Predvidene lastnosti
Z izjemo jedrskih lastnosti niso bile izmerjene nobene lastnosti darmštatija ali njegovih spojin; to je posledica izjemno omejene in drage proizvodnje ter in dejstva, da darmštatij (in njegovi starši) zelo hitro propadejo. Lastnosti kovine darmštatija tako ostajajo neznane in na voljo so le napovedi.
Kemične
Darmštatij je osmi član serije 6d prehodnih kovin in bi moral biti podoben kovinam iz platinske skupine. Izračuni njegovih ionizacijskih energij ter atomskih in ionskih polmerov so podobni izračunom njegovega lažjega homologa platine, kar pomeni, da bodo osnovne lastnosti darmštatija podobne tistim od drugih elementov 10. skupine, niklja, paladija in platine.
Napovedovanju verjetnih kemijskih lastnosti darmštatija v zadnjem času niso posvetili veliko pozornosti. darmštatij bi moral biti zelo žlahtna kovina. Napovedan standardni potencial zmanjšanja za par Ds2+/Ds je 1,7 V. Na podlagi najstabilnejših oksidacijskih stanj lažjih elementov 10. skupine naj bi bila najstabilnejša oksidacijska stanja darmštatija +6, +4 in +2, vendar naj bi bilo nevtralno stanje najbolj stabilno v vodnih raztopinah. Za primerjavo, znano je, da le paladij in platina kažeta največje oksidacijsko stanje v skupini, +6, medtem ko sta najbolj stabilni stanji za nikelj in paladij +4 in +2. Pričakuje se tudi, da so lahko najvišja oksidacijska stanja elementov med borijem (element 107) in darmštatijem (element 110) stabilna v plinastem agregatnem stanju, ne pa tudi v vodni raztopini. Darmštatijev heksafluorid (DsF6) naj bi imel zelo podobne lastnosti kot njegov lažji homolog platinov heksafluorid (PtF6), ki ima zelo podobne elektronske strukture in ionizacijske energije. Prav tako naj bi imel enako oktaedrsko molekularno geometrijo kot PtF6. Drugi predvideni spojini darmštatija sta darmštatijev karbid (DsC) in darmštatijev tetraklorid (DsCl4), ki naj bi se obnašali kot njuna lažja homologa. Za razliko od platine, ki prednostno tvori kompleks s cianidom v svojem +2 oksidacijskem stanju, Pt(CN)2, naj bi darmštatij raje ostal v nevtralnem stanju in tvoril Ds(CN)2−
2 in tvoril močno povezavo Ds–C z nekaterimi znaki večkratne vezi.
Fizikalne in atomske
Darmštatij naj bi bil v normalnih pogojih trdnina in kristaliziral v telesno centrirani kubični strukturi, za razliko od njegovih lažjih sorodnikov, ki kristalizirajo v ploskovno centrirani kubični strukturi, saj naj bi imel drugačno gostoto elektronskega naboja. Moral bi biti zelo težka kovina z gostoto približno 34,8 g/cm3. Za primerjavo ima najgostejši znani element, ki mu je bila izmerjena gostota, osmij, gostoto le 22,61 g/cm3. To je posledica velike atomske teže darmštatija, kontrakcije lantanidov in aktinidov ter relativističnih učinkov, čeprav bi bilo ustvarjanje dovolj darmštatija za merjenje te količine nepraktično in bi vzorec hitro propadel.
Valenčna elektronska konfiguracija darmštatija je izračunana, da je 6d8 7s2, kar upošteva Aufbaujevo načelo in ne sledi platinasti valenčni elektronski konfiguraciji 5d9 6s1. To je posledica relativistične stabilizacije elektronskega para 7s2 v celotni sedmi periodi, tako da ni pričakovati, da bi imel kateri koli od elementov od 104 do 112 elektronske konfiguracije, ki bi kršila Aufbaujevo načelo. Atomski radij darmštatija naj bi bil približno 132 pm.
Eksperimentalna kemija
Nedvoumna določitev kemijskih lastnosti darmštatija še ni bila ugotovljena zaradi kratkega razpolovnega časa izotopov darmštatija in omejenega števila verjetnih hlapnih spojin, ki bi jih lahko preučevali v zelo majhnem obsegu. Ena redkih spojin darmštatija, ki je verjetno dovolj hlapna, je darmštatijev heksafluorid (DsF
6); njegov lažji homolog platinov heksafluorid (PtF
6) je hlapen nad 60 °C in zato je lahko tudi analogna spojina darmštatija dovolj hlapna; hlapni oktafluorid (DsF
8) je tudi možen. Da bi kemijske študije lahko opravili na transaktinoidih, morajo biti proizvedeni vsaj štirje atomi, razpolovna doba uporabljenih izotopov mora biti najmanj 1 sekunda, hitrost proizvodnje pa mora biti vsaj en atom na teden. Čeprav je razpolovna doba 281Ds, najbolj stabilnega potrjenega izotopa darmštatija, 12,7 sekunde, dovolj dolgo za izvedbo kemijskih študij, je še eno oviro potrebo premagati. Mora se povečati stopnja proizvodnje izotopov darmštatija in omogočiti izvajanje poskusov tedne ali mesece, da se lahko dobijo statistično relevantni rezultati. Ločevanje in odkrivanje je treba izvajati neprekinjeno, da se ločijo izotopi darmštatija, in imeti avtomatiziran sistemski kemični eksperiment v plinastem agregatnem stanju in raztopini darmštatija, saj naj bi bili donosi za težje elemente manjši od teh za lažje elemente; nekatere tehnike ločevanja, ki se uporabljajo za borij in hasij, bi lahko ponovno uporabili. Eksperimentalna kemija darmštatija ni prejela toliko pozornosti, kot težji elementi od kopernicija do livermorija.
Bolj nevtronsko bogati izotopi darmštatija so najbolj stabilni in so zato bolj obetavni za kemijske študije. Lahko jih dobimo le posredno iz alfa razpada težjih elementov, posredne metode sinteze pa niso tako ugodne za kemijske študije kot metode neposredne sinteze. Bolj nevtronsko bogata izotopa 276Ds in 277Ds bi lahko nastali neposredno v reakciji med torijem-232 in kalcijem-48, vendar naj bi bil donos nizek. Poleg tega je bila ta reakcija že preizkušena brez uspeha, in novejši poskusi, ki so z indirektnimi metodami uspešno sintetizirali 277Ds, kažejo, da ima kratek razpolovni čas 3,5 ms, ne dovolj dolgo za izvajanje kemijskih študij. Edini znani izotop darmštatija z razpolovno dobo, dovolj dolgo za kemijske raziskave, je 281Ds, ki bi ga morali proizvesti kot produkt 289Fl.
Glej tudi
- Izotopi darmštatija
- Alotropi darmštatija
- Darmštatijeve anorganske spojine
- Darmštatijeve organske spojine
- Radioaktivnost
- Nikljeva skupina
- Darmstadt
- Otok stabilnosti
Opombe
Sklici
Viri
- Audi, G.; Kondev, F. G.; Wang, M.; in sod. (2017). »The NUBASE2016 evaluation of nuclear properties«. Chinese Physics C. 41 (3): 030001. Bibcode:2017ChPhC..41c0001A. doi:10.1088/1674-1137/41/3/030001.
- Beiser, A. (2003). Concepts of modern physics (6. izd.). McGraw-Hill. ISBN 978-0-07-244848-1. OCLC 48965418.
{{navedi knjigo}}: Vzdrževanje CS1: ref podvaja privzeto (povezava) - Hoffman, D. C.; Ghiorso, A.; Seaborg, G. T. (2000). The Transuranium People: The Inside Story. World Scientific. ISBN 978-1-78-326244-1.
- Kragh, H. (2018). From Transuranic to Superheavy Elements: A Story of Dispute and Creation. Springer. ISBN 978-3-319-75813-8.
{{navedi knjigo}}: Vzdrževanje CS1: ref podvaja privzeto (povezava) - Zagrebaev, V.; Karpov, A.; Greiner, W. (2013). »Future of superheavy element research: Which nuclei could be synthesized within the next few years?«. Journal of Physics: Conference Series. 420 (1): 012001. arXiv:1207.5700. Bibcode:2013JPhCS.420a2001Z. doi:10.1088/1742-6596/420/1/012001. ISSN 1742-6588.
Zunanje povezave
- WebElements.com – Ds (angleško)
- Video o darmštatiju na kanalu Periodic Videos (angleško s podnapisi v portugalščini)
This article uses material from the Wikipedia Slovenščina article Darmštatij, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Vsebina je na voljo pod licenco CC BY-SA 4.0, razen če je navedeno drugače. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Slovenščina (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.


