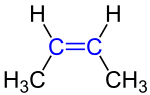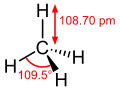分子
「分子」得尋 - 維基大典
君所欲求,蓋名曰"分子"者乎?此共筆臺已有之。 又羅得數條,悉列於下。
- 分子,一譯微塵,原子之所合也,原子、分子、離子三者概謂曰:「端(微粒)」,其極微不能目見,義大利化學家阿伏伽德羅名之。質性之微極,各施其能,各彰其性,可變乎化學反應也。 異質相合,為化合物,水、二氧化碳是也。同元合,則為單質,氫氣、氧氣、硫磺是也。又有獨立者,若氦、氖之屬。然鹽類之輩,非分子也,蓋其陰陽偏阿一極,為離子也。……
- 超固體者,物態也,諸分子、原子、原子對者,列之有序,又有超流體之性者也。其處同一低溫基態,屬玻愛凝聚態。超固體者,諸性奇特,諸類分子者,皆類乎同一分子,無熵,不黏,又無摩擦力,善流動如液體者,又有晶體之構矣。 二零零四年,美格致家陳鴻渭有察,凍固氦至極低之溫,又使其振蕩,見粒子無摩擦,似液氦超流體矣。固氦此性,此前未有察之矣。……
 ,體形善變矣。夫科技遞之千里,亦察有各殊異之物,其態異於三相者,遂以分子之牽附結連類之。 微觀其構,夫固體之粒子互縛,定地而動;液體者,粒子雖有牽力,尚能流動;氣體者,分子細隙少力,能四遊矣;亦有曰電漿者,蓋火熱之際,電子自去,分子電離,以離子之力牽之也,性異氣者。固、液、氣、電漿者,基本四相也。……
,體形善變矣。夫科技遞之千里,亦察有各殊異之物,其態異於三相者,遂以分子之牽附結連類之。 微觀其構,夫固體之粒子互縛,定地而動;液體者,粒子雖有牽力,尚能流動;氣體者,分子細隙少力,能四遊矣;亦有曰電漿者,蓋火熱之際,電子自去,分子電離,以離子之力牽之也,性異氣者。固、液、氣、電漿者,基本四相也。…… 化學鍵,一譯化學黏結,乃粒子間之牽附吸引,攀纏結繞,此謂之鍵,其粒子可原子、可離子、可分子。鍵之類甚繁,強弱、鍵長亦有相異,強者之能強甚,曰共價鍵、離子鍵、金屬鍵,弱者弱能爾,有分子間力、色散力、氫鍵之類。 主文:離子鍵 若並金屬、非金屬,金屬去電子而非金屬得之,兩者並合,此謂離子鍵。……
化學鍵,一譯化學黏結,乃粒子間之牽附吸引,攀纏結繞,此謂之鍵,其粒子可原子、可離子、可分子。鍵之類甚繁,強弱、鍵長亦有相異,強者之能強甚,曰共價鍵、離子鍵、金屬鍵,弱者弱能爾,有分子間力、色散力、氫鍵之類。 主文:離子鍵 若並金屬、非金屬,金屬去電子而非金屬得之,兩者並合,此謂離子鍵。…… 共之,無有電子之得失,故原子無荷矣。共價鍵強於氫鍵,而近離子鍵矣。一九一六年,吉爾伯特·路易斯首倡之。 原子以共價鍵者,多為非金屬也。多為分子,亦有成晶體者也。 夫原子軌域者,繫以共價鍵之原子者,共予單電子,為電子對,乃為共有之電子也。乎量子力學者,又以各原子之軌域相並,所得分子軌域者為共價鍵矣。……
共之,無有電子之得失,故原子無荷矣。共價鍵強於氫鍵,而近離子鍵矣。一九一六年,吉爾伯特·路易斯首倡之。 原子以共價鍵者,多為非金屬也。多為分子,亦有成晶體者也。 夫原子軌域者,繫以共價鍵之原子者,共予單電子,為電子對,乃為共有之電子也。乎量子力學者,又以各原子之軌域相並,所得分子軌域者為共價鍵矣。……- 硫酸根者,書SO42−,銨根者,書NH4+。 欲書核素者,當於左上書其原子量。 以磷三十二所構之磷酸根者,記32PO43−。 最簡式者,亦稱實驗式,分子間之元素比也,過氧化氫者(H2O2),最簡式書HO。用以析間之元素分子比也。 欲書官品,可以分子式、結構式書之。 分子式者,表其成份也,乙烯之分子式如下: C2H4 結構式者,表其結構也。乙烯之結構式如下:……
 氮者,化學元素也,符號為N,原子序七,屬非金屬,無色,常存為雙原子分子。甲於大氣,凡百有七十八。 因性頗惰故,清徐壽譯曰「淡氣」。後統一部首,凡氣體入气部,遂改今名。 以價廉,性惰故,作護衛之氣,用諸煉金、高溫合成。效雖不及氦氬,所費低廉。施以高熱,可製氮化物如氮化硅陶瓷、氮化硼等等。又,可製氮肥。其液態可冷凍他物。……
氮者,化學元素也,符號為N,原子序七,屬非金屬,無色,常存為雙原子分子。甲於大氣,凡百有七十八。 因性頗惰故,清徐壽譯曰「淡氣」。後統一部首,凡氣體入气部,遂改今名。 以價廉,性惰故,作護衛之氣,用諸煉金、高溫合成。效雖不及氦氬,所費低廉。施以高熱,可製氮化物如氮化硅陶瓷、氮化硼等等。又,可製氮肥。其液態可冷凍他物。…… 有數原子軌域者,加以混成,能量簡並而成者,曰混成軌域也。可述鍵性,亦可輔以價層電子對互斥論,以析分子軌域之形狀。一九三一年,化學家鮑林倡之。 雜化軌道,首論者鮑氏也,釋以甲烷者諸分子之構。初,為闡化學之制立之,後人亦多用之,至今亦能析官品之構也。 主文:原子軌域……
有數原子軌域者,加以混成,能量簡並而成者,曰混成軌域也。可述鍵性,亦可輔以價層電子對互斥論,以析分子軌域之形狀。一九三一年,化學家鮑林倡之。 雜化軌道,首論者鮑氏也,釋以甲烷者諸分子之構。初,為闡化學之制立之,後人亦多用之,至今亦能析官品之構也。 主文:原子軌域……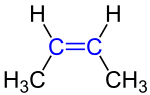 凡分子有二碳雙鍵者,其旋轉皆有所限,故其形常有二種,此之謂順反異構。 丁-2-烯分子之形有二種,其甲基或俱在同側,或相對而處。俱在同側者曰順,相對而處者曰反。 順者之性與反者甚異。順者之沸温常高於反者,蓋順者有極性,其分子之力大,非高温不能分之。而反者無極性,故其沸温常低。……
凡分子有二碳雙鍵者,其旋轉皆有所限,故其形常有二種,此之謂順反異構。 丁-2-烯分子之形有二種,其甲基或俱在同側,或相對而處。俱在同側者曰順,相對而處者曰反。 順者之性與反者甚異。順者之沸温常高於反者,蓋順者有極性,其分子之力大,非高温不能分之。而反者無極性,故其沸温常低。…… 銩,化學元素也,符號為Tm,原子序六十九。屬鑭系元素、稀土金屬。氧化態以正三為最常,見諸氧化物、鹵化物等;以其電子殼幾滿故,正二亦穩。在水中,合九水分子而成配合物。 一八七九年,瑞典化學家克勒韋(Per Teodor Cleve)初得氧化銩。一九一一年,始提純銩金屬。……
銩,化學元素也,符號為Tm,原子序六十九。屬鑭系元素、稀土金屬。氧化態以正三為最常,見諸氧化物、鹵化物等;以其電子殼幾滿故,正二亦穩。在水中,合九水分子而成配合物。 一八七九年,瑞典化學家克勒韋(Per Teodor Cleve)初得氧化銩。一九一一年,始提純銩金屬。…… 氟,化學元素也,符號為F,原子序九,屬鹵素。色淡黃,敏於腐蝕,有毒。 性烈,難以自存。常合二為一,成雙原子分子,稱氟氣。電負度甲於各元素,鮑林標度下,幾近於四(四為最高)。常溫之下,已可化合於他物,並生熱。 以性烈故,氟與氟化物,俱可合於貴氣體(初以為貴氣體絕無反應,後以相合於氟故,方知誤)。一九六……
氟,化學元素也,符號為F,原子序九,屬鹵素。色淡黃,敏於腐蝕,有毒。 性烈,難以自存。常合二為一,成雙原子分子,稱氟氣。電負度甲於各元素,鮑林標度下,幾近於四(四為最高)。常溫之下,已可化合於他物,並生熱。 以性烈故,氟與氟化物,俱可合於貴氣體(初以為貴氣體絕無反應,後以相合於氟故,方知誤)。一九六……- 分子有二碳雙鍵者,其旋轉皆有所限,故此分子常有二形。譬如1,2-氯乙烯之形有二種,氯原子或俱在同側,或相對而處。俱在同側者曰順,相對而處者曰反。此之謂順反異構。對映異構謂二分子相為鏡像而不同也。若其中碳原子所引四原子團皆異,則謂之手性,言其若手不相稱也。分子有手性者,其鏡像異乎己也。若分子無手性,則其鏡像同乎己。……
- 元素者,又譯原質、原行、極微,物質之本,非分子、原子、離子之謂,乃以質子數論其類也。今察元素凡一百十八,其九十四常存於天地,餘者不安(非穩定結構也),「放射者」也,多轉瞬即逝。 原子序者,原子之質子數也。原子,電子繞核而為之;核,質子與中子並而為之,故有電子、中子數異,而質子數相侔者,亦屬同素矣。化變者,電子數有更,然未有易其元素者。……
- 晶體者,乃原子、離子、分子各列而序,週而复始,乎結晶之時、列而有幾何定形之固體者也。 坤輿之間,固體者,多為晶體者矣。夫液氣非晶質者,乎合宜之況,亦可成晶矣。 本徵必有常構,週而有律,亦使有以下通性: 性均,宏觀晶體各處,其性同侔; 各向異性,向不同而性不同矣; 具多面體之形; 熔點銳而顯也; 對稱;……
 構近石墨,善導電。 式常書P。 深黑屑狀。 白磷(黃磷) 式書P4 味臭、性毒。 淡黃半透之固體。於水難溶而於苯、乙醚易溶焉,貯於水中。 紅磷(赤磷) 共價巨分子。 式常書P。 鮮紅屑狀,無毒。 紫磷 層構,而異於黑磷。 式常書P。 其同位素有十三,自磷廿七迄磷卅九,性穩者獨磷卅一,餘者皆不安,常衰變而不存矣。……
構近石墨,善導電。 式常書P。 深黑屑狀。 白磷(黃磷) 式書P4 味臭、性毒。 淡黃半透之固體。於水難溶而於苯、乙醚易溶焉,貯於水中。 紅磷(赤磷) 共價巨分子。 式常書P。 鮮紅屑狀,無毒。 紫磷 層構,而異於黑磷。 式常書P。 其同位素有十三,自磷廿七迄磷卅九,性穩者獨磷卅一,餘者皆不安,常衰變而不存矣。…… 鐿,化學元素也,符號為Yb,原子序七十。屬鑭系元素、稀土金屬。氧化態以正三為最常,見諸氧化物、鹵化物等,惟正二亦穩。在水中,合九水分子而成配合物。以其電子殼悉滿故,密度、沸點俱異於諸鑭系元素。 一八七八年,瑞士化學家馬里歷(Jean Charles Galissard de……
鐿,化學元素也,符號為Yb,原子序七十。屬鑭系元素、稀土金屬。氧化態以正三為最常,見諸氧化物、鹵化物等,惟正二亦穩。在水中,合九水分子而成配合物。以其電子殼悉滿故,密度、沸點俱異於諸鑭系元素。 一八七八年,瑞士化學家馬里歷(Jean Charles Galissard de…… 昔中外物觀,皆以水為本素,即中土五行論、希臘四元素說也。 水( H 2 O {\displaystyle {\ce {H_2O}}} ),以分子存世,呈角形,鍵角凡百四度有半。 在植物者,光照於斯,合於二氧化碳、葉綠素,成氧、成醣。此即光合作用。 在電石者,相合而生乙炔、氫氧化鈣。 在氧化鈣者,相合而生氫氧化鈣。……
昔中外物觀,皆以水為本素,即中土五行論、希臘四元素說也。 水( H 2 O {\displaystyle {\ce {H_2O}}} ),以分子存世,呈角形,鍵角凡百四度有半。 在植物者,光照於斯,合於二氧化碳、葉綠素,成氧、成醣。此即光合作用。 在電石者,相合而生乙炔、氫氧化鈣。 在氧化鈣者,相合而生氫氧化鈣。……- 內能者,一物內分子之動能勢能和也。 能量單位為焦耳也,然亦可使公斤成焦耳每公斤以量內能。 內能一文似未成。宜善之。……
 氫氰酸 (氰化氫,甲腈),式書HCN,偏分子化合物也。 屬酸類,味似苦杏仁,常溫下為易揮發性液或無色氣體。氫氰酸及其鹽皆為劇毒。 欲製氫氰酸,可加硫酸於氰化鉀中焉。 KCN+H2SO4=KHSO4+HCN↑……
氫氰酸 (氰化氫,甲腈),式書HCN,偏分子化合物也。 屬酸類,味似苦杏仁,常溫下為易揮發性液或無色氣體。氫氰酸及其鹽皆為劇毒。 欲製氫氰酸,可加硫酸於氰化鉀中焉。 KCN+H2SO4=KHSO4+HCN↑……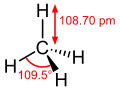 甲烷,化學式曰CH4,其內碳原子有一、氫原子有四,屬烷烴。有機物中,其為最簡。分子結構,屬正四面體。四鍵之長、相互之角,悉無異也。 日常為氣,無色無味,易於起火。化合於氧,則得水、二氧化碳。與氯氣並照於光,可得一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氫。 以易燃故,可為燃料,稱天然氣。寒涼之地,有固態者,曰可燃冰。……
甲烷,化學式曰CH4,其內碳原子有一、氫原子有四,屬烷烴。有機物中,其為最簡。分子結構,屬正四面體。四鍵之長、相互之角,悉無異也。 日常為氣,無色無味,易於起火。化合於氧,則得水、二氧化碳。與氯氣並照於光,可得一氯甲烷、二氯甲烷、三氯甲烷、四氯甲烷、氯化氫。 以易燃故,可為燃料,稱天然氣。寒涼之地,有固態者,曰可燃冰。……