효소: 생체 촉매
효소(酵素, 영어: enzyme)는 기질과 결합해서 효소-기질 복합체를 형성하여 화학 반응의 활성화 에너지를 낮춤으로써 물질대사의 속도를 증가시키는 생체 촉매이다. 그리고 경우에 따라 속도를 조절하는 생체 보호기능을 수행하기도 한다. 효소는 기질을 생성물로 알려진 다른 분자로 전환시킨다. 세포의 거의 모든 대사 과정은 생명을 유지할 수 있을 만큼의 빠른 속도로 일어나야 하기 때문에 효소 촉매작용을 필요로 한다. 대사 경로는 효소에 의존하여 개별 단계들을 촉매한다. 효소에 대해 연구하는 학문을 효소학이라고 하며, 최근에 유사효소(pseudoenzyme) 분석의 새로운 분야가 성장하여 진화 과정에서 일부 효소가 생물학적 촉매 능력을 상실했다는 것을 알게 되었으며, 이는 종종 유사효소의 아미노산 서열과 특이한 유사촉매(pseudocatalytic) 특성에 기인한다.
효소는 5,000가지 이상의 생화학 반응 유형들을 촉매하는 것으로 알려져 있다. 대부분의 효소들은 단백질이지만, 일부 효소들은 촉매 기능을 가지고 있는 RNA 분자이다. 촉매 기능을 가지고 있는 RNA를 리보자임이라고 한다. 효소의 특이성은 독특한 3차원 구조에서 비롯된다.
다른 촉매들과 마찬가지로, 효소는 화학 반응의 활성화 에너지를 낮춤으로써 반응 속도를 증가시킨다. 어떤 효소들은 기질을 생성물로 전환시키는 것을 수백만 배 더 빨리 일어나게 할 수 있다. 극단적인 예로는 오로티딘 일인산 탈카복실화효소가 있는데, 이 효소는 수백만 년이 걸릴 수 있는 반응을 밀리세컨드 단위로 일어나게 한다. 화학적으로 효소는 다른 촉매들과 같아서 화학 반응에서 소모되지 않으며 반응의 평형을 변화시키지도 않는다. 효소는 훨씬 더 특이적이라는 점에서 대부분의 다른 촉매들과 다르다. 효소의 활성은 다른 분자에 의해 영향을 받을 수 있다. 저해제는 효소의 활성을 감소시키는 분자인 반면, 활성화제는 효소의 활성을 증가시키는 분자이다. 많은 약과 독은 효소 저해제이다. 효소의 활성은 최적 온도와 pH 범위 밖에서 현저하게 감소하며, 많은 효소들은 과도한 열에 노출되면 영구적으로 변성되어 구조와 촉매 특성을 상실하게 된다.
예를 들어 어떤 효소들은 항생제의 합성에 상업적으로 사용된다. 일부 가정용 제품들은 화학 반응의 속도를 높이기 위해 효소를 사용한다. 생물학적 세탁 세제에 들어 있는 효소는 옷에 묻은 단백질, 녹말, 지방의 얼룩을 분해하고, 고기 연화제에 들어 있는 효소는 단백질들을 더 작은 분자들로 분해하여 고기를 씹기 쉽게 만든다.
어원과 역사

18세기 말과 19세기 초에 위 분비물에 의한 고기의 소화 및 식물 추출물과 침에 의해 녹말이 당으로 전환된다는 것은 알려져 있었지만, 이러한 현상이 일어나는 메커니즘은 밝혀져 있지 않았다.
프랑스의 화학자 앙셀름 파얜은 1833년에 다이아스테이스라고 불리는 효소를 최초로 발견하였다. 수십년 후에 루이 파스퇴르는 효모에 의한 알코올 발효를 연구할 때 발효가 발효소(ferment)라고 불리는 효모 세포 내에 포함된 생명력에 의해 촉매된다고 결론 짓고, 이러한 일이 살아 있는 생명체 내에서만 가능하다고 생각했다. 파스퇴르는 "알코올 발효는 세포의 죽음이나 부패가 아닌 효모 세포의 생명 및 구성과 상호연관된 작용이다"라고 기록했다.
1877년에 독일의 생리학자 빌헬름 퀴네는 이러한 과정을 설명하기 위해 그리스어 "ἔνζυμον" (독일어로 "leavened"라는 의미로 영어로 "in yeast"라는 뜻)에서 유래한 "효소(enzyme)"라는 용어를 만들었다. 한자 번역어인 효소(酵素)는 "효모(酵母, yeast)에 들어있는 어떤 요소(要素)"라는 뜻이다. 효소라는 단어는 나중에 펩신과 같은 살아있지 않는 것들을 지칭하는데 사용되었으며, 발효소(ferment)는 생명체에 의해 생성된 화학적 활성을 지칭하는데 사용되었다.
1897년에 에두아르트 부흐너는 효모 추출물의 연구에 대한 그의 첫 번째 논문을 제출했다. 베를린 훔볼트 대학교에서 행해진 일련의 실험에서 부흐너는 혼합물에 살아있는 효모 세포가 없을 때에도 "효모 추출물에 의해" 당이 발효된다는 것을 발견했다. 부흐너는 설탕(수크로스)을 발효시키는 효소를 "치메이스(zymase)"라고 이름지었다. 부흐너는 "그의 생화학적 연구와 무세포 발효의 발견"에 대한 공로로 1907년에 노벨 화학상을 수상했다. 부흐너의 예를 따라 효소는 일반적으로 그 효소가 수행하는 반응에 따라 명명된다. 보통 접미사 "-ase"는 기질의 이름 뒤에 붙이거나(예: 락테이스는 락토스(젖당) 분해효소이다), 반응의 유형(예: DNA 중합효소는 DNA 중합체를 형성한다)에 따른다.
효소의 생화학적 정체는 1900년대 초에 이르기까지 여전히 알려지지 않았다. 많은 과학자들은 효소의 활성이 단백질과 관련되어 있다고 지적했지만 몇몇 과학자들은(노벨 화학상 수상자인 리하르트 빌슈테터 같은) 단백질이 효소의 운반체일 뿐이며, 단백질 자체는 촉매 작용을 할 수 없다고 주장했다. 그러나 1926년에 제임스 B. 섬너는 유레이스(요소가수분해효소)가 순수 단백질이며 결정화할 수 있음을 밝혀냈고, 1937년에 카탈레이스도 마찬가지임을 보여주었다. 순수 단백질이 효소일 수 있다는 결론은 소화 효소인 펩신, 트립신, 키모트립신을 연구한 존 하워드 노스럽, 웬들 메러디스 스탠리에 의해 결정적으로 증명되었다. 제임스 B. 섬너, 존 하워드 노스럽, 웬들 메러디스 스탠리는 1946년에 노벨 화학상을 공동 수상했다.
효소가 결정화될 수 있다는 발견으로 과학자들은 마침내 X선 결정학으로 효소의 구조를 밝혀낼 수 있게 되었다. 이러한 시도는 눈물, 침, 달걀 흰자에서 발견되며 일부 세균의 외막을 분해하는 효소인 라이소자임에 대해 처음으로 수행되었으며, 라이소자임의 구조는 데이비드 칠턴 필립스가 이끈 연구진에 의해 밝혀졌고, 1965년에 발표되었다. 이렇게 밝혀진 라이소자임의 고해상도 구조는 구조생물학의 시작과 효소가 원자 수준에서 어떻게 작동하는지 이해하려는 노력의 성과를 보여준다.
명명 규칙
효소의 이름은 보통 효소의 기질이나 효소가 촉매하는 화학 반응에서 유래된 단어 끝에 접미사 "-에이스(-ase)"를 붙여서 짓는다. 락테이스(lactase), 알코올 탈수소효소(alcohol dehydrogenase), DNA 중합효소(DNA polymerase) 등이 그 예이다. 동일한 화학 반응을 촉해하는 서로 다른 효소들을 동질효소라고 한다.
국제 생화학·분자생물학 연합(IUBMB)은 효소에 대한 명명법인 EC 번호를 고안했다. 각각의 효소는 "효소 위원회(Enzyme Commission)"를 의미하는 "EC"가 앞에 붙는 일련의 4개의 숫자로 기술된다. 4개의 숫자 중 첫 번째 숫자는 효소의 반응 메커니즘에 따라 크게 분류되는 부류를 의미한다.
최상위 분류 체계는 다음과 같다.
- EC 1, 산화 환원 효소: 산화·환원 반응을 촉매한다.
- EC 2, 전이 효소: 한 기질의 작용기(예: 메틸기, 인산기)를 다른 기질로 옮기는 반응을 촉매한다.
- EC 3, 가수 분해 효소: 물을 첨가하여 기질을 분해하는 반응을 촉매한다.
- EC 4, 분해 효소: 가수분해와 산화 이외의 방법으로 다양한 결합을 분해하는 반응을 촉매한다.
- EC 5, 이성질화 효소: 단일 분자 내에서 원자 배열을 바꾸어 이성질체로 만드는 반응을 촉매한다.
- EC 6, 연결 효소: 에너지를 소비해서 두 개의 기질을 서로 연결시키는 반응을 촉매한다.
이러한 분류들은 기질, 생성물 및 반응 메커니즘과 같은 다른 특징들에 의해 보다 세분화된다. 효소는 4개의 숫자로 지정된다. 예를 들어, 헥소키네이스(EC 2.7.1.1)에서 첫 번째 숫자 2는 최상위 분류인 전이효소를, 두 번째 숫자 7은 인산기 전이효소를, 세 번째 숫자 1은 하이드록시기를 수용체로 가지는 인산기 전이효소를, 네 번째 숫자 1은 인산기의 수용체인 D-글루코스를 나타낸다.
구조

효소는 일반적으로 단독으로 또는 더 큰 복합체로 작용하는 구상 단백질이다. 아미노산의 서열은 효소의 촉매 활성을 결정하는 구조를 지정한다. 구조가 기능을 결정하지만, 새로운 효소 활성은 아직 구조만으로는 예측할 수 없다. 효소 구조는 가열하거나 화학적 변성 물질에 노출될 때 접힘이 풀리며(변성), 이러한 구조의 파괴는 전형적으로 효소 활성의 소실을 야기한다. 효소의 변성은 일반적으로 효소의 최적 온도보다 높은 온도와 관련이 있다. 그 결과, 온천과 같은 화산 환경에 사는 세균으로부터 얻은 효소는 고온에서 기능을 할 수 있는 능력 때문에 매우 중요하며, 효소 촉매 반응을 매우 빠른 속도로 일어날 수 있게 한다.
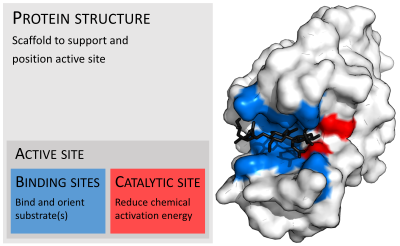
효소는 보통 기질보다 훨씬 더 크다. 효소의 크기는 단지 62개의 아미노산 잔기를 가지고 있는 단량체인 4-옥살로크로톤산 호변이성질화효소로부터 2,500개가 넘는 아미노산 잔기를 가지고 있는 동물의 지방산 생성효소까지 다양하다. 효소 구조의 작은 부분(약 2~4개의 아미노산)만이 촉매 작용에 직접적으로 관여하는데, 이 부위를 촉매 부위라고 한다. 이러한 촉매 부위는 잔기들이 기질을 배향시키는 하나 이상의 결합 부위 옆에 위치한다. 촉매 부위와 결합 부위는 함께 효소의 활성 부위를 구성한다. 효소 구조의 나머지 대부분은 활성 부위의 정확한 방향 및 역학 관계를 유지하는 역할을 한다.
일부 효소에서는 촉매 작용에 아미노산이 직접적으로 관여하지 않는 대신에 보조 인자와 결합하고 그 방향을 정하는 역할을 한다. 효소 구조는 또한 작은 분자의 결합이 효소의 활성을 증가 또는 감소시키는 입체구조적 변화를 일으키는 다른 자리 입체성 조절 부위를 포함할 수 있다.
리보자임이라고 불리는 소수의 RNA 기반 생물학적 촉매가 존재하며, 리보자임은 단독으로 또는 단백질과 복합체를 형성하여 작용할 수 있다. 리보자임들 중 가장 일반적인 것은 촉매 기능을 가진 RNA와 단백질의 복합체인 리보솜이다.
반응 메커니즘
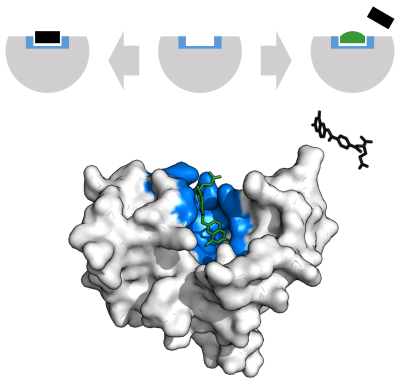
기질의 결합
효소는 화학 반응을 촉매하기 전에 기질과 결합해야 한다. 효소는 보통 어떤 기질과 결합하고, 기질의 화학 반응을 촉매하는데 있어서 특이성이 있다. 특이성이란 기질 및 기질과 경쟁하는 분자들을 식별할 수 있는 효소의 능력을 말한다. 특이성은 상보적인 구조, 전하 및 친수성/소수성을 갖는 포켓에 기질이 결합함으로써 충족된다. 따라서 효소는 화학선택성, 위치선택성, 입체특이성이 매우 비슷한 기질 분자들을 구별할 수 있다.
가장 높은 특이성과 정확성을 보여주는 일부 효소들은 게놈의 복제 및 발현에 관여한다. 이들 효소들 중 일부는 "교정" 기작을 가지고 있다. 여기서 DNA 중합효소와 같은 효소는 첫 번째 단계에서 반응을 촉매한 다음, 두 번째 단계에서 생성물이 올바른지를 확인한다. 이러한 두 단계 반응은 높은 정확도를 가지고 있는 포유류의 DNA 중합효소에서 평균적으로 1억 회의 반응당 오류 횟수가 1회 미만의 오류률을 나타내도록 한다. 이와 유사한 교정 기작은 RNA 중합효소, 아미노아실 tRNA 합성효소, 리보솜에서도 발견된다.
반대로, 일부 효소들은 광범위한 기질 특이성을 가지며, 다양한 생리학적 관련 기질들에 작용하는 효소 다중기능성(enzyme promiscuity)을 나타낸다. 많은 효소들은 우연하게 일어나는 작은 부차적인 활성(예: 분자진화의 중립설)을 가지고 있는데, 이것은 새로운 기능의 진화적 선택에 대한 출발점이 될 수 있다.
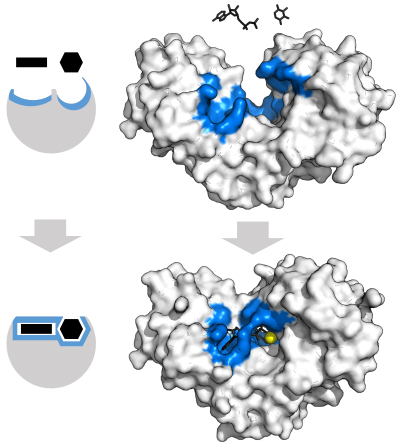
자물쇠와 열쇠 모델
관찰된 효소의 특이성을 설명하기 위해 에밀 피셔는 1894년에 효소와 기질이 서로 정확하게 들어맞는 상호보완적이고 기하학적으로 특이적인 형태를 가지고 있다고 제안했다. 이러한 모델을 보통 자물쇠와 열쇠 모델이라고 한다. 자물쇠와 열쇠 모델은 효소의 특이성을 설명하지만, 효소가 반응을 촉매하면서 달성되는 전이 상태의 안정성은 설명하지 못한다.
유도 적합 모델
1958년에 다니엘 코쉬랜드(Daniel Koshland)는 자물쇠와 열쇠 모델에 대한 수정을 제안했다. 효소는 다소 유연한 구조이기 때문에 활성 부위는 기질이 효소와 상호작용을 함에 따라 계속해서 구조를 바꿀 수 있다. 결과적으로 기질은 효소의 고정된 활성 부위에 단순히 결합하는 것이 아니다. 활성 부위를 구성하는 아미노산 곁사슬들은 효소가 촉매 작용을 수행할 수 있는 정확한 위치로 자리잡게 된다. 글리코시데이스와 같은 일부 경우에 기질 분자도 활성 부위로 들어가면서 모양이 약간 변화하기도 한다. 활성 부위는 기질이 완전하게 결합할 때까지 계속해서 변화하며 완전히 결합되면 최종적인 형태와 전하 분포가 결정된다. 유도 적합은 입체구조적 교정 기작을 통해 분자 간의 경쟁 및 혼선이 존재하는 경우에 분자 인식의 충실도를 향상시킬 수 있다.
촉매작용
효소는 여러 가지 방법으로 활성화 에너지를 낮춤으로서 반응 속도를 높일 수 있다(ΔG‡, 깁스 자유 에너지).
- 전이 상태를 안정화시킴:
- 활성화 에너지를 낮추기 위해 전이 상태에서 상호보완적인 전하 분포로 환경을 조성한다.
- 대체 반응 경로를 제공함:
- 일시적으로 기질과 반응하여 공유 결합된 중간생성물을 형성하여 전이 상태에서의 활성화 에너지를 낮춘다.
- 기질의 바닥 상태를 불안정하게 만듦:
- 결합된 기질을 전이 상태의 형태로 변형시켜 전이 상태에 도달하는데 필요로 하는 에너지를 감소시킨다.
- 기질을 반응이 일어날 수 있는 적절한 위치에 배치시켜 반응 엔트로피 변화를 감소시킨다. 이 메커니즘이 촉매작용에 미치는 영향은 상대적으로 작다.
효소는 이러한 여러 가지 메커니즘을 동시에 사용할 수 있다. 예를 들어, 트립신과 같은 프로테이스는 촉매 삼잔기를 사용하여 공유결합성 촉매작용을 수행하고, 산소 음이온 구멍을 사용하여 전이 상태에서 전하의 축적을 안정화시키며, 기질인 물을 사용하여 가수분해를 수행한다.
동역학
효소는 경직되고, 정적인 구조가 아니다. 대신에 효소는 내부에 복잡한 역동적인 움직임을 가지고 있다. 즉, 개별 아미노산 잔기, 단백질 루프를 형성하는 잔기들의 그룹, 2차 구조의 단위, 심지어 전체 단백질 도메인과 같은 효소 구조의 일부분의 움직임을 의미한다. 이러한 움직임들은 평형 상태에서 상호 변환하는 약간 다른 구조의 입체 구조적 변화를 유발한다. 이와 같은 입체구조적 변화 내의 다른 상태들은 효소 기능의 다른 측면들과 연관될 수 있다. 예를 들어, 다이하이드로폴산 환원효소의 상이한 입체 구조는 촉매 주기에서 기질의 결합, 촉매 작용 보조 인자의 방출, 생성물의 방출과 관련된다.
다른 자리 입체성 조절
다른 자리 입체성 조절 부위는 활성 부위와 구별되는 효소의 주머니로 세포 환경의 분자들과 결합한다. 이러한 분자들은 활성 부위로 전달되는 효소의 변형이나 동역학에서 입체 구조의 변화를 일으켜 효소의 반응 속도에 영향을 미친다. 이와 같은 방식으로 다른 자리 입체성 조절 상호작용은 효소를 저해하거나 활성화시킬 수 있다. 효소의 대사 경로에서 대사 산물의 이전 단계 또는 이후 단계와의 다른 자리 입체성 조절 상호작용은 피드백 조절을 유발하고, 나머지 대사 경로를 통한 흐름에 따라 효소의 활성을 변화시킨다.
보조 인자

일부 효소들은 단백질로만 이루어져 있다. 대다수의 효소들은 보조 인자라고 불리는 비단백질 분자를 효소의 활성을 위해 필요로 한다. 보조 인자는 무기 화합물(예: 금속 이온, 철-황 클러스터) 또는 유기 화합물(예: 플라빈, 헴)일 수 있다. 이러한 보조 인자들은 여러 가지 목적으로 사용되는데, 예를 들어 금속 이온은 활성 부위 내에서 친핵체를 안정화시키는데 도움을 줄 수 있다. 유기 보조 인자는 일반적으로 반응이 끝나면 효소의 활성 부위에서 분리될 수 있는 조효소이거나, 효소와 강하게 결합되어 있는 보결분자단일 수 있다. 유기 보결분자단은 공유 결합될 수 있다(예: 피루브산 카복실화효소에서의 비오틴).
보조 인자를 포함하고 있는 효소의 예로 탄산무수화효소가 있으며, 탄산무수화효소는 활성 부위의 일부분에 아연 보조 인자가 결합되어 있다. 이렇게 강하게 결합된 이온 또는 분자는 일반적으로 활성 부위에서 발견되며, 촉매 작용에 관여한다. 예를 들어, 플라빈 및 헴 보조 인자는 산화환원 반응에 관여한다.
보조 인자를 필요로 하는 효소에서 보조 인자를 제외한 효소의 단백질 부분을 주효소(主酵素, apoenzyme)라고 한다. 주효소와 보조 인자가 결합해 완전한 효소 활성을 갖는 상태를 전효소(全酵素, holoenzyme)라고 한다. 또한 전효소라는 용어는 DNA 중합효소와 같은 여러 개의 단백질 소단위체를 가지고 있는 효소에 사용할 수도 있는데, 여기서 전효소는 효소 활성에 필요한 모든 소단위체들을 포함하고 있는 완전한 복합체를 의미한다.
조효소
조효소는 약하게 또는 강하게 효소와 결합할 수 있는 작은 유기 분자이다. 조효소는 어떤 효소에서 다른 효소로 작용기를 운반한다. 이에 대한 예로는 니코틴아마이드 아데닌 다이뉴클레오타이드(NAD+), 니코틴아마이드 아데닌 다이뉴클레오타이드 인산(NADP+) 및 아데노신 삼인산(ATP) 등이 있다. 플라빈 모노뉴클레오타이드(FMN), 플라빈 아데닌 다이뉴클레오타이드(FAD), 티아민 피로인산(TPP), 테트라하이드로폴산(THF)과 같은 일부 조효소들은 비타민으로부터 유래한다. 이러한 조효소들은 체내에서 신생합성으로 합성될 수 없으며, 밀접하게 관련된 화합물(비타민)은 반드시 식사를 통해 섭취해서 얻어야 한다. 조효소가 운반하는 작용기들은 다음과 같다.
- NAD+ 또는 NADP+는 수소화물(H−)을 운반한다.
- ATP는 인산기를 운반한다.
- 조효소 A는 아세틸기를 운반한다.
- 폴산은 폼일기, 메테닐기, 메틸기를 운반한다.
- S-아데노실메티오닌은 메틸기를 운반한다.
효소 작용의 결과로 조효소가 화학적으로 변하기 때문에 보조 효소를 다양한 효소들에 공통적인 특별한 종류의 기질 또는 두 번째 기질로 간주하는 것이 유용하다. 예를 들어, 약 1,000가지의 효소들이 조효소로 NADH를 사용하는 것으로 알려져 있다.
조효소는 대개 지속적으로 재생되며, 그 농도는 세포 내에서 일정 수준으로 유지된다. 예를 들어, NADPH는 오탄당 인산 경로 및 메티오닌 아데노실트랜스퍼레이스에 의한 S-아데노실메티오닌을 통해 재생된다. 이러한 지속적인 재생은 소량의 조효소가 매우 집중적으로 사용될 수 있음을 의미한다. 예를 들어, 사람이 하루에 사용하는 ATP의 총량은 자신의 몸무게보다 더 많다.
열역학
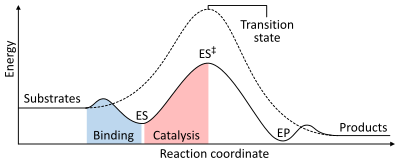
모든 촉매와 마찬가지로, 효소는 반응의 화학 평형에는 영향을 주지 않는다. 효소가 존재할 때도 효소가 없을 때와 마찬가지로 같은 방향으로 반응이 진행되며, 단지 반응 속도가 더 빨라진다. 예를 들어, 탄산무수화효소는 반응물의 농도에 따라 양방향으로 반응을 촉매한다.
-
(조직에서 CO2 농도가 높을 때)
()
-
(폐에서 CO2 농도가 낮을 때)
()
반응 속도는 생성물로 전환시키기 위한 전이 상태를 형성하는데 필요한 활성화 에너지에 따라 달라진다. 효소는 반응의 활성화 에너지를 낮춤으로써 반응 속도를 증가시킨다. 첫째, 효소-기질 복합체(ES 복합체)를 형성하여 활성화 에너지를 낮춘다. 둘째, 효소는 효소가 없을 때의 반응에 비해 더 적은 에너지가 필요하도록 전이 상태를 안정화(ES‡)시킨다. 마지막으로 효소-생성물 복합체(EP 복합체)는 해리되어 생성물을 방출한다.
효소는 두 개 이상의 반응들을 짝지을 수 있으므로 열역학적으로 유리한 반응을 이용하여 열역학적으로 불리한 반응을 진행시켜서 생성물의 결합된 에너지를 기질보다 낮출 수 있다. 예를 들어, ATP의 가수분해는 종종 다른 화학 반응을 일으키는데 사용된다.
효소의 활성화 에너지
엔트로피와 깁스 자유 에너지
엔트로피란 화학 반응계에서 구성 성분들의 무질서도를 나타내는 것이다. 화학 반응계에서는 이런 엔트로피의 변화를 ΔS로 표시한다. 무작위성이 증가될 때는 ΔS가 양의 값이 되고, 무작위성이 감소할 때는 ΔS가 음의 값이 된다.
일에 실제로 이용할 수 있는 에너지를 자유 에너지라고 한다. 깁스는 화학 반응에서 이러한 에너지 변화와 관련된 이론을 제시했다. 닫힌 반응계에서 화학 반응은 평형이 될 때까지 자발적으로 진행한다. 이런 상황에서 일정한 온도, 압력에서 반응계가 초기상태에서 평형상태로 변화됨에 따른 에너지 변화가 자유 에너지 변화가 된다.
그것을 식으로 나타낸 것이 G=H-TS이다. G는 자유 에너지를 나타내는 것이며, 이 자유 에너지의 양은 엔탈피(H), 엔트로피(S), 절대온도(T)를 통해 결정된다. 즉, 어떤 화학 반응이 일정한 온도에서 일어날 때, 자유 에너지의 변화는 ΔH(붕괴되거나 형성되는 화학결합과 비공유결합성 상호작용의 종류와 수에 의해 결정됨)와 무작위성의 변화인 ΔS에 의하여 결정되는 것이다(ΔG = ΔH - TΔS).
ΔG의 크기는 특별한 화학 반응이나 반응계가 초기의 평형으로부터 얼마나 멀어져 있는가에 의존한다. 화학 반응에 관계되는 각각의 화합물은 결합의 종류와 수에 관계되는 일정량의 위치 에너지를 가지고 있다. 자유 에너지의 감소 반응은 자발적으로 일어나는 반응으로, 생성물은 기질보다 더 적은 자유 에너지를 가지므로 반응이 일어남에 따라 자유 에너지를 방출하고 일을 할 수 있다. 이 때 방출된 에너지의 일부만이 일을 수행하는데 사용된다. 이와 다르게 자유 에너지의 증가 반응은 에너지를 흡수하는 반응이다.
생물학적으로 보았을 때 세포의 중요 기능을 수행하는 단백질과 같은 거대분자들의 형성에 필요한 자유 에너지는 양(+)의 값이다. 열역학적으로 불리한 반응, 바꾸어 말하면 에너지 요구 반응(자유 에너지의 증가 반응)을 수행하기 위하여 세포는 이 반응을 자유 에너지를 방출하는 다른 반응(자유 에너지의 감소 반응)과 짝지어 일어나게 함으로써, 전체 과정이 자유 에너지의 감소 반응으로 되고, 그 결과 자유 에너지 변화의 총합은 음(-)의 값이 된다. 이와 같이 자유 에너지의 감소 반응과 자유 에너지의 증가 반응이 짝지어지는 것은 생물의 반응계에서 에너지 교환에 절대적으로 중요하다.
반응 속도
반응 속도에 대한 정확한 열역학적 정의
특정한 화학 반응의 속도는 기질의 농도와 속도상수(일반적으로 k로 표시함)에 의하여 결정된다. 기질(S)로부터 생성물(P)로의 단일분자의 반응에서, 반응 속도(V)는 단위 시간당 반응하는 기질의 양을 의미하고 다음의 식으로 표시된다(V=k[S]).
이 반응에서 반응 속도는 단지 기질의 농도에 의해서만 변한다는 것을 알 수 있다. 이와 같은 반응을 1차 반응이라 한다. 속도상수 k는 주어진 조건(PH, 온도 등)에서 반응의 확률을 나타내는 비례 상수이다. 여기에서 k는 1차 속도 상수가 되고 그 단위는 시간의 역수(s-1)가 된다.
2차 반응이란 반응 속도가 서로 다른 2가지 화합물의 농도에 의해 결정되거나, 같은 화합물이라도 2개의 분자가 반응에 참여할 때를 의미한다. 이 때 k는 2차 속도 상수가 된다. 이 반응 속도식은 다음과 같이 나타낼 수 있다(V=k[S1][S2]).
여기에 전이 상태 이론을 적용하면, 속도상수와 활성화 에너지가 관련되는 식이 유도된다.
k = kT/h
이 식에서 중요한 것은 속도상수 k와 활성화 에너지 ΔG는 지수 함수적인 반비례의 관계에 있다는 것이다. 식에 따라 활성화 에너지가 낮으면 반응 속도는 증가하고, 활성화 에너지가 높으면 반응 속도는 감소하는 것을 알 수 있다.
효소의 활성화 에너지의 변화와 반응 속도의 관계
화학 반응에서 반응의 시작점을 바닥 상태라고 부르는데, 이것은 주어진 조건에서 계에 의하여 주어지는 자유 에너지이다. 기질의 바닥 상태에서 자유 에너지와 생성물의 바닥 상태에서 자유 에너지의 차이가 둘 사이의 평형을 결정한다.
기질과 생성물의 사이에는 에너지 장벽이 존재한다. 반응이 진행되기 위해서는 분자를 이 에너지 장벽보다 높은 에너지 상태까지 높여주어야 한다. 에너지가 제일 높은 지점에 분자가 위치한 것을 전이 상태라고 한다. 전이 상태는 결합의 파괴와 형성 그리고 전하의 변화라고 하는 것이, 기질에도 생성물에도 균등하게 진행될 수 있는 어떤 시점에 도달한 순간을 가리킨다.
바닥 상태와 전이 상태의 에너지의 차를 활성화 에너지(ΔG)라고 부른다. 반응 속도는 이 활성화 에너지에 의하여 좌우된다.
온도를 높여 주게 되면 반응 속도는 증가하는데, 이러한 상태는 에너지의 장벽을 넘어가는데 충분한 에너지를 가지고 있는 분자의 수가 많아지기 때문이다. 또한 활성화 에너지는 촉매를 가해 줌으로써 낮출 수 있다. 촉매는 반응의 활성화 에너지를 낮추어 줌으로써 반응 속도를 증가시킨다. 효소는 촉매의 일종인 생체촉매로서 반응 속도를 증가시킨다.
활성화 에너지는 세포가 계속해서 살아가는데 있어서 대단히 중요하다. 분자는 활성화 에너지가 높을수록 안정하며, 만일 이러한 에너지의 장벽이 없다면 복잡한 구조를 가지고 있는 생체 거대분자는 좀 더 단순한 분자의 형태로 자발적으로 변화되어 버릴 것이다. 또한 세포가 가지고 있는 복잡하면서도 고도의 질서를 유지하고 있는 구조나 대사 경로는 존재 할 수 없게 된다. 세포는 효소를 이용하여 살아가는데 필요한 반응에 대해 선택적으로 활성화 에너지를 낮출 수 있도록 진화되어 온 것이다.
결합 에너지
결합 에너지와 그 작용기작
효소가 특이적 반응에서 오는 활성화 에너지를 극도로 낮출 수 있는 이유는 결합 에너지에 있다. 활성화 에너지를 낮추는데 필요한 대부분의 에너지는 일반적으로 기질과 효소 사이의 약한 결합인 비공유결합들로부터 얻어진다.
효소는 특이적인 효소-기질 복합체(ES 복합체)를 형성한다는 점에서 많은 다른 촉매들과 구별된다. 이 효소-기질 복합체에서 기질과 효소의 결합 방식은 단백질 분자의 구조를 안정화시키는 요인인 수소 결합, 소수성 결합, 이온 결합 등에 의존한다. 이들 결합들은 효소-기질 복합체 내부에 약한 결합들을 형성함으로써 이러한 상호작용을 안정화시킬 정도의 적은 자유 에너지가 방출된다. 이와 같은 효소-기질 상호작용에 의하여 얻어진 에너지를 결합 에너지라고 부른다. 이 결합 에너지의 의미는 단지 효소-기질간의 상호작용의 안정화에만 국한되지 않는다. 결합 에너지는 효소가 반응의 활성화 에너지를 낮추는 데 사용되는 자유 에너지의 중요한 공급원이다.

효소가 반응을 촉매하기 위해서는 반응의 전이 상태에서 기질과 상보적이 되어야만 한다. 다시 말하면 기질과 효소 간의 최적의 관계(약한 상호작용)는 전이 상태에서만 생길 수 있다. 일부의 약한 상호작용이 효소-기질 복합체에서 형성되며, 기질과 효소간의 약한 상호작용에 의한 완전히 상보적인 결합은 반응이 전이 상태가 되어서야 비로소 형성되는 것이다.
이 결합을 형성할 때에 방출되는 결합 에너지의 일부가 에너지 장벽을 뛰어넘는 데에 필요한 에너지의 일부로서 사용된다. 반응이 일어나기 어렵게 하는 활성화 에너지와 반응이 일어나기 쉽게 하는 결합 에너지의 차이가 알짜 활성화 에너지가 된다. 전이 상태는 기질이 에너지 장벽의 꼭대기에 있는 대단히 짧은 시간인데, 효소가 촉매하는 반응의 경우에 에너지 장벽의 높이가 아주 낮기 때문에 효소 반응은 비효소 반응보다 반응 속도가 훨씬 빠른 것이다.
여기서 가장 중요한 효소 반응의 원리는 효소와 기질 간의 약한 결합이 효소 촉매 반응의 주요한 에너지원이 된다는 것이다. 이와 같은 반응에서 효소와 약한 상호작용에 관여하고 있는 기질의 부분은 절단 부위나 변화를 받는 부위와 다른 곳에 있다. 따라서 전이 상태에서 처음으로 형성되는 약한 상호작용이 촉매 반응의 진행에 가장 중요한 역할을 하게 된다.
결합 에너지의 효소 반응 메커니즘에 대한 역할 정리
- 결합 에너지는 촉매 반응에 필요한 에너지를 공급할 뿐 아니라 반응의 특이성을 확보하는 데에도 관련되어 있다. 기질 특이성이란 효소와 반응하고자 경쟁하는 두 가지의 유사한 기질을 식별할 수 있는 효소의 능력을 말한다. 즉, 이러한 기질 특이성은 효소와 그 기질 분자 간에 많은 부분 혹은 기질이 되는 거의 모든 부분의 구조적인 면에서 다수의 약한 결합이 형성되어 만들어지는 것이다.
- 기질이 효소에 결합함으로써 엔트로피가 감소한다. 결합 에너지는 기질이 반응하는데 필요한 적절한 배치를 유지하도록 해준다.
- 기질과 효소 사이에 약한 결합이 형성됨으로써 기질은 탈용매화된다.
- 전이 상태에서 형성되는 약한 상호작용에 의한 결합 에너지는 전자의 재배치에 의한 뒤틀림을 이용하여 기질이 반응하는 것을 열역학적으로 보상한다.
- 기질과 효소 사이에 부분적으로 여러 개의 약한 상호작용이 새로이 형성되면서 효소의 입체 형태의 변화가 유도된다.
효소 반응속도론
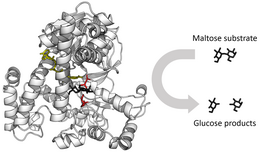
효소 반응속도론은 효소가 기질과 어떻게 결합하고 기질을 생성물로 전환시키는지에 대한 연구이다. 효소 반응 속도론에 사용되는 속도 데이터는 일반적으로 효소 분석법에서 얻는다. 1913년에 레오노르 미하엘리스와 모드 레오노라 멘텐은 미하엘리스-멘텐 속도론이라 불리는 효소 반응 속도론의 정량적인 이론을 제안했다. 미하엘리스와 멘텐의 주요 공헌은 효소 반응이 두 단계로 나뉘어 일어난다고 생각한 것이었다. 첫째, 기질은 효소와 가역적으로 결합하여 효소-기질 복합체를 형성한다. 효소-기질 복합체는 미하엘리스와 멘텐의 업적을 기리기 위해 때때로 미하엘리스-멘텐 복합체로도 불린다. 둘째, 효소는 반응에서 화학 반응을 촉매한 다음, 생성물을 방출한다. 효소 반응 속도론에 대한 연구는 조지 에드워드 브릭스와 존 버든 샌더슨 홀데인에 의해 더욱 더 발전되었으며, 이들은 오늘날에도 여전히 널리 사용되고 있는 효소 반응 속도식을 도출해 냈다.
효소가 촉매하는 반응 속도는 용액의 조건과 기질의 농도에 달려있다. 효소 반응의 최대 속도를 찾기 위해 생성물이 일정한 속도로 생성될 때까지 기질의 농도를 증가시킨다. 이것은 오른쪽의 포화 곡선에 나타나 있다. 포화는 기질의 농도가 증가함에 따라 유리 효소가 보다 더 많이 효소-기질 복합체로 전환되기 때문에 일어난다. 효소의 최대 반응 속도(Vmax)에서 모든 효소의 활성 부위는 기질과 결합하고, 효소-기질 복합체의 총 개수는 효소의 총 개수와 같다.
Vmax는 몇 가지 효소 반응 속도론의 중요한 매개 변수 중 하나이다. 주어진 반응 속도를 달성하기 위해 필요한 기질의 양도 또한 중요하다. 이는 효소가 최대 반응 속도의 1/2에 도달하기 위해 필요한 기질의 농도인 미하엘리스-멘텐 상수(Km)에 의해 주어진다. 일반적으로, 각각의 효소는 주어진 기질에 대한 고유한 Km을 가지고 있다. 또 다른 유용한 상수는 전환수(turnover number)라고도 하는 kcat이며, kcat은 효소가 기질로 포화되었을 때 단위 시간당 1개의 효소 분자에 의해 생성물로 바뀌는 기질 분자의 수를 의미한다.
효소의 효율은 kcat/Km으로 나타낼 수 있다. kcat/Km은 특이성 상수라고도 하며, kcat/Km은 E+S가 E+P로 전환하는 속도 상수로 첫 번째 비가역적인 단계를 포함한 반응의 모든 단계에 대한 속도 상수를 포함한다. 특이성 상수는 친화도 및 촉매 능력을 모두 반영하기 때문에 서로 다른 효소들을 비교하거나 서로 다른 기질을 사용하는 동일한 효소를 서로 비교하는데 유용하다. 특이성 상수에 대한 이론적 최대값을 확산 한계(diffusion limit)라고 하며, 약 108~109 M−1 s−1이다. 이때 효소는 기질과 충돌할 때마다 촉매 작용이 일어나며, 생성물의 형성 속도는 반응 속도에 의해서가 아니라 확산 속도에 의해 제한된다. 이러한 특성을 가지고 있는 효소는 촉매적으로 완벽하거나 반응속도론적으로 완벽(확산 지배 효소)하다고 불린다. 확산 지배 효소의 예로는 삼탄당 인산 이성질화효소, 탄산무수화효소, 아세틸콜린에스터레이스, 카탈레이스, 푸마레이스, β-락타메이스, 초과산화물 불균등화효소 등이 있다. 이러한 효소들의 전환율은 초당 수백만 회의 반응에 이를 수 있다. 그러나 대부분의 효소들은 촉매적으로 완벽한 상태와는 거리가 멀다. 일반적인 효소들의 



미하엘리스-멘텐 반응 속도론은 자유 확산 및 열역학적으로 유도되는 무작위적 충돌의 가정으로부터 도출된 질량작용의 법칙에 달려있다. 많은 생화학적 또는 세포적 과정들은 고분자 군집 및 제한된 분자 운동으로 인해 이러한 조건들에서 크게 벗어난다. 보다 최근의, 복잡한 모델의 확장은 이러한 효과들의 수정을 시도하고 있다.
저해
효소 반응 속도는 다양한 유형의 효소 저해제에 의해 감소될 수 있다.
저해의 유형
가역적 저해
가역적 저해제 (reversible inhibitor)는 오직 효소와 일시적인 결합체만을 형성한다. 용어 자체가 암시하듯이 가역적 저해제는 효소와 저해제간의 평형이 성립되고 효소에 대한 저해제의 친화력은 평형 또는 해리상수로 표시된다. 최근에는 3가지 유형의 가역적 저해제가 알려져 있는데 경쟁적 저해제, 비경쟁적 저해제, 무경쟁적 저해제가 그 예이다.
경쟁적 저해
경쟁적 저해제 (competitive inhibitor)는 구조가 기질과 유사해서 기질과 경쟁적으로 효소의 활성 부위에 결합한다. 경쟁적 저해제가 효소의 활성 부위에 결합하면 기질이 효소에 결합하지 못하므로 반응이 저해되어 반응 속도가 감소한다. 예를 들어, 메토트렉세이트라는 약물은 다이하이드로폴산을 테트라하이드로폴산으로의 환원을 촉매하는 효소인 다이하이드로폴산 환원효소의 경쟁적 저해제이다. 다이하이드로폴산과 메토트렉세이트의 구조적 유사성은 오른쪽 그림에 표시되어 있다. 기질의 농도가 증가하면 경쟁적 저해제의 저해 효과가 감소한다. 다른 경우에, 저해제는 통상적인 기질의 결합 부위가 아닌 다른 부위에 결합해서 다른 자리 입체성 조절 효과를 발휘하여 통상적인 결합 부위의 형태를 변화시킬 수 있다.
무경쟁적 저해
무경쟁적 저해제 (non-competitive inhibitor) 또는 비경쟁적 저해제는 효소의 활성 부위가 아닌 다른 부위에 결합한다. 비경쟁적 저해제가 효소에 결합하면 효소의 활성 부위의 입체 구조가 변해 기질이 효소에 결합하지 못하므로 반응이 저해되어 반응 속도가 감소한다. 기질은 여전히 평소의 친화력으로 효소와 결합하므로 Km은 동일하게 유지된다. 그러나 비경쟁적 저해제는 효소의 촉매 효율을 감소시키기 때문에 Vmax는 감소한다. 경쟁적 저해제와는 달리, 비경쟁적 저해제는 기질의 농도가 증가해도 저해 효과가 감소하지 않는다.
반경쟁적 저해
반경쟁적 저해제 (uncompetitive inhibitor) 또는 불경쟁적 저해제 또는 비경쟁적 저해제 또는 무경쟁적 저해제는 유리 효소에 결합할 수 없고, 효소 기질 복합체에만 결합할 수 있다. 따라서 무경쟁적 저해제는 기질의 농도가 높을 때 가장 효과적이다. 무경쟁적 저해제의 존재 하에서 효소-기질 복합체는 활성화되지 않는다. 무경쟁적 저해는 매우 드문 효소 저해 유형이다.
혼합 저해
혼합 저해제 (mixed inhibitor)는 다른 자리 입체성 부위에 결합하고, 효소 또는 효소-기질 복합체와 결합할 수 있다. 혼합적 저해제가 효소와 결합하고 있으면 효소의 기능이 떨어지지만, 효소의 기능이 없어지지는 않는다. 혼합적 저해제는 미하엘리스-멘텐 식을 따르지 않는다.
비가역적 저해
비가역적 저해제 (irreversible inhibitor)는 대개 단백질과 공유 결합을 형성하여 효소를 영구적으로 불활성화시킨다. 페니실린과 아스피린은 이러한 방식으로 작용하는 흔한 약물들이다.
저해제의 기능
많은 생물에서 저해제는 피드백 메커니즘의 일부로 작용할 수 있다. 효소가 생물에서 특정 물질을 너무 많이 생성시키면, 그 물질은 물질을 생성하는 대사 경로의 시작 단계를 촉매하는 효소의 저해제로 작용하여 특정 물질의 양이 충분할 경우에 그 물질의 생성을 늦추거나 중단시킬 수 있다. 이것은 음성 피드백의 한 형태이다. 시트르산 회로와 같은 주요 대사 경로들은 이러한 메커니즘을 사용한다.
저해제는 효소의 기능을 조절할 수 있기 때문에 종종 약물로 사용된다. 그러한 많은 약물들은 메토트렉세이트와 같이 효소의 고유 기질과 비슷한 구조를 가지고 있는 가역적인 경쟁적 저해제이다. 경쟁적 저해제의 또 다른 잘 알려진 예로는 콜레스테롤의 수치가 높은 환자들의 치료에 사용되는 스타틴 및 HIV와 같은 레트로바이러스에 감염된 환자들의 치료에 사용되는 프로테이스 저해제 등이 있다. 약물로 사용되는 비가역적 저해제의 예로는 염증 반응을 조절하는 프로스타글란딘을 생성하는 효소인 사이클로옥시제네이스-1(COX-1)과 사이클로옥시제네이스-2(COX-2)를 저해하는 아스피린이 있다. 다른 효소 저해제들 중에는 독으로 작용하는 것도 있다. 예를 들어, 사이안화물 독은 사이토크롬 c 산화효소의 활성 부위에 있는 구리 및 철과 결합하여 세포 호흡을 차단하는 비가역적 효소 저해제이다.
생물학적 기능
효소는 살아있는 생물체 내에서 다양한 기능을 한다. 효소는 신호 전달과 세포 조절에 필수적이며 종종 키네이스 및 포스파테이스를 통해 관여한다. 또한 효소는 근수축을 위해 ATP를 가수분해한 에너지를 이용하여 마이오신의 움직임을 발생시키며, 세포 골격의 일부로서 세포 주위로 물질을 운반한다. 세포막에 있는 다른 ATPase는 능동수송에 관여하는 이온 펌프이다. 또한 효소는 반딧불이의 빛을 생성하는 루시퍼레이스와 같은 보다 색다른 기능에도 관여한다. 바이러스는 또한 HIV 인테그레이스 및 역전사효소와 같이 세포를 감염시키기 위해 필요한 효소나 인플루엔자 바이러스의 뉴라미니데이스와 같이 세포로부터 바이러스를 방출시키는데 필요한 효소를 함유할 수 있다.
효소의 중요한 기능 중 하나는 동물의 소화계에서 소화 효소로 작용하는 것이다. 아밀레이스나 프로테이스와 같은 효소는 큰 분자(녹말이나 단백질)를 작은 분자로 분해하여 소장에서 흡수될 수 있도록 돕는다. 예를 들어, 녹말 분자는 너무 커서 소장에서 흡수되지 않지만, 효소는 녹말 사슬을 엿당과 같이 더 작은 분자로 가수분해한 다음 결국 포도당으로 가수분해하여 흡수할 수 있도록 한다. 반추동물은 장에 공생하는 미생물이 분비하는 셀룰레이스 덕분에 식물 세포벽의 성분인 셀룰로스를 분해할 수 있다.
물질대사

여러 효소들이 특정 순서로 함께 작용해서 대사 경로를 형성한다. 대사 경로에서 어떤 효소는 다른 효소의 생성물을 기질로 사용한다. 촉매 반응 후에 생성물은 다른 효소로 옮겨진다. 때로는 한 가지 이상의 효소가 동일한 반응을 동시에 촉매할 수 있는데, 이는 보다 복잡한 조절을 가능하게 한다. 예를 들어, 하나의 효소에 의해서는 일정한 수준의 낮은 활성을 가지지만, 두 번째 효소로부터 높은 활성이 유도될 수 있다.
효소는 대사 경로에서 어떤 단계를 일어나게 할지를 결정한다. 효소가 없다면 물질대사는 일어나지 않을 것이고, 세포의 필요를 충족시키기 위해 대사를 조절할 수도 없을 것이다. 대부분의 중심 대사 경로들은 주로 ATP의 가수분해 활성을 가지고 있는 효소들을 통해 몇 가지 핵심적인 단계에서 조절된다. ATP의 가수분해 반응은 많은 에너지를 방출하기 때문에 열역학적으로 불리한 반응을 ATP 가수분해와 짝지어서 일련의 연결된 대사 반응들을 일으킬 수 있다.
효소 활성의 통제
세포 내에서 효소의 활성을 통제하는 5가지 주요 방식이 있다.
조절
효소는 다른 분자들에 의해서 활성화되거나 저해될 수 있다. 예를 들어, 대사 경로의 최종 생성물은 종종 대사 경로의 첫 번째 효소(일반적으로 첫 번째 비가역적 단계 또는 개입 단계라고 함)에 대한 저해제이며, 따라서 대사 경로에 의해 만들어지는 최종 생성물의 양을 조절한다. 이러한 조절 메커니즘은 생성된 최종 생성물의 양이 최종 생성물의 농도에 의해 조절되기 때문에 음성 피드백 조절 메커니즘이라고 불린다. 음성 피드백 조절 메커니즘은 세포의 요구에 따른 대사 중간생성물의 합성 속도를 효과적으로 조절할 수 있다. 이러한 음성 피드백 조절은 물질 및 에너지의 효과적인 배분에 도움을 주며, 최종 생성물의 과도한 생성을 방지한다. 다른 항상성 조절 기작과 마찬가지로, 효소 작용의 조절은 살아있는 생물체에서 안정적인 내부 환경을 유지하는데 도움을 준다.
번역 후 변형
번역 후 변형의 예로는 인산화, 미리스토일화, 글리코실화 등이 있다. 예를 들어, 인슐린에 대한 반응에서 글리코젠 생성효소를 비롯한 여러 효소들의 인산화는 글리코젠의 합성 또는 분해를 조절하고, 세포가 혈당의 변화에 반응하도록 한다. 번역 후 변형의 또 다른 예는 폴리펩타이드 사슬의 절단이다. 프로테이스인 키모트립신은 이자에서 비활성형인 키모트립시노젠으로 생성되어 위로 운반된 다음 위에서 활성화된다. 이것은 장에서 분비되기 전에 효소가 이자나 다른 조직을 소화시키는 것을 막는다. 이러한 유형의 비활성 효소 전구체는 지모젠 또는 프로효소로 알려져 있다.
양
효소의 생성(효소 유전자의 전사 및 번역)은 세포 환경의 변화에 반응하여 세포에 의해 증가되거나 감소될 수 있다. 이러한 형태의 유전자 발현의 조절을 효소 유도라고 한다. 예를 들어, 세균은 페니실린과 같은 항생제에 내성을 가질 수 있는데, 이는 페니실린 분자 내에서 중요한 베타-락탐 고리를 가수분해하는 베타-락타메이스라고 불리는 효소가 유도되기 때문이다. 또 다른 예로는 간에 존재하는 사이토크롬 P450 산화효소가 있는데, 사이토크롬 P450 산화효소는 약물 대사에서 중요하다. 이러한 효소의 유도 또는 저해는 약물 상호작용을 일으킬 수 있다. 또한 효소의 양은 효소의 분해 속도를 변화시킴으로써 조절할 수 있다. 효소 유도의 반대는 효소 억제이다.
세포 내 분포
효소는 구획화될 수 있으며, 서로 다른 세포 내 구획에서 서로 다른 대사 경로가 일어날 수 있다. 예를 들어, 지방산은 세포질, 소포체, 골지체의 효소들에 의해 합성되고, 미토콘드리아의 효소들에 의해 베타 산화되어 에너지원으로 사용된다. 또한, 상이한 구획에 효소가 집중되는 것은 효소의 활성에 영향을 미치는 양성자화(예: 중성의 세포질 및 산성의 리소좀) 또는 산화 상태(예: 산화된 주변세포질 또는 환원된 세포질)의 정도를 변화시킬 수 있다. 효소가 막에 결합된 세포소기관으로 구획화되는 것과는 달리, 효소의 세포 내 구획화는 효소의 중합을 통한 세포질의 거대분자 필라멘트로 변화될 수 있다.
기관의 전문화
다세포 진핵생물에서 여러 기관과 조직의 세포들은 유전자 발현의 패턴이 다르므로 대사 반응에 사용할 수 있는 효소들(동질효소로 알려짐)의 세트가 다르다. 이것은 생물체의 전체적인 물질대사를 조절하는 기작을 제공한다. 예를 들어, 해당과정의 첫 번째 단계를 촉매하는 효소인 헥소키네이스는 간과 이자에서 발현되는 글루코키네이스라고 불리는 특수한 형태를 가지는데, 글루코키네이스는 글루코스에 대한 친화도는 낮지만 글루코스 농도 변화에 보다 민감하게 반응한다. 글루코키네이스는 혈당량을 감지하고 인슐린의 생성을 조절하는데 관여한다.
질병 관련
효소 활성의 엄격한 조절은 항상성에 필수적이기 때문에, 핵심적인 효소의 이상(돌연변이, 과잉생산, 과소생산 또는 결실)은 유전 질환을 일으킬 수 있다. 인체에 존재하는 수천 가지의 효소들 중 한 개의 효소에 이상이 생겨도 치명적일 수 있다. 효소의 결핍으로 인한 치명적인 유전 질환의 예로는 헥소사미니데이스의 결핍으로 유발되는 테이-삭스병이 있다.
페닐케톤뇨증은 효소 결핍으로 인한 질환의 가장 대표적인 예이다. 페닐알라닌의 분해의 첫 번째 단계를 촉매하는 효소인 페닐알라닌 하이드록실화효소의 단일 아미노산 돌연변이는 페닐알라닌 및 관련된 물질의 축적을 일으킨다. 일부 돌연변이는 효소의 활성 부위에서 일어나서 기질과의 직접적인 결합과 촉매 작용을 방해하지만, 많은 돌연변이들은 효소의 활성 부위에서 먼 곳에서 일어나며 단백질의 구조를 불안정하게 만들거나 정확한 올리고머화에 영향을 미쳐서 효소의 활성을 감소시킨다. 이러한 질환을 적절하게 치료하지 못하면 지적 장애를 유발할 수도 있다. 또 다른 예로는 체내의 콜린 에스터 약물을 분해하는 능력이 저하되는 슈도콜린에스터레이스 결핍증이 있다. 효소의 경구 투여는 외분비 이자기능부전 및 젖당불내증과 같은 일부 기능적 효소 결핍증을 치료할 수 있다.
효소의 이상이 질병을 일으킬 수 있는 또 다른 방법은 DNA 복구 효소들을 암호화하는 유전자에서 생식세포 돌연변이가 일어나는 것이다. 이러한 효소들의 결함은 세포가 게놈에서 일어나는 돌연변이들을 제대로 복구할 수 없기 때문에 돌연변이가 천천히 축적되어 암을 발생시킬 수도 있다. 이러한 유전성 암의 예로는 자외선에 대한 최소한의 노출에도 반응하여 피부암을 유발할 수 있는 색소성 건피증이 있다.
산업적 이용
효소는 매우 특정한 촉매가 필요할 때 화학공업 및 기타 산업 분야에서 사용된다. 효소는 일반적으로 유기 용매 및 고온에서 안정성이 떨어지기 때문에 산업적으로 이용할 수 있는 반응의 수는 제한된다. 결과적으로 단백질공학은 연구가 활발한 영역이며, 합리적인 설계 또는 시험관 내에서의 진화를 통해 새로운 특성을 갖는 새로운 효소를 만들려는 시도를 포함한다. 이러한 노력들은 성공하기 시작했고, 몇몇 효소들은 이제 자연에서 일어나지 않는 반응들을 촉매하기 위해 처음부터 설계되었다.
| 적용 | 사용된 효소 | 용도 |
|---|---|---|
| 바이오 연료 산업 | 셀룰레이스 | 셀룰로스 에탄올을 생산하기 위해 셀룰로스를 발효될 수 있는 당으로 분해한다. |
| 리그니네이스 | 바이오 연료의 생산을 위한 바이오매스의 전처리 | |
| 세탁 세제 | 프로테이스, 아밀레이스, 라이페이스 | 세탁물 및 식기류에서 단백질, 녹말, 지방 또는 오일의 얼룩을 제거한다. |
| β-만노시데이스 | 일반 식품첨가물인 구아검에서 식품 얼룩을 제거한다. | |
| 양조 산업 | 아밀레이스, 글루카네이스, 프로테이스 | 맥아에서 다당류와 단백질을 분해한다. |
| β-글루카네이스 | 맥아즙과 맥주의 여과 특성을 향상시킨다. | |
| 아밀레이스, 플루라네이스 | 저칼로리 맥주를 만들고 발효를 조절한다. | |
| 아세토락트산 탈카복실화효소 | 다이아세틸의 생성을 줄임으로써 발효의 효율을 증가시킨다. | |
| 조리에 사용 | 파파인 | 요리를 위해 고기를 부드럽게 만든다. |
| 낙농 산업 | 키모신 (레닌) | 치즈의 제조 과정에서 단백질을 가수분해한다. |
| 라이페이스 | 로크포르와 같은 카망베르 치즈 및 블루 치즈를 생산한다. | |
| 식품 가공 | 아밀레이스 | 고과당 옥수수 시럽을 만드는 것과 같이 녹말로부터 당을 만드는데 사용한다. |
| 프로테이스 | 비스킷 제조에서 밀가루의 단백질 수치를 낮춘다. | |
| 트립신 | 저자극성 이유식을 제조하는데 사용한다. | |
| 셀룰레이스, 펙티네이스 | 과일 주스를 투명해지게 하는데 사용한다. | |
| 분자생물학 | 뉴클레이스, DNA 연결효소 및 중합효소 | 재조합 DNA를 만들기 위해 제한효소와 중합효소 연쇄 반응을 이용한다. |
| 제지 산업 | 자일라네이스, 헤미셀룰레이스, 리그닌 과산화효소 | 크라프트 펄프에서 리그닌을 제거한다. |
| 퍼스널 케어 | 프로테이스 | 콘택트 렌즈의 단백질을 제거하여 감염을 예방한다. |
| 녹말 산업 | 아밀레이스 | 녹말을 포도당과 다양한 시럽으로 전환한다. |
같이 보기
각주
This article uses material from the Wikipedia 한국어 article 효소, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). 별도로 명시하지 않은 경우, 내용은 CC BY-SA 4.0에 따라 사용할 수 있습니다. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki 한국어 (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.