Vogelgrippe H7N9: Influenzavirus
Vogelgrippe H7N9 ist die eine Viruserkrankung der Vögel und eine Form der Geflügelpest, hervorgerufen durch das Influenza-A-Virus H7N9 (auch A/H7N9), das heißt durch einen Subtyp des Influenzavirus, der insbesondere bei Hühnervögeln vorkommt.
Eine niedrigpathogene, reassortierte Variante des Virus führte – vermutlich erstmals im Februar 2013 – in der Volksrepublik China zu Infektionen beim Menschen; seit 2017 sind aus China auch hochpathogene Varianten bekannt. In Einzelfällen sind die Viren in den vergangenen Jahren auch auf Säugetiere und auf Menschen übertragen worden, die Erkrankung ist also eine Zoonose.
| Influenza-A-Virus H7N9 | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
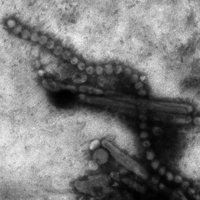 Transmissionselektronenmikroskopische Aufnahme von | ||||||||||||||||||||||
| Systematik | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||||||||
| Influenza A virus A/H7N9 | ||||||||||||||||||||||
| Kurzbezeichnung | ||||||||||||||||||||||
| FLUAV/(H7N9) | ||||||||||||||||||||||
| Links | ||||||||||||||||||||||
|
Beschreibung des Virus
Das Influenza-A-Virus H7N9 galt bei Hühnervögeln zunächst als ungefährlich (LPAI), da es bei diesen keine Krankheitssymptome verursachte. Durch diese apathogene Eigenschaft bei Hühnervögeln konnte es sich unbemerkt in diesen Populationen ausbreiten. Im Januar 2017 wurden jedoch erstmals genetische Veränderungen nachgewiesen (bei drei erkrankten Erwachsenen in China), die von der Weltgesundheitsorganisation als hoch pathogen (HPAI) klassifiziert wurden, ohne dass hieraus jedoch ein erhöhtes Risiko für eine Mensch-zu-Mensch-Übertragung abgeleitet wurde.
Das Friedrich-Loeffler-Institut erläuterte am 8. April 2013 auf seiner Website: „Genetische Untersuchungen deuten darauf hin, dass es sich um eine bisher nicht bekannte Variante handelt, die aus einem aviären Reservoir stammt und Gensegmente dreier unterschiedlicher aviärer ‚Elternviren‘ trägt. Von den 8 Gensegmenten stammen 6 offenbar vom Subtyp H9N2, die für H7 und N9 kodierenden Gensegmente von unterschiedlichen anderen Vogelviren.“ Die als PB2, PB1 und PA bezeichneten Merkmale weisen die größte Nähe zu der 2012 bei Bergfinken isolierten Virusvariante A/brambling/Beijing/16/2012(H9N2) auf. Bis zum Beginn des Infektionsgeschehens an der chinesischen Ostküste waren nur 25 Datensätze zu A/H7N9 in der GenBank hinterlegt. Die Pathogenität von A/H7N9 für den Menschen wird insbesondere durch eine Punktmutation bewirkt, die im Jahr 2000 im Subtyp A/H9N2 entstand und von diesem übernommen wurde.
Eine genetische Studie an Viren von vier schwer kranken Patienten aus Zhejiang sowie Geflügel lokaler Frischfleischmärkte stellte im Juni 2013 fast identische H7 bzw. N9 kodierende Gensegmente bei von einem Huhn und einem Patienten isolierten Viren fest. Das für H7 kodierende Gensegment war nahezu identisch mit A/H7N3-Viren aus Hausenten, die man 2011 in Zhejiang untersucht hatte; das für N9 kodierende Gensegment stand A/H7N9-Viren nahe, die man in Südkorea aus Vögeln isoliert hatte. Eine als PB2 Asp701Asn bezeichnete Mutation des für H7 kodierenden Gensegments wurde als Anpassung an den Patienten während der Erkrankung interpretiert. Im August 2013 wurde in einer weiteren Studie bestätigt, dass Gene aus H7-Viren, die in mindestens zwei Fällen von Enten auf Hühner übergegangen waren, sowie Gene eines H9N2-Virus im Wege der Reassortierung zur Bildung des H7N9-Virus beitrugen.
Aus einem Vergleich von H7N9-Virusproben mit Virusmaterial von einem H7N7-Ausbruch in den Niederlanden im Jahr 2003 und einer H7N1-Epidemie in Italien (1999–2000) wurde 2013 abgeleitet, dass die H7N9-Viren vor ihrer erstmaligen Entdeckung sich bereits weiträumig verbreitet hatten, da sie eine Vielzahl an genetischen Veränderungen gegenüber den älteren H7-Varianten aufweisen. 2015 wurde dann nachgewiesen, dass sich innerhalb Chinas bereits mehrere Virus-Linien mit Reassortierungs-Varianten gebildet haben.
Krankheitsverlauf/Symptome beim Menschen
Die meisten mit A/H7N9 Infizierten entwickeln hohes Fieber, Husten, Kurzatmigkeit und eine unbehandelt rasch fortschreitende, schwere Lungenentzündung, weswegen häufig Intensivpflege geboten ist. Zu den auftretenden Komplikationen gehören das Acute Respiratory Distress Syndrome (ARDS), septischer Schock und Multiorganversagen. Besonders schwere Krankheitsverläufe wurden bei Schwangeren, bei alten Menschen und bei Erkrankten mit zusätzlich vorhandenen chronischen Erkrankungen beobachtet.
Verlauf des Ausbruchs in der Volksrepublik China seit 2013
Erste Infektionen beim Menschen
Erstmals wurden Menschen im Februar 2013 nach Kontakt mit Geflügel mit dem Virus A/H7N9 infiziert, und zwar zunächst zwei Männer in Shanghai. Weitere Fälle wurden Anfang März aus den benachbarten ostchinesischen Provinzen Anhui und Zhejiang sowie aus der Provinz Jiangsu bekannt. Ab Mitte April 2013 wurden auch andernorts in China Infektionen bekannt, zunächst im Norden in Peking und in der Provinz Henan in Zentralchina, Ende April dann auch aus den ostchinesischen Provinzen Fujian, Shandong und Jiangxi sowie aus Hunan im östlichen Landesinneren. Nachdem im Januar 2014 erste Erkrankungen aus dem südchinesischen Autonomen Gebiet Guangxi gemeldet wurden, wuchs im angrenzenden Vietnam die Sorge, die Epidemie könne aufgrund des grenzüberschreitenden Tierhandels auf das Nachbarland übergreifen.
Am 3. April 2013 wurden drei Todesfälle bestätigt, darunter ein Mann, der bereits am 4. März verstorben war. In Shanghai wurden Anfang April Tauben gefunden, die das Virus in sich trugen und kurz darauf auch Hühner. Vorbeugend wurden dort umgehend 98.000 Hühner, Enten, Gänse und Tauben getötet; ferner wurden bei den seit dem 10. März 2013 im Fluss Huangpu Jiang treibenden, rund 20.000 toten Schweinen Gewebeproben entnommen, in denen allerdings keine A/H7N9-Viren nachgewiesen werden konnten.
Am 6. April 2013 waren nach offiziellen Angaben 18 Menschen in Ostchina infiziert, sechs davon waren an den Folgen der Infektion verstorben; einen Monat später, am 7. Mai 2013, betrug die Zahl der registrierten Infizierten 130, von denen 31 verstorben waren; bis Ende Mai 2013 erhöhte sich die Zahl der Infizierten auf 132 Personen, von denen 37 verstorben waren. Danach wurden bis Mitte August 2013 nur drei weitere Neuerkrankungen bekannt, was laut WHO-Sprecher Keiji Fukuda als Folge des wärmeren Witterung und der damit verbundenen schlechteren Übertragbarkeit von Viren interpretiert wurde.
Ab Oktober 2013 wurden aus mehreren Provinzen der VR China weitere Infizierte bekannt, Mitte Dezember 2013 betrug deren Anzahl 143 Personen, von denen 45 verstorben waren. Bis Mitte Juli 2015 stieg die Anzahl der registrierten Infizierten auf 677, von denen mindestens 275 verstorben waren. In den folgenden Sommermonaten wurden erneut nur wenige weitere Erkrankungen bekannt. Bis zum 9. Mai 2016 stieg die Zahl der registrierten Infizierten jedoch auf 770 an, von denen 306 verstorben waren.
Infektionsgeschehen ab 2017
Im Winterhalbjahr 2016/17 erhöhte sich die Anzahl der Infizierten besonders stark: Bis Mitte Februar 2017 wurden insgesamt 1223 Erkrankte registriert, von denen 380 verstorben waren; allein zwischen dem 17. Januar und dem 14. Februar hatte es in China 305 neue Erkrankungen gegeben, mindestens 79 Erkrankte starben im Januar 2017 an den Folgen der Infektion.
Im März 2017 wurde A/H7N9 erstmals in den USA nachgewiesen; im Rahmen von Routinekontrollen in einem Geflügelzuchtbetrieb in Tennessee wurde eine LPAI-Variante entdeckt, was zur Tötung von 16.500 Masthähnchen führte.
Am 15. Juni 2017 waren der WHO insgesamt 1533 bestätigte Infizierte bekannt, von denen mindestens 592 Personen verstorben waren, am 27. September 2017 berichtete die WHO über 1564 bestätigte Infizierte, von denen laut China National Health and Family Planning Commission 612 Personen verstorben waren. Bis zum 28. Mai 2018 erhöhte sich die der WHO bekannte Fallzahl geringfügig auf 1567, davon 615 Todesfälle, und bis zum 2. März 2022 auf 1568 Erkrankungen und 616 Todesfälle.
Übertragungswege
Die genauen Umstände, die zur Infektion mit dem Virus führen, gelten als ungeklärt; nicht alle Erkrankten hatten zuvor unmittelbaren Kontakt mit Geflügel. Als besonders leicht infizierbar erwiesen sich in Laborexperimenten Hühner und Wachteln. Ungeklärt ist weiterhin, wie viele Menschen das A/H7N9-Virus in sich tragen, ohne Krankheitssymptome zu zeigen.
Hinweise auf „anhaltende“ (sustained) Virus-Übertragungen von Mensch zu Mensch lagen der Weltgesundheitsorganisation laut ihren offiziellen Stellungnahmen nicht vor (Stand: 20. Februar 2017). Bekannt geworden war jedoch bereits am 17. April 2013 eine Familie mit mehreren Erkrankten; am gleichen Tag hatte ein WHO-Sprecher daher eingeräumt, möglicherweise sei es in „seltenen Ausnahmen“ (rare exceptions) doch zu einer solchen Infektionskette gekommen. Anfang August 2013 wurde dann der Fall einer 32-jährigen Frau aus Wuxi bekannt, die sich bereits im März „höchstwahrscheinlich“ („probable“) bei ihrem Vater angesteckt hatte; beide verstarben an Multiorganversagen. Bei 43 Personen, die Kontakt mit den beiden Erkrankten hatten, wurden keine Hinweise auf eine Infektion mit A/H7N9 gefunden. Zwei weitere Mensch-zu-Mensch-Übertragungen ereigneten sich vermutlich 2015 in einem chinesischen Krankenhaus, wo zwei Ärzte von einem Patienten angesteckt wurden.
In mehreren Tierexperimenten mit Frettchen, deren Immunsystem ähnlich wie das des Menschen auf Influenza-Viren reagiert, erwies sich das H7N9-Isolat A/Shanghai/2/2013 (SH2) als über die Luft von einem Tier zum anderen übertragbar; die Forscher leiteten daraus ab, dass „unter geeigneten Bedingungen“ auch eine Mensch-zu-Mensch-Übertragung möglich sei. Während eine dieser Studien ergab, dass Viren, die in ausgeatmeten Flüssigkeitströpfchen übertragen wurden, bislang nicht besonders effektiv in neue Wirtszellen eindringen können, ergab eine andere Studie, dass die so verbreiteten Viren sehr „leicht übertragbar“ („highly transmissible“) waren.
Andererseits gingen von den bei Vögeln viel häufiger auftretenden Grippeviren wie H4, H5, H6 oder H7 bisher keine Grippeepidemien bei Menschen aus; diese waren immer durch H1, H2 und H3 bedingt, die wiederum viel seltener bei Vögeln auftreten. Zudem ist die Übertragungsrate derzeit sehr niedrig, weil das H7N9-Virus bislang noch eine stark ausgeprägte Anpassung an aviäre Rezeptoren aufweist und die umlaufenden Virusvarianten – entgegen den In-vitro-Befunden – bislang zumeist nur in den oberen Atemwegen an Rezeptoren des Menschen binden, nicht aber in der Lunge. Auch sind die bisherigen nachvollziehbaren Grippeepidemien nicht auf eine direkte Virusübertragung von Geflügeltieren entstanden, sondern durch genetische Variationen der bekannten und beim Menschen vorbestehenden Virustypen.
Auf regionaler Ebene wurde 2020 für China berechnet, dass die Verbreitung von aviären Influenzaviren auch entlang der Handelswege von Geflügel erfolgt.
Wie alle anderen durch Influenza-Viren verursachten Geflügelkrankheiten ist in Deutschland die Vogelgrippe bei in Gefangenschaft gehaltenen Vögeln eine anzeigepflichtige Tierseuche und bei Wildvögeln eine meldepflichtige Tierkrankheit.
Risikolage
Die Pathogenität beim Menschen ist aufgrund fehlender Daten zum Kontagionsindex, also wie viele der infizierten Personen auch erkranken, noch unbekannt.
Die Weltgesundheitsorganisation (WHO) empfiehlt bislang (Stand: 20. Februar 2017) weder spezielle Einreisekontrollen noch Reisebeschränkungen, warnt Reisende aber vor dem Besuch von Geflügelhaltungen und Geflügelmärkten in China.
„Um eine Verbreitung der Epidemie ins Ausland zu verhindern“ wurde bereits Ende Januar 2014 von den chinesischen Gesundheitsbehörden angeordnet, dass an den chinesischen Flughäfen alle Ausreisenden „die grippenähnliche Symptome wie Fieber, Husten und Atemschwierigkeiten haben, genauer geprüft und bei Verdacht auf H7N9 rechtzeitig isoliert werden.“
Der erste Erkrankte außerhalb der Volksrepublik China wurde am 24. April 2013 aus Taiwan bekannt; der Mann hatte sich zuvor in Suzhou, VR China, aufgehalten. Daraufhin kündigten mehrere asiatische Staaten an, einreisende Personen auf Flughäfen zum Beispiel mit Hilfe von Wärmebildkameras auf fiebrige Erkrankungen zu überprüfen. Bei einer im Februar 2014 in Malaysia diagnostizierten Erkrankung handelte es sich um eine Reisende aus China, die bereits vor Antritt ihrer Reise gegen Fieber und Husten behandelt worden war.
Laut Thomas Mettenleiter, dem Präsidenten des Friedrich-Loeffler-Instituts, ist das Risiko einer Ausbreitung der H7N9-Viren über China hinaus vergleichbar mit dem bei der Vogelgrippe H5N1 im Jahr 2004. Allerdings scheint das Influenza-A-Virus H7N9 leichter von Geflügel auf den Menschen überzugehen als das Influenza-A-Virus H5N1; A/H7N9 wurde daher von WHO-Sprecher Keiji Fukuda am 24. April 2013 als eines der „most lethal influenza viruses we have seen so far“ bezeichnet, als „eines der tödlichsten Influenzaviren, das wir bisher gesehen haben“. Da das Virus bislang nicht unter Menschen zirkulierte, sei zu erwarten, dass Menschen aller Altersgruppen und weltweit für A/H7N9 anfällig seien. Experimente mit ex-vivo-Material aus menschlichem Luftröhren- und Lungen-Gewebe ergaben, dass die Viren insbesondere die Epithelzellen der unteren Atemwege sowie Typ-II-Pneumozyten befallen und dass die üblichen saisonalen Influenza-Impfstoffe keinen Schutz gegen die Viren bieten.
Das Ministerium für Ernährung, Ländlichen Raum und Verbraucherschutz Baden-Württemberg hat 2023 die bereits geltenden Biosicherheitsmaßnahmen für Geflügelhaltungen mit mehr als 1.000 Tieren auch für kleinere Haltungen landesweit angeordnet. Ziel ist der Schutz des Geflügels vor einer Ansteckung mit der Geflügelpest. In Baden-Württemberg gab es seit Anfang des Jahres elf Nachweise der Geflügelpest bei Wildvögeln. Deutschlandweit kam es seit September 2021 insgesamt zu mehr als 1900 Geflügelpestausbrüchen. Das Friedrich-Löffler-Institut (FLI) hat in seiner Risikobewertung das Eintragsrisiko ausgehend von Wildvögeln in die Geflügelhaltungen bundesweit als hoch eingestuft und empfiehlt Biosicherheitsmaßnahmen konsequent einzuhalten.
Arzneimittel-Entwicklung
Ein wirksamer und erprobter Influenzaimpfstoff gegen A/H7N9 ist bisher kommerziell nicht verfügbar (Stand: März 2017), jedoch werden bereits seit 2014 mehrere „candidate vaccines“ (potentiell wirksame Impfstoffe) in klinischen Studien erprobt. Bereits im April 2013 waren zwecks Impfstoffentwicklung Virus-Proben an Fachlaboratorien außerhalb Chinas abgegeben worden, um den RNA-Code zu charakterisieren, und am 2. Mai 2013 hatte die WHO auch die Bereitstellung von Virus-Proben für Impfstoff-Hersteller angekündigt. Ersten Befunden zufolge scheint A/H7N9 eine deutlich schwächere Immunreaktion hervorzurufen als die meisten anderen Influenza-Viren. Dies erhöhe zum einen das Risiko, dass sich die Viren auch ohne erkennbare Krankheitssymptome verbreiten; zum anderen benötige man im Vergleich mit anderen Influenza-Viren sehr viel mehr „Saatviren“ für die Produktion von Impfstoffen gegen A/H7N9.
Mitte April 2013 hatte die U.S. Food and Drug Administration (FDA) bekannt gegeben, dass die A/H7N9-Viren ein „erhebliches Potential für eine Gefährdung des Gesundheitswesens“ besitzen; die Behörde hatte daher im Rahmen einer „Notfall-Erlaubnis“ gestattet, dass Virus-Nachweisverfahren (Test-Kits) auch dann schon verwendet werden dürfen, wenn das übliche Genehmigungsverfahren durch die FDA noch nicht abgeschlossen ist.
Anfang August 2013 forderte eine Gruppe von Virologen um den niederländischen Forscher Ron Fouchier, das A/H7N9-Virus im Labor so zu verändern, dass es von Mensch zu Mensch übertragen werden könnte; so könne besser abgeschätzt werden, welche Mutationen zu einer Pandemie führen würden. Vergleichbare, unter Forschern und in der Öffentlichkeit umstrittene Experimente hatte es zuvor auch mit dem Influenza-A-Virus H5N1 gegeben. Die Forderung der Virologen stieß bei anderen Fachleuten teils auf Zustimmung, teils auf Ablehnung. Das U.S. Department of Health and Human Services kündigte an, eine Risikoabschätzung vorzunehmen.
Die antivirale Substanz Amantadin ist gegen A/H7N9 – wenn überhaupt – nur eingeschränkt wirksam, da sie in der Geflügelhaltung in China massiv eingesetzt wurde und sich daher resistente Influenza-Stämme gebildet haben; in einem Infektionsfall beim Menschen erwies sich zudem Tamiflu als unwirksam gegen A/H7N9.
Einer 2017 publizierten Studie zufolge erwiesen sich alle getesteten H7N9-Stämme anfällig für den Inhibitor einer viralen RNA-Polymerase namens „Favipiravir“ (auch: „T-705“), der daher als mögliche antivirale Option im Falle einer Infektion in Betracht gezogen werden könnte.
Literatur
- Jian Zhong Shi et al.: Isolation and characterization of H7N9 viruses from live poultry markets — Implication of the source of current H7N9 infection in humans. In: Chinese Science Bulletin. April 2013, doi:10.1007/s11434-013-5873-4
- Rongbao Gao et al.: Human Infection with a Novel Avian-Origin Influenza A (H7N9) Virus. In: New England Journal of Medicine. Band 368, 2013, S. 1888–1897, doi:10.1056/NEJMoa1304459
- Yu Chen et al.: Human infections with the emerging avian influenza A H7N9 virus from wet market poultry: clinical analysis and characterisation of viral genome. In: The Lancet. Band 381, Nr. 9881, 2013, S. 1916–1925, doi:10.1016/S0140-6736(13)60903-4
- Di Liu et al.: Origin and diversity of novel avian influenza A H7N9 viruses causing human infection: phylogenetic, structural, and coalescent analyses. In: The Lancet. Band 381, Nr. 9881, 2013, S. 1926–1932, doi:10.1016/S0140-6736(13)60938-1
- Benyun Shi et al.: Inferring the potential risks of H7N9 infection by spatiotemporally characterizing bird migration and poultry distribution in eastern China. In: Infectious Diseases of Poverty. Band 2, Nr. 8, 2013, doi:10.1186/2049-9957-2-8
- Hai-Nv Gao et al.: Clinical Findings in 111 Cases of Influenza A (H7N9) Virus Infection. In: New England Journal of Medicine. Band 368, 2013, S. 2277–2285, doi:10.1056/NEJMoa1305584
Siehe auch
Weblinks
Fachbehörden
- Das RKI zu humanen Erkrankungsfällen mit aviärer Influenza A(H7N9). Robert Koch-Institut, zuletzt abgerufen am 4. April 2022.
- Tierseuchengeschehen: Aviäre Influenza (AI) / Geflügelpest. Webseiten des Friedrich-Loeffler-Instituts.
- Avian influenza. Übersichtsseite des Europäischen Gesundheitsbehörde ECDC, zuletzt abgerufen am 4. April 2022.
- Global Influenza Programme. Übersichtsseite der Weltgesundheitsorganisation, zuletzt abgerufen am 4. April 2022.
- H7N9 situation update. Übersichtsseite der Ernährungs- und Landwirtschaftsorganisation der Vereinten Nationen (FAO).
- Ausgewählte Fragen und Antworten zur Hygiene bei Lebensmitteln und Bedarfsgegenständen in Zeiten der Vogelgrippe - Bundesinstitut für Risikobewertung (BfR). 16. März 2022
Hintergrundinformationen
- „H7N9 ist wie keine Vogelgrippe zuvor“. Ein Interview mit dem niederländischen Virologen Ron Fouchier auf zeit.de vom 19. April 2013.
- Virus H7N9: Vogelgrippe unter Beobachtung. In: Frankfurter Allgemeine Zeitung (Natur und Wissenschaft) vom 12. Dezember 2013.
- H7N9 is a virus worth worrying about. Auf: nature.com vom 24. April 2013.
- China bird flu may be two mutations from a pandemic. Auf: newscientist.com vom 10. April 2013.
- Influenza Risk Assessment Tool. Kriterienkatalog der US-Gesundheitsbehörde CDC zum Abschätzen des Pandemie-Risikos. Auf: cdc.gov, zuletzt abgerufen am 4. April 2022.
Belege
This article uses material from the Wikipedia Deutsch article Vogelgrippe H7N9, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Abrufstatistik · Autoren Der Inhalt ist verfügbar unter CC BY-SA 4.0, sofern nicht anders angegeben. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Deutsch (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.