Hóa Học Lai Hóa
Trong hóa học, lai hóa orbital là khái niệm về việc trộn lẫn các orbital nguyên tử thành những orbital lai hóa mới (với mức năng lượng, hình dạng,...
khác với các obitan nguyên tử thành phần) phù hợp để các electron hình thành liên kết hóa học trong thuyết liên kết hóa trị. Orbital lai hóa rất có ích trong việc giải thích hình học phân tử và tính chất liên kết nguyên tử. Tuy đôi lúc được dạy cùng với thuyết đẩy lùi cặp electron vỏ hóa trị (VSEPR), thực tế là liên kết cộng hóa trị và sự lai hóa không liên quan tới mô hình VSEPR. Các obitan tham gia lai hóa phải có năng lượng không khác nhau nhiều.
Lịch sử Hóa Học Lai Hóa
Nhà hóa học Linus Pauling lần đầu phát minh ra thuyết lai hóa vào năm 1931 để giải thích cấu trúc của những phân tử đơn giản như methan (CH4) bằng cách dùng obitan nguyên tử. Pauling chỉ ra rằng một nguyên tử cacbon hình thành bốn liên kết bằng cách dùng một obitan s và ba obitan p, do đó "có thể suy ra" rằng một nguyên tử cacbon sẽ hình thành ba liên kết tại góc vuông (sử dụng các obitan p) và một liên kết thứ tư yếu hơn bằng obitan s với hướng tùy ý. Tuy nhiên theo thực tế, methan có bốn liên kết với sức mạnh bằng nhau và với góc liên kết tứ diện 109.5°. Pauling giải thích bằng cách giả sử sự xuất hiện của bốn nguyên tử hydro, obitan s và p hình thành bốn tổ hợp tương đương hay là obitan lai hóa, mỗi tổ hợp được biểu thị là sp3 để thể hiện thành phần của nó, thứ nằm dọc theo bốn liên kết C-H. Khái niệm Hóa Học Lai Hóa này được phát triển cho hệ thống hóa học đơn giản nhưng sau này đã được áp dụng rộng rãi, ngày nay còn được coi là một phương pháp hiệu quả để giải thích hợp lý cấu trúc hợp chất hữu cơ. Nó cho ta một bức tranh đơn giản tương đương với cấu trúc Lewis. Thuyết lai hóa chủ yếu được sử dụng trong hóa hữu cơ, một trong những ví dụ thuyết phục nhất là quy tắc Baldwin.
Obitan nguyên tử Hóa Học Lai Hóa
Obitan là một mô hình đại diện cho chuyển động của các electron trong phân tử. Trong trường hợp lai hóa đơn giản, sự ước chừng này được dựa trên obitan nguyên tử, tương tự với những obitan của nguyên tử hydro, nguyên tử trung tính duy nhất mà phương trình Schrödinger có thể giải quyết chính xác. Với các nguyên tử nặng hơn như cacbon, nito và oxi, obitan nguyên tử được sử dụng là 2s và 2p, tương tự với trạng thái obitan bị kích thích của hydro.
Tổng quan Hóa Học Lai Hóa
Lai hóa Obitan được cho là sự trộn lẫn các obitan nguyên tử, xen phủ nhau theo nhiều tỉ lệ. Ví dụ, với methan, obitan lai hóa của C hình thành từ các liên kết carbon–hydro chứa 25% đặc tính s và 75% đặc tính p do vậy được mô tả là lai hóa sp3 (đọc như s-p-ba). Cơ học lượng tử mô tả sự lai hóa này như một hàm sóng sp3 với hình thức N(s + √3pσ), tại đó N là một hằng số chuẩn (tại đây là 1/2) và pσ là một obitan p định hướng dọc theo trục C-H để hình thành một liên kết sigma. Trong ví dụ này hệ số tỉ lệ (thường được biểu thị là λ) là √3. Từ khi mật độ electron liên kết với một obitan tỉ lệ với bình phương hàm sóng, tỉ lệ của đặc tính p với đặc tính s là λ2 = 3. Đặc tính p hoặc khối lượng của phần p là N2λ2 = 3/4.
Lượng đặc tính p hay đặc tính s, vốn được quyết định chủ yếu bởi sự lai hóa obitan, có thể dùng để dự đoán các đặc tính của phân tử như tính axit hay tính base.
Khái niệm Hóa Học Lai Hóa
Lai hóa là sự tổ hợp các obitan nguyên tử khác nhau để tạo ra các obitan nguyên tử hoàn toàn giống nhau về hình dạng, kích thước và năng lượng nhưng có hướng khác nhau.
Ví dụ: Trong phân tử CH4, khi nguyên tử cacbon (C) tham gia liên kết với bốn nguyên tử H tạo thành phân tử CH4 thì obitan 2s đã trộn lẫn với ba obitan 2p tạo thành bốn obitan mới giống hệt nhau gọi là bốn obitan lai hóa sp3. Bốn obitan lai hóa sp3 xen phủ với bốn obitan 1s của bốn nguyên tử H tạo thành bốn liên kết C - H giống nhau.
Nguyên nhân của sự lai hóa là các obitan hóa trị ở các phân lớp khác nhau có năng lượng và hình dạng khác nhau cần phải đồng nhất để tạo được liên kết bền với các nguyên tử khác.
Lai hóa giữa obitan 2s và obitan 2p Hóa Học Lai Hóa
Khi obitan 2s của nguyên tử cacbon tổ hợp với 1 hoặc nhiều obitan 2p thì sẽ xảy ra ba trường hợp sau:
- Obitan 2s + 1 Obitan 2p → 2 Obitan lai hóa sp + 2 Obitan 2p còn lại
- Obitan 2s + 2 Obitan 2p → 3 Obitan lai hóa sp2 + 1 Obitan 2p còn lại
- Obitan 2s + 3 Obitan 2p → 4 Obitan lai hóa sp3
- ?Obitan lai hóa sẽ được dùng trong liên kết sigma với nguyên tử khác, các obitan còn lại được dùng cho liên kết pi. Obitan lai hóa sp thường được dùng để liên kết với 2 nguyên tử hoặc nhóm nguyên tử, obitan lai hóa sp2 thường liên kết với 3 và obitan lai hóa sp3 thường liên kết với 4 nguyên tử hoặc nhóm nguyên tử.
Lai hóa sp Hóa Học Lai Hóa3
Lai hóa sp Hóa Học Lai Hóa3 là sự tổ hợp 1 obitan s với 3 obitan p của một nguyên tử tham gia liên kết tạo thành 4 obitan lai hóa sp3 định hướng từ tâm đến 4 đỉnh của hình tứ diệnđều, các trục đối xứng của chúng tạo với nhau một góc khoảng 109°28'
Lai hóa sp Hóa Học Lai Hóa3 được gặp ở các nguyên tử O, N, C trong các phân tử H2O, NH3, CH4 và các ankan.
Ví dụ: phân tử methan CH4
Cấu hình electron của nguyên tử C ở trạng thái kích thích:

Obitan 2s lai hóa với 3 obitan 2p tạo thành 4 obitan lai hóa sp3

4 obitan lai hóa sp3 xen phủ với obitan 1s của nguyên tử Hydro tạo thành 4 liên kết sigma.
Góc liên kết trong phân tử CH4 là 109°28'
Lai hóa sp Hóa Học Lai Hóa2

Lai hóa sp Hóa Học Lai Hóa2 là sự tổ hợp 1 obitan s với 2 obitan p của một nguyên tử tham gia liên kết tạo thành 3 obitan lai hóa sp2 nằm trong một mặt phẳng, định hướng từ tâm đến đỉnh của tam giác đều. Góc liên kết là 120°.
Lai hóa sp Hóa Học Lai Hóa2 được gặp trong các phân tử BF3, C2H4...
Ví dụ: phân tử etilen C2H4:

Cấu hình electron của nguyên tử C ở trạng thái kích thích:

Obitan 2s lai hóa với 2 obitan 2p tạo thành 3 obitan lai hoá sp2

Ba obitan lai hóa sp2 tạo 1 liên kết sigma giữa hai nguyên tử cacbon và 2 liên kết sigma với hai nguyên tử Hydro. Mỗi nguyên tử cacbon còn 1 obitan p không tham gia lai hóa sẽ xen phủ bên với nhau tạo liên kết pi.
Lai hóa sp Hóa Học Lai Hóa
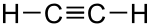
Lai hóa sp Hóa Học Lai Hóa là sự tổ hợp 1 obitan s với 1 obitan p của một nguyên tử tham gia liên kết tạo thành 2 obitan lai hóa sp nằm thẳng hàng với nhau hướng về hai phía, đối xứng nhau. Góc liên kết là 180°.
Lai hóa sp Hóa Học Lai Hóa được gặp trong các phân tử BeH2, C2H2, BeCl2...
Ví dụ: phân tử C2H2
Cấu hình electron của nguyên tử C ở trạng thái kích thích:

Obitan 2s lai hóa với 1 obitan 2p tạo thành 2 obitan lai hóa sp

Hai obitan lai hóa sp tạo 1 liên kết sigma giữa hai nguyên tử cacbon và 1 liên kết sigma với 2 nguyên tử Hydro. Hai obitan p còn lại xen phủ bên với nhau từng đôi một tạo ra 2 liên kết pi.
Ngoài ra còn có lai hóa sp3d và lai hóa sp3d2.
Tham khảo
This article uses material from the Wikipedia Tiếng Việt article Lai hóa (hóa học), which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Nội dung được phát hành theo CC BY-SA 4.0, ngoại trừ khi có ghi chú khác. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Tiếng Việt (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.

