Alkan
Alkan (tiếng Anh: alkane /ˈæl.keɪn/) trong hóa hữu cơ là hydrocarbon no không tạo mạch vòng.
Bài viết này cần thêm chú thích nguồn gốc để kiểm chứng thông tin. |
- Đối với hydrocarbon no chứa một hay nhiều mạch vòng, xem Cycloalkan.
Điều đó có nghĩa là chúng là các hydrocarbon không tạo mạch vòng, trong đó mỗi phân tử chứa số nguyên tử hydro cực đại và không chứa các liên kết đôi.

Alkan còn được biết đến như là parafin, hoặc nói một cách tổng thể là dãy parafin; tuy nhiên các thuật ngữ này chỉ được sử dụng để chỉ tới các alkan mà các nguyên tử carbon của nó tạo thành mạch đơn không phân nhánh; trong trường hợp đó, các alkan mạch nhánh được gọi là isoparafin.
Công thức tổng quát của alkan là CnH2n+2 (với n là số nguyên dương); do đó alkan đơn giản nhất là methan, CH4. Tiếp theo là ethan, C2H6; dãy này có thể kéo dài vô tận. Mỗi một nguyên tử carbon trong alkan có cặp lai quỹ đạo sp3.
Đồng phân Alkan
Các nguyên tử carbon trong các alkan (có chứa hơn 3 nguyên tử carbon) có thể sắp xếp theo nhiều cách khác nhau, tạo ra các đồng phân khác nhau. Alkan "thông thường" có cấu trúc thẳng, không phân nhánh. Số lượng các đồng phân tăng nhanh theo số lượng nguyên tử carbon; đối với các alkan có từ 1 đến 12 nguyên tử carbon thì số các đồng phân lần lượt là 1, 1, 1, 2, 3, 5, 9, 18, 35, 75, 159, 355.
Danh pháp khoa học Alkan
Trong tiếng Việt, tên gọi của các alkan kết thúc bằng -an.
Các alkan mạch thẳng
Mười phân tử đầu tiên của dãy (theo số lượng nguyên tử carbon) được đặt tên như sau:
- methan, CH4
- ethan, C2H6
- propan, C3H8
- butan, C4H10
- pentan, C5H12
- hexan, C6H14
- heptan, C7H16
- octan, C8H18
- nonan, C9H20
- decan, C10H22
| Wiki Commons có thêm hình ảnh và phương tiện truyền tải về Ankan mạch thẳng. |
Các alkan chứa 5 hoặc nhiều hơn nguyên tử carbon được đặt tên bằng cách bổ sung thêm hậu tố -an vào quy ước chính xác của IUPAC để đọc các số. Do đó, pentan, C5H12; hexan, C6H14; heptan, C7H16; octan, C8H18; v...v... Để có danh sách hoàn chỉnh hơn, xem Danh sách các alkan.
Các alkan mạch không phân nhánh đôi khi được bổ sung thêm tiền tố n- (ám chỉ thông thường) để phân biệt chúng với các alkan mạch nhánh có cùng số nguyên tử carbon. Mặc dù nó không phải là cần thiết một cách tuyệt đối, nhưng việc sử dụng nó vẫn là phổ biến trong các trường hợp mà ở đó có sự khác biệt quan trọng về thuộc tính giữa alkan mạch không phân nhánh và các đồng phân mạch nhánh: ví dụ n-hexan là một chất độc đối với hệ thần kinh trong khi các đồng phân mạch nhánh của nó thì lại không phải.
Các alkan mạch nhánh
Các alkan mạch nhánh được đặt tên như sau:
- Xác định mạch các nguyên tử carbon dài nhất.
- Đánh số các nguyên tử carbon trong mạch này, bắt đầu từ 1 tại đầu gần nhánh hơn và tiếp tục đếm cho đến khi gặp nguyên tử carbon cuối cùng của mạch đó ở đầu kia.
- Kiểm tra các nhóm đính vào mạch theo trật tự và tạo ra tên gọi cho chúng.
- Tạo ra tên bằng cách nhìn vào các nhóm đính vào khác nhau, và viết tên của chúng cho từng nhóm, theo trật tự sau:
- Số hay các số của nguyên tử carbon, hay các nguyên tử, mà ở đó nó đính vào.
- Các tiền tố di-, tri-, tetra- v.v nếu nhóm đính vào 2, 3, 4 v.v vị trí trong mạch, hoặc không có gì nếu nó được đính vào chỉ một chỗ duy nhất.
- Tên của nhóm đính vào.
- Việc tạo ra tên gọi được kết thúc khi đã viết xong tên gọi của mạch carbon dài nhất.
Để thực hiện thuật toán này, người ta cần phải biết các nhóm thay thế được gọi như thế nào. Điều này được thực hiện bằng cùng một cách, ngoại trừ là thay vì sử dụng mạch carbon dài nhất thì người ta sử dụng mạch dài nhất bắt đầu từ điểm đính vào; ngoài ra, việc đánh số được thực hiện sao cho nguyên tử carbon tiếp theo điểm đính vào có giá trị số bằng 1.
Ví dụ, hợp chất (CH3)3-CH là alkan chứa 4 nguyên tử carbon duy nhất có thể có tính chất khác với butan CH3-CH2-CH2-CH3. Tên gọi hình thức của nó là 2-methylpropan.
Tuy nhiên, pentan có hai đồng phân mạch nhánh ngoài dạng mạch thẳng thông thường là: (CH3)4-C hay 2,2-dimethylpropan và (CH3)2-CH-CH2-CH3 hay 2-methylbutan.
Tên gọi thông thường
Các tên gọi ngoài hệ thống vẫn được duy trì trong hệ thống của IUPAC:
Tên gọi isooctan được sử dụng rộng rãi trong công nghiệp hóa dầu để chỉ 2,2,4-trimethylpentan.
Sự phổ biến Alkan

Alkan có cả trên Trái Đất và trong hệ Mặt Trời, tuy nhiên chỉ có một tỷ lệ không lớn và chủ yếu chỉ ở dạng "có dấu vết". Các hydrocarbon nhẹ, đặc biệt là methan và ethan là một phần quan trọng của các thiên thể khác: ví dụ, chúng được tìm thấy trong đuôi của sao chổi Hyakutake và trong một số thiên thạch chẳng hạn như các loại chondrit carbon. Chúng cũng tạo thành một phần quan trọng của bầu khí quyển của các hành tinh khí ngoài xa của hệ Mặt Trời như Mộc Tinh, Thổ Tinh, Thiên Vương Tinh và Hải Vương Tinh. Trên Titan, vệ tinh của Thổ Tinh, người ta tin rằng đã từng có một đại dương lớn chứa các alkan mạch dài, các biển nhỏ chứa ethan lỏng được cho là vẫn còn tồn tại.
Dấu vết của methan (khoảng 0,0001% hay 1 ppm) có trong bầu khí quyển Trái Đất, được sản xuất chủ yếu bởi các dạng khuẩn cổ. Hàm lượng trong nước biển là không đáng kể do độ hòa tan thấp trong nước: tuy nhiên, ở áp suất cao và nhiệt độ thấp, methan có thể cùng kết tinh với nước để tạo ra methan hydrat rắn. Mặc dù chúng không thể được khai thác trong phạm vi thương mại vào thời điểm hiện tại nhưng giá trị về năng lượng của các mỏ methan hydrat đã biết vượt xa tổng giá trị năng lượng của tất cả các mỏ khí thiên nhiên và dầu mỏ—methan thu được từ methan hydrat vì thế được coi là ứng cử viên cho nguồn nhiên liệu trong tương lai.

Ngày nay, các nguồn thương mại quan trọng nhất của alkan rõ ràng là khí thiên nhiên và dầu mỏ, là những hợp chất hữu cơ duy nhất có ở dạng khoáng chất trong tự nhiên. Khí thiên nhiên chủ yếu chứa methan và ethan, với một chút propan và butan. Dầu mỏ là hỗn hợp của các alkan lỏng và các hydrocarbon khác. Cả hai đều được hình thành khi các động vật biển chết được che phủ bằng trầm tích để loại bỏ sự có mặt của oxy và được chuyển hóa sau nhiều triệu năm ở nhiệt độ và áp suất cao thành các chất tự nhiên tương ứng. Ví dụ dưới đây miêu tả một phản ứng hình thành ra khí thiên nhiên:
- C6H12O6 → 3CH4 + 3CO2
Chúng tự tập hợp lại trong các loại đá xốp, được che phủ bởi các lớp không thấm nước phía trên. Ngược lại với methan là hợp chất được tạo ra với khối lượng lớn, các alkan mạch dài hơn ít được tạo ra để có một khối lượng đáng kể trong tự nhiên. Các mỏ dầu hiện nay sẽ không được tái tạo một khi chúng bị cạn kiệt.
Các alkan rắn thu được như là cặn còn lại sau khi cho dầu mỏ bay hơi, được biết đến như là hắc ín. Một trong các mỏ tự nhiên lớn nhất của alkan rắn là trong hồ chứa bitum gọi là La Brea trên đảo Trinidad vùng Caribe.
Làm tinh khiết và sử dụng Alkan
Các alkan là nguyên liệu thô quan trọng cho công nghiệp hóa dầu và là nguồn nhiên liệu quan trọng nhất của kinh tế thế giới.
Các nguyên liệu ban đầu cho gia công chế biến là khí thiên nhiên và dầu thô. Dầu thô được tách ra tại các nhà máy lọc dầu bằng cách chưng cất phân đoạn và sau đó được chế biến thành các sản phẩm khác nhau, ví dụ xăng. Sự "phân đoạn" khác nhau của dầu thô có các điểm sôi khác nhau và có thể cô lập và tách bóc rất dễ dàng: với các phân đoạn khác nhau thì các chất có điểm sôi gần nhau sẽ bay hơi cùng với nhau.
Sử dụng chủ yếu của một alkan nào đó có thể xác định hoàn toàn phù hợp với số nguyên tử carbon trong nó, mặc dù sự phân chia ranh giới dưới đây là đã lý tưởng hóa và chưa thực sự hoàn hảo. Bốn alkan đầu tiên được sử dụng chủ yếu để cung cấp nhiệt cho các mục đích sưởi ấm và nấu ăn, và trong một số quốc gia còn để chạy máy phát điện. Methan và ethan là các thành phần chủ yếu của khí thiên nhiên; chúng thông thường được lưu trữ như là khí nén. Tuy nhiên, rất dễ dàng chuyển chúng sang dạng lỏng: điều này đòi hỏi đồng thời việc nén và làm lạnh khí.
Propan và butan có thể hóa lỏng ở áp suất tương đối thấp, và chúng được biết dưới tên gọi khí hóa lỏng (viết tắt trong tiếng Anh là LPG). Ví dụ, propan được sử dụng trong các lò nung khí propan còn butan thì trong các bật lửa sử dụng một lần (ở đây áp suất chỉ khoảng 2 bar). Cả hai alkan này được sử dụng làm tác nhân đẩy trong các bình xịt.
Từ pentan tới octan thì alkan là các chất lỏng dễ bay hơi. Chúng được sử dụng làm nhiên liệu trong các động cơ đốt trong, do chúng dễ hóa hơi khi đi vào trong khoang đốt mà không tạo ra các giọt nhỏ có thể làm hư hại tính đồng nhất của sự cháy. Các alkan mạch nhánh được ưa chuộng hơn, do chúng có sự bắt cháy muộn hơn so với các alkan mạch thẳng tương ứng (sự bắt cháy sớm là nguyên nhân sinh ra các tiếng nổ lọc xọc trong động cơ và dễ làm hư hại động cơ). Xu hướng bắt cháy sớm được đo bằng chỉ số octan của nhiên liệu, trong đó 2,2,4-trimethylpentan (isooctan) có giá trị quy định ngẫu hứng là 100 còn heptan có giá trị bằng 0. Bên cạnh việc sử dụng như là nguồn nhiên liệu thì các alkan này còn là dung môi tốt cho các chất không phân cực.
Các alkan từ nonan tới ví dụ là hexadecan (alkan với mạch chứa 16 nguyên tử carbon) là các chất lỏng có độ nhớt cao, ít phù hợp cho mục đích sử dụng như là xăng. Ngược lại, chúng tạo ra thành phần chủ yếu của dầu diesel và nhiên liệu hàng không. Các nhiên liệu diesel được đánh giá theo chỉ số cethan (cethan là tên gọi cũ của hexadecan). Tuy nhiên, điểm nóng chảy cao của các alkan này có thể sinh ra các vấn đề ở nhiệt độ thấp và tại các vùng gần cực Trái Đất, khi đó nhiên liệu trở nên đặc quánh hơn và sự truyền dẫn của chúng không được đảm bảo chuẩn xác.
Các alkan từ hexadecan trở lên tạo ra thành phần quan trọng nhất của các loại chất đốt trong các lò đốt và dầu bôi trơn. Ở chức năng sau thì chúng làm việc như là các chất chống gỉ do bản chất không ưa nước của chúng làm cho nước không thể tiếp xúc với bề mặt kim loại. Nhiều alkan rắn được sử dụng như là sáp parafin, ví dụ trong các loại nến. Không nên nhầm lẫn sáp parafin với sáp thực sự (ví dụ sáp ong) chủ yếu là hỗn hợp của các este.
Các alkan với độ dài mạch carbon khoảng từ 35 trở lên được tìm thấy trong bitum, được sử dụng chủ yếu trong nhựa đường để rải đường. Tuy nhiên, các alkan có mạch carbon lớn có ít giá trị thương mại và thông thường hay được tách ra thành các alkan mạch ngắn hơn thông qua phương pháp cracking.
Điều chế Alkan
Ý nghĩa: Ngoài việc tổng hợp được các alkan cần cho Công nghiệp hay phòng thí nghiệm (Lab) thì việc tổng hợp này còn có một ý nghĩa khác đó là cho thấy cách chuyển hoá các bộ phận của phân tử (nhóm chức) thành các nhóm hydrocarbon no.
Phương pháp thứ nhất
Khử R-X (X là các Halogen) trực tiếp:
- R-X +2H --> R-H + H-X
Tác nhân khử co thể là Zn/HCl - Mg.Hg/HCl - H2/Pd, Pt, Ni.. - LiAlH4, NaBH4..- Na/EtOH...
Lưu ý: Một trong những tác nhân khử mạnh nữa là HI thường dùng để khử dẫn xuất Iod theo phản ứng sau: R-I + H-I --> R-H + I2 (Phản ứng Alkan xảy ra trong bình kín, nhiệt độ)
Phương pháp thứ hai
Thủy phân hợp chất cơ kim (Thường là cơ Magnesi- Hợp chất Grignard)
- R-X + Mg/ete khan ---> R-MgX + H2O ---> R-H + Mg(OH)X
Phương pháp thứ ba
Hydro hoá các hợp chất hydrocarbon không no
Phương pháp thứ tư
Hợp hai gốc hydrocarbon lại bằng cách tạo liên kết C-C (Có nhiều pp nhưng chủ yếu nhất vẫn là Wurtz và Corey - House)
1. Tổng hợp Wurtz (Vuyec-1854):
- R-X + 2Na + R-X --> R-R + 2NaX
Một vài lưu ý về phản ứng:
- • Phản ứng Alkan này đạt hiệu suất cao nhất khi 2 gốc hydrocarbon đem ghép là 2 gốc giống nhau.
- • Khi 2 gốc hydrocarbon đem ghép là 2 gốc khác nhau, phản ứng cho hỗn hợp sản phẩm R-R, R-R', R'-R'.
- • Phản ứng Alkan xảy ra trong dung môi là ether khan.
2. Tổng hợp Corey- House: Sơ đồ phản ứng tạm biểu diễn như sau:
- R-X + 2Li ---> RLi + LiX
- 2RLi + CuX ---> R2CuLi + LiX (R2CuLi: Lithi điAnkyl Cuprat)
- R2CuLi + R'X ---> R-R' + R-Cu + LiX
Lưu ý: Phản ứng Alkan chỉ xảy ra khi R' là dẫn xuất Halogen bậc 1 hay bậc 2. Phản ứng Alkan đạt hiệu suất cao nhất khi mà R và R' đều là dẫn xuất Hal bậc 1.
Cấu trúc phân tử Alkan
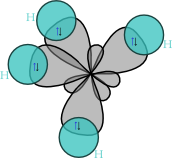
Cấu trúc phân tử Alkan của các alkan trực tiếp ảnh hưởng tới các thuộc tính hóa-lý của chúng. Nó thu được từ cấu hình điện tử của carbon, do nó có bốn điện tử hóa trị. Nguyên tử carbon trong các alkan luôn luôn cặp lai sp3, có nghĩa là các điện tử hóa trị có thể được coi là nằm trong 4 quỹ đạo (orbital) tương đương thu được từ tổ hợp của một quỹ đạo 2s và ba quỹ đạo 2p. Các quỹ đạo này, có các mức năng lượng đồng nhất, được sắp xếp trong không gian trong dạng của một hình tứ diện, các góc giữa chúng bằng 109,47°.
Độ dài và góc liên kết

Phân tử alkan chỉ có liên kết đơn C–H và C–C. Liên kết đầu là kết quả của phần chồng lên của quỹ đạo sp3 của carbon với quỹ đạo 1s của hydro; liên kết sau là do phần chồng lên của hai quỹ đạo sp3 trên các nguyên tử carbon khác nhau. Giá trị của các độ dài liên kết là 1,09×10−10 m đối với liên kết C–H và 1,54×10−10 m đối với liên kết C–C.
Sự phân bổ không gian của các liên kết là tương tự như của bốn quỹ đạo sp3—chúng phân bổ theo dạng tứ diện, với góc giữa chúng là 109,47°. Công thức cấu tạo trong đó thể hiện các liên kết như là vuông góc với nhau là phổ biến và hữu ích, nhưng không phù hợp với thực tế.
Cấu hình
Công thức cấu tạo và các góc liên kết không đủ để miêu tả đầy đủ dạng hình học của phân tử. Còn phải lưu ý tới độ tự do cho mỗi liên kết C–C: góc xoắn giữa các nguyên tử hoặc các nhóm liên kết tới các nguyên tử tại mỗi đầu của liên kết. Sự phân bổ không gian được miêu tả bởi các góc xoắn của phân tử được gọi là cấu hình của nó.
Ethan

Ethan là trường hợp đơn giản nhất để nghiên cứu cấu hình của alkan, do nó chỉ có một liên kết C–C. Nếu nhìn thẳng vào trục của liên kết C–C khi đó có cái gọi là ánh xạ Newman: vòng tròn đại diện cho hai nguyên tử carbon, một nguyên tử nằm sau nguyên tử kia, và các liên kết tới hydro được đại diện bởi các đường thẳng. Các nguyên tử hydro trên các liên kết tới nguyên tử carbon trước hay sau đều có góc giữa chúng là 120°, tạo ra do phép chiếu của hình tứ diện lên một mặt phẳng. Tuy nhiên góc xoắn giữa nguyên tử hydro nhất định gắn với nguyên tử carbon trước và nguyên tử hydro nhất định gắn với nguyên tử carbon sau có thể dao động tự do trong khoảng 0° và 360°. Đây là hệ quả của sự tự quay tự do xung quanh liên kết đơn C–C. Mặc dù có sự tự do biểu kiến này nhưng chỉ có hai cấu hình giới hạn là quan trọng:
- Trong cấu hình che lấp, tương ứng với góc xoắn 0°, 120° hay 240°, các nguyên tử hydro gắn với nguyên tử carbon trước là nằm ngay phía trước và thẳng hàng trong phép ánh xạ đối với các nguyên tử hydro gắn với nguyên tử carbon sau.
- Trong cấu hình so le, tương ứng với các góc xoắn 60°, 180° hay 300°, các nguyên tử hydro gắn với nguyên tử carbon trước trong phép ánh xạ là nằm chính xác ở giữa các nguyên tử hydro gắn với nguyên tử carbon sau.
Hai cấu hình này, còn được gọi là các rotomer là khác nhau về năng lượng: cấu hình so le thấp năng lượng hơn là 12,6 kJ/mol (ổn định hơn) so với cầu hình che khuất. Sự giải thích cho sự khác biệt về năng lượng này là chủ đề gây tranh cãi, với hai thuyết chủ đạo chính là:
- Trong cấu hình che khuất thì lực đẩy tĩnh điện giữa các điện tử trong các liên kết C–H là cực đại.
- Trong cấu hình so le thì sự siêu kết hợp (một dạng của phi cục bộ hóa) của các điện tử hóa trị là cực đại.
Hai giải thích này không phải là mâu thuẫn hay loại trừ lẫn nhau; giả thuyết sau được coi là quan trọng hơn đối với ethan.
Sự khác biệt về năng lượng giữa hai cấu hình, được biết đến như là năng lượng xoắn, là nhỏ so với nhiệt năng của phân tử ethan ở nhiệt độ bao quanh nó. Ở đây có sự tự quay liên tục xung quanh liên kết C–C, mặc dù với các "khoảng dừng" ngắn ở mỗi cấu hình so le. Thời gian cần thiết đối với phân tử ethan để chuyển từ một cấu hình so le sang cấu hình so le kế tiếp, tương đương với sự tự quay của một nhóm CH3 một góc 120° tương đối với các nhóm khác, là khoảng 10−11 giây.
Các alkan cao hơn

Các tình huống tương ứng với hai liên kết C–C trong propan về mặt định tính là tương tự như của ethan. Tuy nhiên, nó là phức tạp hơn nhiều đối với butan và các alkan mạch dài hơn.
Nếu người ta lấy liên kết C–C trung tâm của butan như là trục tham chiếu chính, mỗi một nguyên tử carbon trong số hai nguyên tử trung tâm được kiên kết với hai nguyên tử hydro và một nhóm methyl. Bốn cấu hình khác nhau có thể phân biệt và xác định theo góc xoắn giữa hai nhóm methyl và giống như trong trường hợp của ethan, mỗi cấu hình này đều có mức năng lượng đặc trưng của nó.
- Cấu hình che khuất hoàn toàn hay cùng chiều có góc xoắn bằng 0°. Nó là cấu hình có mức năng lượng cao nhất.
- Cấu hình nghiêng có góc xoắn 60° (hay 300°). Nó là cực tiểu về năng lượng cục bộ.
- Cấu hình che khuất một phần có góc xoắn 120° (hay 240°). Nó là cực đại về năng lượng cục bộ.
- Cấu hình ngược chiều có góc xoắn 180°. Hai nhóm methyl là xa nhau nhất ở mức có thể và cấu hình này có mức năng lượng thấp nhất.
Chênh lệch về năng lượng giữa hai cấu hình "che khuất hoàn toàn" và "ngược chiều" là khoảng 19 kJ/mol, và vì thế vẫn là tương đối nhỏ ở nhiệt độ bao quanh nó.
Trường hợp của các alkan mạch dài hơn là tương tự: cấu hình ngược chiều luôn luôn là cấu hình ưa thích nhất xung quanh mỗi liên kết C–C. Vì lý do này, các alkan thường được biểu diễn dưới dạng phân bổ chữ chi (zigzag) trong các giản đồ hay các mô hình. Cấu trúc thực sự luôn khác biệt một chút so với các dạng lý tưởng hóa này, do khác biệt về năng lượng giữa các cấu hình là nhỏ so với nhiệt năng của phân tử: các phân tử alkan không có dạng cấu trúc cố định giống như những gì mà các mô hình đề ra.
Các cấu hình của các phân tử chất hữu cơ dựa trên các tính chất này của alkan và được xem xét trong các bài liên quan.
Thuộc tính Alkan
Vật lý
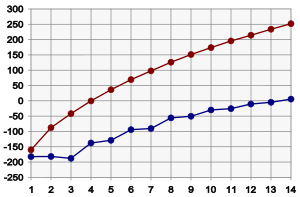 Cấu trúc phân tử Alkan, cụ thể là diện tích bề mặt của phân tử, xác định điểm sôi của alkan: diện tích bề mặt càng nhỏ thì điểm sôi càng thấp, do các lực van der Waals giữa các phân tử là yếu hơn. Việc giảm diện tích bề mặt có thể thu được nhờ tạo nhánh hay là cấu trúc vòng. Điều này có nghĩa là trong thực tế các alkan có số nguyên tử carbon nhiều hơn thông thường sẽ có điểm sôi cao hơn so với các alkan có số nguyên tử carbon nhỏ hơn, và các alkan mạch nhánh và cycloalkan có điểm sôi thấp hơn so với các dạng mạch thẳng của chúng. Ở điều kiện tiêu chuẩn, từ CH4 tới C4H10 thì các alkan có dạng khí; từ C5H12 tới C17H36 chúng là lỏng; và từ C18H38 thì chúng là rắn. Điểm sôi tăng khoảng 20 tới 30 °C cho một nhóm CH2.
Cấu trúc phân tử Alkan, cụ thể là diện tích bề mặt của phân tử, xác định điểm sôi của alkan: diện tích bề mặt càng nhỏ thì điểm sôi càng thấp, do các lực van der Waals giữa các phân tử là yếu hơn. Việc giảm diện tích bề mặt có thể thu được nhờ tạo nhánh hay là cấu trúc vòng. Điều này có nghĩa là trong thực tế các alkan có số nguyên tử carbon nhiều hơn thông thường sẽ có điểm sôi cao hơn so với các alkan có số nguyên tử carbon nhỏ hơn, và các alkan mạch nhánh và cycloalkan có điểm sôi thấp hơn so với các dạng mạch thẳng của chúng. Ở điều kiện tiêu chuẩn, từ CH4 tới C4H10 thì các alkan có dạng khí; từ C5H12 tới C17H36 chúng là lỏng; và từ C18H38 thì chúng là rắn. Điểm sôi tăng khoảng 20 tới 30 °C cho một nhóm CH2.
Các điểm nóng chảy của các alkan cũng tăng theo chiều tăng của số nguyên tử carbon (ngoại lệ duy nhất là propan). Tuy nhiên, điểm nóng chảy tăng chậm hơn nhiều so với sự tăng của điểm sôi, cụ thể là đối với các alkan lớn. Ngoài ra, điểm nóng chảy của các alkan chứa lẻ số nguyên tử carbon tăng nhanh hơn so với điểm nóng chảy của các alkan chứa chẵn số nguyên tử carbon (xem hình): nguyên nhân của hiện tượng này là do "mật độ bao gói" cao hơn của các alkan chứa chẵn số nguyên tử carbon. Điểm nóng chảy của các alkan mạch nhánh có thể cao hơn hoặc thấp hơn so với các alkan mạch thẳng tương ứng, phụ thuộc vào hiệu quả của sự bao gói phân tử: nó là đúng phần nào với đối với các isoalkan (các đồng phân 2-methyl), thông thường có điểm nóng chảy cao hơn so với các đồng phân mạch thẳng của nó.
Các alkan không có tính dẫn điện và về cơ bản chúng cũng không bị phân cực bởi điện trường. Vì lý do này chúng không tạo ra các liên kết hydro và vì vậy không hòa tan trong các dung môi phân cực như nước. Do các liên kết hydro giữa các phân tử nước riêng biệt là tách biệt với các phân tử alkan, sự cùng tồn tại của alkan và nước dẫn tới sự tăng trong trật tự phân tử (giảm entropy). Do không có liên kết đáng kể giữa các phân tử nước và phân tử alkan, định luật hai nhiệt động lực học cho rằng việc giảm entropy này được giảm thiểu bằng cách giảm thiểu sự tiếp xúc giữa alkan và nước: các alkan được coi là không ưa nước và chúng là đẩy nước.
Độ hòa tan của chúng trong các dung môi không phân cực là tương đối tốt, một thuộc tính gọi là ưa mỡ. Các alkan khác nhau là có thể trộn lẫn nhau với tỷ lệ bất kỳ.
Tỷ trọng của các alkan thông thường tăng theo chiều tăng của số nguyên tử carbon, nhưng vẫn thấp hơn tỷ trọng của nước. Vì thế, các alkan tạo thành lớp trên trong hỗn hợp alkan-nước.
Hóa học
Các alkan nói chung thể hiện tính hoạt động hóa học tương đối yếu, do các liên kết C–H và C–C của chúng là tương đối ổn định và không dễ phá vỡ. Không giống như các hợp chất hữu cơ khác, chúng không có các nhóm chức.
Chúng phản ứng rất kém với các chất có tính điện ly hay phân cực. Các giá trị pKa của tất cả các alkan là trên 60, vì thế trên thực tế chúng là trơ với các acid hay base. Tính trơ này là nguồn gốc của thuật ngữ parafin (tiếng Latinh para + affinis, với nghĩa là "thiếu ái lực"). Trong dầu thô các phân tử alkan giữ các thuộc tính hóa học không thay đổi trong hàng triệu năm.
Tuy nhiên các phản ứng oxy hóa-khử của các alkan, cụ thể là với oxy và các halogen, là có thể do các nguyên tử carbon là ở trong các điều kiện khử mạnh; trong trường hợp của methan, trạng thái oxy hóa thấp nhất đối với carbon (−4) đã đạt tới. Phản ứng Alkan với oxy dẫn tới sự cháy; với các halogen là các phản ứng thế.
Các gốc tự do và các phân tử với các điện tử không bắt cặp đóng vai trò quan trọng trong phần lớn các phản ứng của alkan, chẳng hạn như trong cracking và sửa đổi mà ở đó các alkan mạch dài bị chia cắt thành các alkan và alken mạch ngắn hay các alkan mạch thẳng bị chuyển thành các đồng phân mạch nhánh.
Trong các alkan mạch nhánh lớn thì các góc liên kết có thể khác đáng kể so với giá trị tối ưu (109,5°) để đảm bảo cho các nhóm khác có đủ không gian cần thiết. Điều này sinh ra sự căng trong phân tử, được biết đến như là sự cản trở không gian, và nó có thể tắng độ hoạt động hóa học đáng kể.
Quang phổ
Gần như mọi hợp chất hữu cơ đều chứa các liên kết C–C và C–H, và vì thế chúng thể hiện một số dặc trưng của alkan trong quang phổ của chúng. Các alkan đáng chú ý là do không có các nhóm khác và vì vậy chúng thiếu vắng các đặc trưng quang phổ khác.
Phổ hồng ngoại
Kiểu kéo căng C–H tạo ra sự hấp thụ mạnh ở khoảng 2850 và 2960 cm−1, trong khi kiểu kéo căng C–C hấp thụ trong khoảng giữa 800 và 1300 cm−1. Kiểu liên kết C–H phụ thuộc vào bản chất của nhóm: các nhóm methyl xuất hiện ở dải 1450 cm−1 và 1375 cm−1, trong khi các nhóm methylen xuất hiện ở dải 1465 cm−1 và 1450 cm−1. Các mạch carbon với nhiều hơn 4 nguyên tử carbon xuất hiện vạch hấp thụ yếu ở khoảng 725 cm−1.
Phổ NMR
Sự cộng hưởng proton của các alkan thông thường tìm thấy ở δH = 0–1. Sự cộng hưởng carbon-13 phụ thuộc vào số nguyên tử hydro đính vào carbon: δC = 8–30 (methyl), 15–55 (methylen), 20–60 (methyn). Sự cộng hưởng carbon-13 của nguyên tử carbon trong nhóm bốn là rất yếu, do thiếu hiệu ứng tăng Overhauser hạt nhân và thời gian dãn dài: nó có thể bỏ qua trong quang phổ thông thường.
Phép đo phổ khối lượng
Các alkan có năng lượng ion hóa cao, và các ion thông thường là rất yếu. Các kiểu phân chia rất khó diễn giải, nhưng trong trường hợp của các alkan mạch nhánh thì mạch carbon có xu hướng bị tách ra ở carbon thứ ba hay thứ tư do tính ổn định tương đối của các gốc tự do tạo thành. Sự phân chia tạo ra do mất nhóm methyl đơn (M−15) thông thường không tồn tại, và sự phân chia khác thông thường được dàn theo các khoảng của 14 đơn vị khối lượng, tương ứng với sự mất liên tiếp các nhóm CH2.
Phản ứng Alkan
Với oxy
Tất cả các alkan phản ứng với oxy trong phản ứng cháy, mặc dù chúng trở nên khó bắt lửa hơn khi số lượng nguyên tử carbon tăng lên. Phương trình tổng quát của phản ứng cháy hoàn toàn là:
- 2CnH2n+2 + (3n+1)O2 → 2(n+1)H2O + 2nCO2
Khi không có đủ lượng oxy cần thiết thì carbon mônôxít hay thậm chí là muội than có thể tạo ra, như được chỉ ra dưới đây cho methan:
- 2CH4 + 3O2 → 2CO + 4H2O
- CH4 + O2 → C + 2H2O
Các alkan thông thường cháy với ngọn lửa không sáng và rất ít muội than được tạo ra.
Sự thay đổi enthalpy của sự cháy, ΔcHo, đối với các alkan tăng khoảng 650 kJ/mol cho một nhóm CH2. Các alkan mạch nhánh có giá trị ΔcHo thấp hơn so với các alkan mạch thẳng khi cùng một số nguyên tử carbon, vì thế có thể coi là ổn định hơn về một số khía cạnh nào đó.
Với các halogen
Các alkan phản ứng với các halogen trong phản ứng gọi là phản ứng halogen hóa. Các nguyên tử hydro trong alkan bị thay thế dần dần, hay bị thay thế bằng các nguyên tử halogen. Các gốc tự do là các dạng chất tham gia vào trong phản ứng, thông thường hay tạo ra hỗn hợp các sản phẩm. Các phản ứng này là phản ứng tỏa nhiệt cao và có thể dẫn tới nổ.
Chuỗi cơ chế phản ứng như sau, với chlor hóa methan là ví dụ điển hình:
- 1. Khởi đầu: Chia cắt phân tử chlor để tạo ra hai nguyên tử chloro, được kích thích bằng bức xạ cực tím. Nguyên tử chlor có điện tử không bắt cặp và phản ứng như là một gốc tự do.
- Cl2 → 2Cl·
- 2. Lan truyền (2 bước): Nguyên tử hydro bị lôi ra khỏi methan sau đó gốc methyl kéo Cl· từ Cl2.
- CH4 + Cl· → CH3· + HCl
- CH3· + Cl2 → CH3Cl + Cl·
- Điều này tạo ra sản phẩm mong muốn và gốc chlor tự do khác. Gốc tự do này sau đó sẽ tham gia vào trong phản ứng lan truyền khác sinh ra một phản ứng dây chuyền. Nếu có đủ chloro, các sản phẩm khác chẳng hạn như CH2Cl2 có thể tạo ra.
- 3. Kết thúc: Tái tổ hợp của hai gốc tự do:
- Cl· + Cl· → Cl2; hay
- CH3· + Cl· → CH3Cl; hoặc
- CH3· + CH3· → C2H6.
- Khả năng cuối cùng trong bước kết thúc sẽ tạo ra tạp chất trong hỗn hợp cuối cùng; chủ yếu là sự tạo ra các phân tử hữu cơ với mạch carbon dài hơn thay vì tái tạo lại các chất tham gia phản ứng.
Trong trường hợp của methan hay ethan, mọi nguyên tử hydro đều bình đẳng và có cơ hội nganh nhau để được thay thế. Điều này dẫn đến cái gọi là sự phân bổ sản phẩm thống kê. Đối với propan và các alkan lớn hơn thì các nguyên tử hydro tạo thành các nhóm CH2 (hay CH) được ưu tiên thay thế.
Phản ứng Alkan của các halogen khác nhau dao động đáng kể: tỷ lệ tương đối là: fluor (108) > chlor (1) > brom (7×10−11) > iod (2×10−22). Vì thế phản ứng của alkan với flo là khó kiểm soát nhất, với chlor là nhanh vừa phải, với brom là chậm và đòi hỏi mức độ chiếu xạ tia cực tím cao còn với iod trên thực tế là không tồn tại và không có lợi về mặt nhiệt động lực học.
Các phản ứng này là quy trình công nghiệp quan trọng để halogen hóa các hydrocarbon.
Cracking và sửa đổi
"Cracking" phá vỡ các phân tử lớn thành các phân tử nhỏ hơn. Nó có thể thực hiện bằng các phương pháp nhiệt hay sử dụng chất xúc tác. Quy trình cracking nhiệt tuân theo cơ chế chia cắt liên kết đối xứng, có nghĩa là các liên kết bị phá vỡ đối xứng và cặp các gốc tự do được tạo ra. Quy trình cracking với chất xúc tác được diễn ra với sự tham gia của chất xúc tác acid (thông thường là các acid rắn) như nhôm silicat và zeolit) có xu hướng phá vỡ bất đối xứng các liên kết tạo ra các cặp ion ngược dấu điện tích, thông thường là carbocation và anion hydride rất không ổn định. Các gốc tự do carbon-khu vực hóa và các cation là không ổn định và nhanh chóng tham gia vào quá trình tái tạo mạch, sự phân chia C-C tại vị trí beta (có nghĩa là cracking) và hydro nội phân tử và liên phân tử được di chuyển hoặc trong di chuyển hydride. Trong cả hai dạng quy trình, các chất trung gian của phản ứng (gốc tự do, ion) được tái tạo liên tục, và vì vậy chúng được tạo ra trong một cơ chế tự lan truyền. Chuỗi các phản ứng cuối cùng được kết thúc bằng sự tái tổ hợp các gốc tự do hay các ion.
Ở đây là ví dụ về cracking butan CH3-CH2-CH2-CH3
- Khả năng 1 (48%): việc phá vỡ thực hiện trên liên kết CH3-CH2.
CH3* / *CH2-CH2-CH3
sau một số bước người ta thu được alkan và alken:
CH4 + CH2=CH-CH3
- Khả năng 2 (38%): việc phá vỡ thực hiện trên liên kết CH2-CH2.
CH3-CH2* / *CH2-CH3
sau một số bước người ta thu được alkan và alken dạng khác:
CH3-CH3 + CH2=CH2
- Khả năng 3 (14%): phá vỡ liên kết C-H.
sau một số bước người ta thu được alken và hydro:
CH2=CH-CH2-CH3 + H2
Các phản ứng khác
Các alkan sẽ phản ứng với hơi nước khi có mặt chất xúc tác nickel để tạo ra hydro. Alkan có thể chlorosulfonat hóa và nitrat hóa, mặc dù cả hai phản ứng đều đòi hỏi các điều kiện đặc biệt. Sự lên men hóa các alkan thành các acid carboxylic có một tầm quan trọng kỹ thuật.
Hydrocracking
Đối với các alkan có số carbon lớn (parafin), chúng có thể phản ứng đựoc với hydro trong điều kiện nhiệt độ, áp suất rất cao. Sản phẩm của quá trình này là các hydrocarbon nhẹ,mạch ngắn đến trung bình, chủ yếu dùng làm xăng.
Nguy hiểm Alkan
Methan là một chất nổ khi trộn với không khí (1–8% CH4) và là một chất khí gây hiệu ứng nhà kính mạnh: các alkan thấp khác có thể là chất nổ khi trộn cùng không khí. Các alkan lỏng là những chất dễ bắt lửa, mặc dù rủi ro này giảm dần theo chiều dài mạch carbon. Pentan, hexan và heptan được xếp loại là nguy hiểm cho môi trường và có hại: octan cũng được phân loại là có hại. Hexan mạch thẳng là một chất độc cho hệ thần kinh và vì thế ít được sử dụng trong thương mại.
Trong tự nhiên Alkan
Mặc dù các alkan có trong tự nhiên theo nhiều cách khác nhau, chúng không được đánh giá như là các chất thiết yếu xét về mặt sinh học. Các cycloalkan với số nguyên tử carbon từ 14 tới 18 có trong xạ hương, được chiết ra từ hươu xạ (họ Moschidae). Tất cả các thông tin dưới đây đều chỉ áp dụng cho các alkan không tạo vòng.
Vi khuẩn và khuẩn cổ

Một số loại vi khuẩn nhất định có thể chuyển hóa các alkan: chúng ưa thích các alkan có mạch carbon chẵn do chúng dễ bị phân hủy hơn so với alkan mạch carbon lẻ.
Mặt khác một số vi khuẩn cổ, như methanogen, sản sinh ra một lượng lớn methan bằng cách chuyển hóa carbon dioxide hoặc oxy hóa các hợp chất hữu cơ khác. Năng lượng được giải phóng bằng sự oxy hóa hydro:
- CO2 + 4H2 → CH4 + 2H2O
Mêtanogen cũng sản xuất ra khí đầm lầy trong các vùng đất lầy và giải phóng khoảng 2 tỷ tấn methan mỗi năm—nồng độ methan trong khí quyển trên thực tế chủ yếu là do chúng sản xuất. Công suất sản xuất methan của trâu, bò và các động vật ăn cỏ khác có thể tới 150 lít một ngày, cũng như của mối, đều là do mêtanogen. Chúng cũng sản xuất alkan đơn giản nhất này trong ruột người. Các vi khuẩn cổ mêtanogen vì vậy nằm ở cuối của chu trình carbon, với carbon được giải phóng ngược trở lại khí quyển sau khi đã được cố định bởi quá trình quang hợp. Có lẽ là các mỏ khí thiên nhiên hiện nay cũng đã được hình thành theo cách tương tự.
Nấm và thực vật

Các alkan cũng đóng vai trò nhỏ trong sinh học của ba nhóm eukaryot là: nấm, thực vật và động vật. Một số loại men đặc biệt, ví dụ Candida tropicale, các loài họ Pichia, Rhodotorula, có thể sử dụng alkan như là nguồn carbon và/hoặc năng lượng. Loài nấm Amorphotheca resinae ưa thích các alkan mạch dài trong nhiên liệu hàng không, và có thể sinh ra các vấn đề nghiêm trọng cho máy bay trong các khu vực nhiệt đới.
Trong thực vật người ta cũng tìm thấy các alkan rắn mạch dài; chúng tạo ra một lớp sáp rắn chắc-lớp cutin (biểu bì), trên các khu vực mà thực vật bị lột trần ra ngoài không khí. Nó bảo vệ thực vật chống lại sự mất nước, đồng thời ngăn cản sự thất thoát của các khoáng chất quan trọng do bị mưa. Nó cũng bảo vệ thực vật chống lại vi khuẩn, nấm và các côn trùng có hại. Lớp vỏ sáng màu trên các loại quả như táo cũng chứa các alkan mạch dài. Mạch carbon thông thường nằm giữa 20 và 30 nguyên tử carbon và được thực vật sản xuất từ các acid béo. Thành phần chính xác của lớp sáp không chỉ phụ thuộc vào loài mà còn thay đổi theo mùa và các yếu tố môi trường như điều kiện chiếu sáng, nhiệt độ và độ ẩm.
Động vật
Các alkan cũng được tìm thấy trong các sản phẩm của động vật, mặc dù chúng ít quan trọng hơn so với các hydrocarbon không no. Một ví dụ là dầu gan cá mập chứa khoảng 14% pristan (2,6,10,14-tetramethylpentadecan, C19H40). Sự có mặt của chúng là quan trọng hơn trong các pheromon, loại hóa chất làm tín hiệu, mà gần như toàn bộ côn trùng đều cần khi liên lạc với nhau. Với một số loại, như được sử dụng bởi bọ cánh cứng Xylotrechus colonus, chủ yếu là pentacosan (C25H52), 3-methylpentaicosan (C26H54) và 9-methylpentaicosan (C26H54), chúng được chuyển giao bằng sự tiếp xúc cơ thể. Với các loài khác như muỗi xê xê Glossina morsitans morsitans, pheromon chứa 4 alkan là 2-methylheptadecan (C18H38), 17,21-dimethylheptatriacontan (C39H80), 15,19-dimethylheptatriacontan (C39H80) và 15,19,23-trimethylheptatriacontan (C40H82), và chúng hoạt động bằng mùi với một khoảng cách lớn, một đặc trưng hữu ích để kiểm soát sâu bọ.
Quan hệ sinh thái

Một ví dụ về alkan mà cả trên động và thực vật đều có vai trò là quan hệ sinh thái giữa ong cát (Andrena nigroaenea) và lan hình nhện (Ophrys sphegodes); trong đó hoa lan phụ thuộc vào sự thụ phấn của ong. Ngoài ra, ong cát sử dụng các pheromon để xác định bạn tình của mình; trong trường hợp của A. nigroaenea, con cái sử dụng hỗn hợp của tricosan (C23H48), pentacosan (C25H52) và heptacosan (C27H56) với tỷ lệ 3:3:1, và con đực bị hấp dẫn bởi mùi đặc trưng này. Cây hoa lan đã nắm được ưu thế này— các phần trong hoa của nó không chỉ tương tự như bề ngoài của ong cát, mà nó còn sản xuất ra một lượng lớn cả ba alkan nói trên với cùng một tỷ lệ tương tự. Kết quả là hàng loạt ong đực bị quyến rũ bay đến và cố gắng giao hợp với bạn tình giả mạo của mình: mặc dù nỗ lực này không đem lại thành công cho ong, nhưng nó cho phép cây lan chuyển giao phấn hoa của nó, được gieo rắc sau khi con đực nản chí bay sang các bông hoa khác.
Xem thêm
Một số Alkan
Tham khảo
This article uses material from the Wikipedia Tiếng Việt article Alkan, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Nội dung được phát hành theo CC BY-SA 4.0, ngoại trừ khi có ghi chú khác. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Tiếng Việt (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.











