Nadtlenek Wodoru: Związek chemiczny
Nadtlenek wodoru, H2O2 – nieorganiczny związek chemiczny z grupy nadtlenków, jedna z reaktywnych form tlenu.
Otrzymany został po raz pierwszy przez Louisa Thénarda w 1818 roku w reakcji nadtlenku baru z kwasem azotowym.
| |||||||||||||||||||||||||||
 Próbka 30% perhydrolu | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||
| Wzór sumaryczny | H2O2 | ||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Inne wzory | HO−OH, H−O−O−H | ||||||||||||||||||||||||||
| Masa molowa | 34,01 g/mol | ||||||||||||||||||||||||||
| Wygląd | bezbarwna, syropowata ciecz | ||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||
| Podobne związki | woda, hydrazyna, difluorek tlenu | ||||||||||||||||||||||||||
| Pochodne | |||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||
Budowa cząsteczki
Układ wiązań O−O−H wokół atomów tlenu w cząsteczce H
2O
2 jest nieliniowy (podobnie jak układ H−O−H w wodzie), ponadto atomy H−O−O−H tworzą kąt dwuścienny (w fazie stałej około 90°).
- Budowa cząsteczki nadtlenku wodoru
- w stanie stałym
- w stanie gazowym
Otrzymywanie
Pierwszą i obecnie już tylko historyczną metodą otrzymywania nadtlenku wodoru na skalę przemysłową był proces Thénarda:
- BaO
2 + H
2SO
4 → BaSO
4 + H
2O
2
Obecnie otrzymuje się go najczęściej tzw. metodą antrachinonową przez utlenianie 2-etylo-9,10-antracenodiolu gazowym tlenem przepuszczanym przez roztwór tego związku w mieszaninie odpowiednio dobranych rozpuszczalników. Nadtlenek oddziela się poprzez ekstrakcję z wodą, zaś pozostały w roztworze 2-etyloantrachinon poddaje się regeneracji poprzez redukcję gazowym wodorem do 2-etylo-9,10-antracenodiolu, katalizowaną palladem osadzonym na odpowiednim nośniku lub związkami niklu. W przemysłowych metodach produkcji cykl obu reakcji (utleniania i redukcji) prowadzi się naprzemiennie.

Rozcieńczony roztwór wodny nadtlenku otrzymany w tym procesie zatęża się przez ostrożne odparowywanie wody pod zmniejszonym ciśnieniem, uzyskując w ten sposób roztwór o stężeniu maksymalnie 70%. Dalsze zatężanie prowadzi do wybuchu. Bardziej stężone roztwory oraz całkowicie czysty nadtlenek uzyskuje się prawdopodobnie przez wymrażanie go z wodnego, stężonego roztworu.
W Polsce jedynym producentem nadtlenku wodoru są należące do Grupy Azoty Zakłady Azotowe „Puławy” SA Funkcjonująca od 1995 roku instalacja zapewnia produkcję na poziomie 10 tysięcy ton rocznie. W roku 1997 dobudowano instalację do oczyszczania oraz zatężania nadtlenku wodoru wg technologii szwajcarskiej firmy Sulzer Chemtech, poszerzając tym samym ofertę o nowe stężenia nadtlenku wodoru. Od 2015 roku stabilizowane roztwory wodne nadtlenku wodoru wytwarzane w puławskich zakładach są dopuszczone do sprzedaży na rynkach UE w stężeniach 35%, 49,5%, 50% i 60%, zgodnie z obowiązującymi przepisami. Produkt jest eksportowany na rynki zagraniczne do krajów takich jak Litwa, Łotwa, Słowacja czy Węgry.
Inną, rzadziej stosowaną metodą, jest utlenianie izopropanolu:
- (CH
3)
2CHOH + O
2 → (CH
3)
2C=O + H
2O
2
Reakcja ma przebieg wolnorodnikowy i nie wymaga dodatkowych katalizatorów, gdyż jest katalizowana przez H
2O
2 (do substratu dodaje się niewielką jego ilość aby przyspieszyć fazę początkową). Jej drugim produktem przemysłowym jest aceton. Metoda ta stosowana była w drugiej połowie XX w.; w pierwszej dekadzie XXI w. działały już tylko dwie instalacje w byłym ZSRR. Takiej samej reakcji ulegają inne alkohole, jednak w przypadku alkoholi pierwszorzędowych powstające aldehydy ulegają utlenianiu przez H
2O
2 do kwasów karboksylowych, co wyklucza ich wykorzystanie w tym procesie.
Nadtlenek wodoru można też otrzymywać metodą elektrolityczną z H
2SO
4 lub NH
4HSO
4:
- 2H
2SO
4 → H
2S
2O
8 + H
2↑ - 2NH
4HSO
4 → (NH
4)
2S
2O
8 + H
2↑
W obu przypadkach H
2O
2 uzyskuje się następnie przez hydrolizę:
- S
2O2−
8 + 2H
2O → 2HSO−
4 + H
2O
2
Właściwości
Nadtlenek wodoru w temperaturze pokojowej jest syropowatą, bezbarwną (stężony staje się bladoniebieski) cieczą o temperaturze topnienia −0,44 °C i temperaturze wrzenia około 150 °C. Ma silne właściwości utleniające, wynikające z powstawania w czasie jego rozkładu tlenu atomowego (tak zwany tlen in statu nascendi):
- H
2O
2 → H
2O + O
Czysty nadtlenek wodoru jest nietrwały – ulega egzotermicznemu rozkładowi (często wybuchowemu), na wodę i tlen, pod wpływem ciepła, światła nadfioletowego oraz kontaktu z niektórymi metalami (na przykład manganem) i tlenkami metali.
- 2H
2O
2
(aq) → 2H
2O
(l) + O
2
(g)
Rozkład ten jest katalizowany przez wiele rozdrobnionych substancji, na przykład srebro, platynę i tlenek manganu(IV).
Jej rozkład katalizują też jodki, przy czym H
2O
2 utlenia I−
do I
2, a reakcja H
2O
2 z jodem (lub jodanami) ma charakter reakcji oscylacyjnej:
- 5H
2O
2 + I
2 → 2HIO
3 + 4H
2O - 5H
2O
2 + 2HIO
3 → I
2 + 6H
2O + 5O
2↑
Wydajnym enzymem rozkładającym nadtlenek wodoru jest katalaza.
Ze względu na to, że łatwo reaguje on z wieloma metalami, a także ulega rozkładowi w kontakcie ze szkłem, należy go przechowywać w ciśnieniowych butelkach z grubościennego polietylenu lub aluminium i nie wystawiać na działanie światła dziennego oraz źródeł ciepła. Jego kompleks z węglanem sodu typu hydratu (Na
2CO
3·1,5H
2O
2, tak zwany nadwęglan sodu) jest natomiast względnie trwały i bezpieczny w użyciu.
Nadtlenek wodoru wykazuje słabe właściwości kwasowe. W roztworach wodnych ulega on dysocjacji według równania:
Właściwości utleniająco/redukujące
Wobec reduktorów nadtlenek wodoru zachowuje się jak utleniacz (O-I
→ O-II
), na przykład:
Wobec utleniaczy wykazuje właściwości redukujące (O-I
→ O0
), między innymi w reakcji z nadmanganianem potasu w środowisku kwaśnym:
- 2KMnO
4 + 5H
2O
2 + 3H
2SO
4 → 2MnSO
4 + 5O
2 + K
2SO
4 + 8H
2O
lub z solami srebra(I) w środowisku zasadowym:
- 2AgNO
3 + H
2O
2 + 2KOH → 2Ag + O
2 + 2H
2O + 2KNO
3
Właściwości biologiczne
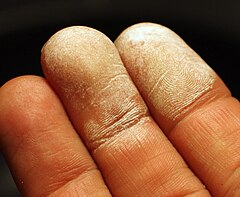

Jest to substancja żrąca wobec żywych tkanek. Przy kontakcie ze skórą pojawiają się białe martwicze plamy.
Zastosowanie
Czysty nadtlenek wodoru jest niedostępny handlowo, gdyż prawo większości krajów Europy oraz Stanów Zjednoczonych zabrania jego sprzedaży ze względów bezpieczeństwa. W handlu dostępne są maksymalnie 70% roztwory tego związku, i to po spełnieniu specjalnych warunków (przepisy RID i ADR)[potrzebny przypis]. Najczęstszą postacią handlową jest tak zwany perhydrol, czyli jego 30% roztwór wodny, oraz roztwór 3%, nazywany wodą utlenioną.
Woda utleniona (roztwór 3%)
Jest stosowana do odkażania powierzchownych ran, a po rozcieńczeniu wodą, w stosunku około 1:50, do płukania jamy ustnej w stanach zapalnych. Takie roztwory do bezpośredniego użycia dostępne są w aptekach. Woda utleniona jest też składnikiem preparatów złożonych o podobnym przeznaczeniu, na przykład płukanki Parmy.
Woda utleniona rozkłada się przy kontakcie z krwią i peroksydazami, gwałtownie wydzielając tlen i spieniając okolice zranienia. Powszechnie uważa się, że pozwala to na wyczyszczenie i oddzielenie zabrudzeń oraz bakterii z zakamarków tkanek otaczających zranienie, jednak pogląd ten nie ma większego oparcia w faktach, a samo stosowanie wody utlenionej do odkażania ran ma wady. Woda utleniona ma naturalne właściwości hemolityczne, a ponadto może prowadzić do oddzielania się świeżego nabłonka od ziarniny w miejscu zranienia. Właściwości bakteriobójcze wody utlenionej przy opatrywaniu zranień są słabe i krótkotrwałe, a stosowanie jej nie zmniejsza ryzyka zakażenia, a w pewnych przypadkach może opóźnić gojenie się zranień. Według innego opracowania woda utleniona nie ma znaczącego negatywnego wpływu na gojenie się ran – ale także nie obniża ryzyka zakażenia (głównie z powodu obniżonej aktywności w rozcieńczonych roztworach, osłabianej dodatkowo przez katalazy bakteryjne i z otaczających zranienie tkanek). Z tego powodu woda utleniona może co najwyżej wspomagać opatrywanie zranień obficie pokrytych zaschniętą lub zakrzepłą krwią, w czym pomagać mają jej właściwości hemolityczne.
Roztwory wody utlenionej są zalecane w pseudonaukowej metodzie leczącej jakoby niektóre rodzaje nowotworów, a także inne schorzenia, poprzez wywoływanie tak zwanej hiperoksygenacji. W oparciu o badania naukowe, American Cancer Society całkowicie neguje skuteczność takich terapii i odradza je jako alternatywę dla ustalonych medycznych procedur leczenia nowotworów.
Wybielacz (roztwory 3–15%)
Roztwory 3–15% są zwykle stosowane jako wybielacz na bazie aktywnego tlenu w środkach chemii gospodarczej, roztwory 3–12% są stosowane we fryzjerstwie do farbowania i rozjaśniania włosów.
Perhydrol (roztwory 30–35%)
Perhydrol stosuje się jako silny środek utleniający w przemyśle chemicznym, na przykład do produkcji barwników organicznych, a także inicjatorów nadtlenkowych (w tym heksametylenotriperoksydiaminy oraz trimerycznego i tetramerycznego nadtlenku acetonu).
Utleniacz paliwa (roztwory 85–98%)
Nadtlenek wodoru o stężeniu 85–98% stosowany jest jako utleniacz paliwa rakietowego oraz paliwa do okrętów podwodnych. Roztwór 60% był używany już podczas II wojny światowej przez Niemców w rakietach V2 i samolotach Messerschmitt Me 163 (pod kryptonimem T-Stoff i innymi) oraz okrętach podwodnych i torpedach (pod kryptonimem Ingolin, Aurol i innymi). Nadtlenek wodoru był wykorzystywany w silnikach rakietowych na satelitach serii Syncom. Obecnie jest stosowany jako utleniacz na rakietach suborbitalnych ILR-33 BURSZTYN oraz Nucleus.
Wyciek wysoko skoncentrowanego do wartości między 85% a 98% nadtlenku wodoru (noszącego w takim stężeniu angielską nazwę high test peroxide – HTP), używanego jako utleniacz dla paliwa w przenoszonych przez okręt podwodny „Kursk” ciężkich torpedach przeciwokrętowych 65-76 Kit był w 2000 roku przyczyną wybuchu na tym okręcie, który następnie zatonął wraz z całą 118-osobową załogą.
Zobacz też
Przypisy
This article uses material from the Wikipedia Polski article Nadtlenek wodoru, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Treść udostępniana na licencji CC BY-SA 4.0, jeśli nie podano inaczej. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Polski (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.




