इलेक्ट्रॉन विन्यास
परमाणु भौतिकी एवं प्रमात्रा रासायनिकी में, किसी अणु, परमाणु या किसी अन्य भौतिक संरचना में इलेक्ट्रॉनों की व्यवस्था को वैद्युतिक विन्यास कहते हैं। वैद्युतिक विन्यास में इलेक्ट्रॉन को किसी परमाणु या आणविक तन्त्र में वितरित करने का तरीका दिया गया होता है।

प्रमात्रा यान्त्रिकी के नियमानुसार, केवल एक इलेक्ट्रॉन वाले तन्त्र हेतु, प्रत्येक वैद्युतिक विन्यास के साथ ऊर्जा का एक स्तर जुड़ा होता है और कुछ स्थितियों में, इलेक्ट्रॉन ऊर्जा की एक मात्रा के उत्सर्जन या अवशोषण द्वारा, एक फोटॉन के रूप में, एक विन्यास से दूसरे में जाने में सक्षम होते हैं।
तत्त्वों का आवर्ती वर्गीकरण की संरचना को समझने में विभिन्न परमाण्वों के वैद्युतिक विन्यास का ज्ञान उपयोगी है। यह परमाण्वों को एक साथ रखने वाले रासायनिक बन्धनों का वर्णन करने हेतु भी उपयोगी है। बल्क सामग्रियों में, यही विचार लेज़रों और अर्धचालकों के विशिष्ट गुणों की व्याख्या करने में सहायता करता है।
परमाण्वों में निरूपण
परमाण्वों के वैद्युतिक विन्यास को दो तरीकों से निरूपित किया जा सकता है:
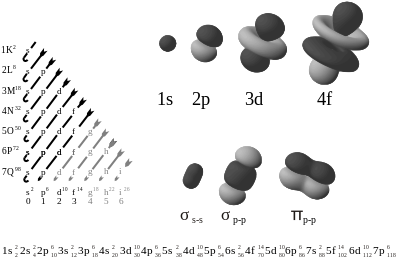
- sαpβdγ संकेतन: इसमें उपकोश को संगत चिह्नाक्षर से निरूपित किया जाता है और उपकोश में उपस्थित इलेक्ट्रॉनों की संख्या को मूर्धांक α,β,γ इत्यादि के रूप में दर्शाते हैं। विभेदन उसके संगत उपकोश के सामने मुख्य प्रमात्रा संख्या को लिखकर किया जाता है।
- कक्षक आरेखण: इसमें उपकोश के प्रत्येक कक्षक को एक सन्दूक द्वारा दर्शाया जाता है और इलेक्ट्रॉन के धन-चक्रण को (↑) ऊर्ध्वगामी तीर और ऋण चक्रण को (↓) निम्नगामी तीर से दर्शाया जा सकता है। पहले संकेतन को तुलना में दूसरे संकेतन का लाभ यह है कि इससे चारों प्रमात्रा संख्याओं को दर्शाया जा सकता है।


हाइड्रोजन परमाणु में केवल एक ही इलेक्ट्रॉन होता है, जो न्यूनतम ऊर्जा वाले कक्षक में जाता है, जिसे 1s¹ कक्षक कहते हैं। इसका अर्थ यह है कि इसके 1s कक्षक में एक इलेक्ट्रॉन होता है। हीलियम का दूसरा इलेक्ट्रॉन भी 1s कक्षक में जा सकता है। अतः हीलियम का वैद्युतिक विन्यास 1s² होता है। दो इलेक्ट्रॉन एक-दूसरे से विपरीत चक्रण में होते हैं जैसा कि कक्षक आरेख से देखा जा सकता है।
परमाण्वों में कक्षकों की भर्ती
कक्षक निर्माण नियम

कक्षक में उपस्थित इलेक्ट्रानों की ऊर्जा n तथा ℓ के मानों पर निर्भर करती है। गणितीय रूप से और पर कक्षकों की n ऊर्जाओं की नैर्भर्य काफी जटिल होती है, लेकिन n तथा ℓ के संयुक्त मान हेतु एक सरल नियम है:
- (n+ℓ) का मान जितना निम्न होगा कक्षक को ऊर्जा भी उतनी ही कम होगी।
- यदि दो कक्षकों हेतु (n+ℓ) का मान समान हो, तो निम्न n के मान वाले कक्षक की ऊर्जा निम्न होगी।
किसी कक्षक की ऊर्जा प्रभावी नाभिक आवेश पर निर्भर करती है और विभिन्न प्रकार के कक्षकों पर इसका परिमाण भिन्न होता है। इसलिए ऐसा कोई भी एक क्रम नहीं है जो सभी परमाण्वों हेतु सही हो तथापि कक्षकों को ऊर्जा का निम्नलिखित वृद्धि क्रम, अर्थात् उनको भरे जाने का क्रम अत्यन्त उपयोगी है: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s, 5f, 6d, 7p...
पाउली अपवर्जन नियम

पाउली अपवर्जन नियमानुसार:
- “केवल दो इलेक्ट्रॉन एक कक्षक में रह सकते हैं। इन इलेक्ट्रॉनों के चक्रण विपरीत होने चाहिए।"
इसका अर्थ है कि दो इलेक्ट्रॉनों की तीन प्रमात्रा संख्याएँ, n, ℓ तथा m एक समान हो सकती हैं, किन्तु उनकी चक्रण प्रमात्रा संख्या भिन्न होनी चाहिए। किसी कक्षक के इलेक्ट्रॉनों में पाउली अपवर्जन नियम द्वारा लगाया गया नियन्त्रण किसी उपकोश में उपस्थित इलेक्ट्रॉनों की क्षमता की गणना करने में सहायक होता है। उदाहरणार्थ, 1s में एक कक्षक होता है। इस प्रकार 1s उपकोश में इलेक्ट्रॉनों की अधिकतम संख्या दो हो सकती है। p तथा d उपकोशों में अधिकतम संख्या क्रमश: 6 तथा 10 हो सकती है, इत्यादि।
हुण्ड का अधिकतम बाहुल्य का नियम
यह नियम एक ही उपकोश से सम्बन्धित कक्षकों को भरने हेतु लागू किया जाता है। इन कक्षकों की ऊर्जा बराबर होती है। उन्हें 'समभ्रंश कक्षक' कहते हैं। यह नियम इस प्रकार है:
- एक ही उपकोश के कक्षकों में इलेक्ट्रॉनों का युग्मन तब तक नहीं होता है, जब तक उस उप-कोश के सभी कक्षकों में एक-एक इलेक्ट्रॉन न आ जाए।
क्योंकि तीन पाँच d तथा सात f कक्षक होते हैं, अतः p,d, और f कक्षकों में युग्मन क्रमशः चतुर्थ, षष्ठ और अष्टम इलेक्ट्रॉन के भरने पर प्रारम्भ होगा। यह देखा गया है कि आधे भरे और पूरे भरे समभ्रंश कक्षकों का स्थायित्व उनकी सममिति के कारण अधिक होता है
सन्दर्भ
इन्हें भी देखें
बाहरी कड़ियाँ
This article uses material from the Wikipedia हिन्दी article इलेक्ट्रॉन विन्यास, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). उपलब्ध सामग्री CC BY-SA 4.0 के अधीन है जब तक अलग से उल्लेख ना किया गया हो। Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki हिन्दी (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.