Elektrokimika energia elektrikoa eta energia kimikoaren arteko konbertsioa ikertzen duen kimikaren adarra da.

Erreakzio kimikoen bidez elektrizitatea lor daiteke; hori da piletan edo baterietan gertatzen dena. Bestalde, korronte elektriko batek bultza dezake erreakzio kimiko bat; adibidez elektrolisian. Bi kasuetan ematen diren erreakzioek erreakzio elektrokimiko izena hartzen dute. Erreakzio elektrokimiko hauek ioi positiboek negatiboekin duten elkarrekintzan oinarritzen dira: ioi negatiboak ioi positiboak erakarri egiten ditu, korronte elektrikoa sortuz.
XVIII. mende amaieran, ilustrazio garaian, Luigi Galvani anatomista eta mediku italiarrak definitu zuen lehenengoz elektrokimika kontzeptua modu zientifiko batean igelen hanketatik elektrizitatea pasatzen zela ohartu zenean.
Ondorengo ekarpenak Alessandro Volta fisikari italiarrak egin zituen lehen bateria sortu zuenean.
XIX. mende erdialdean Michael Faraday-ek eta John Daniell-ek elektrokimikaren azterketa egin eta zenbait kontzeptu argitu zituzten. Mende amaieran elektrokimikak zenbait alorretan eragin zuen, hala nola, elektrolitoen eroankortasunean eta baterien modelatze matematikoan.
XX. mendetik aurrera elektrokimikak zenbait aurkikuntza ekarri zituen, besteak beste, elektroiaren karga aurkitu zen, Bronsted eta Lowry azido eta baseen teoria modernoa ezarri zen eta medikuntza zein biologian gai ugari ikertu ahal izan ziren, esaterako, elektroforesia.
Erredox erreakzioak espezie kimikoen arteko elektroien transferentzian oinarritzen diren erreakzio kimikoak dira. Espezieetako batek elektroiak galduko ditu, hau da, oxidatu egingo da. Elektroien galera horrek bere oxidazio zenbakia positiboagoa izatea eragingo du. Beste espezieak, ordea, irabazi egingo ditu elektroiak: erreduzitu egingo da. Bere oxidazio zenbakia, beraz, negatiboagoa bihurtuko da.
Espezie bat oxidatzen deneko erreakzioari oxidazio deritzogu eta espeziea erreduzitu egin bada erredukzio.
Honakoa erredox erreakzio baten adibidea da:
Cu2+ + Zn 
Erreakzio totala bi erdierreakziotan bana dezakegu:
Cu2+ + 2e- 
Zn 
Kupre katioiak bi elektroi irabazi ditu kupre metalikora pasatzeko eta alderantziz, zink metalikoak bi elektroi galdu ditu. Zinkaren oxidazioak kuprearen erredukzioa ahalbideratu duenez, zinkak erreduktore moduan jokatu duela esaten dugu. Bestalde, kuprea oxidatzaile gisa aritu da, zink metalikoaren oxidazioa eragin duelako.
Pila elektrokimikoa erreakzio kimikoetatik abiatuz energia elektrikoa lortzea ahalbidetzen duen gailua da.

Zink metaliko zati bat jartzen badugu CuSO4 disoluzio batean bi erreakzio gertatuko dira: batetik, zink metalikoa disolbatu egingo da Zn2+ katioi moduan, eta bestetik, disoluzioan zeuden Cu2+ ioiak kupre metalikora erreduzituko dira elektrodoan. Erredox errakzio hau bat batekoa izango da:
Cu2+ + Zn 
Denbora pasa ahala, disoluzioaren urdin kolorea argituz joango da. Honen antzera, kupre metalikozko alanbre bat jartzen badugu AgNO3 disoluzio batean, zilar metalikoa sortuko da honen gainean eta disoluzioa urdinduz joango da Cu2+ ioi hidratatuen presentziaren eraginez.
Demagun oraingoan zink eta kupre metalikoa jartzen ditugula konpartimentu ezberdinetan. Konpartimentu batean ZnSO4 disoluzioa egongo da eta bestean CuSO4, irudian ikus daitekeen moduan. Disoluzioak gatz zubi batez lotzen dira. Gatz zubia disoluzio elektrolitiko geldoa duen hodi bat da, KCl -zkoa adibidez. Hodiaren ertzak agar-agarra bezalako material likatsu batekin estaltzen dira, disoluzioak nahas ez daitezen. Elektrodoak alanbre metaliko batez lotzen badira, elektroiak zinkezko elektrodotik kuprezko elektrodora pasako dira. Izan ere, zinka oxidatu egingo da ezkerreko konpartimentuan eta Zn2+ ioiak sortuko dira, elektroiekin batera. Elektroi horiek eragiten duten korrontearen bidez, Cu2+ ioiak kupre metalikora erreduzituko dira kuprezko elektrodoan. Oxidatu den elektrodoari, kasu honetan zinkezkoari, anodo deitzen diogu. Erreduzitu denari, berriz, katodoa. Gatz zubiaren helburua zirkuitu elektrikoa osatzea da, elektroien mugimendua ahalbidetzen duelarik.
Deskribatutako pila Daniell zelula bezala ezagutzen da eta zelula galbanikoaren edo boltaikoren adibide esanguratsuena da.
Zelula galbanikoen funtzionamendua erredox erreakzioetan oinarritzen da. Zink eta kuprezko kasuan, erredox erreakzioak bi erdierreakzio gisa adieraz daitezke:
Anodoa: Zn(s) 
Katodoa: Cu2+(aq) + 2e- 
Danielen pilaren diagrama honako hau da:
Zn(s) | ZnSO4(1.00M) || CuSO4(1.00M) | Cu(s)
Pilak transferentziazkoak eta transferentziarik gabekoak izan daitezke.
Transferentziazko piletan pareta porotsu edo gatz-zubia dago bi disoluzioen artean.
Transferentziarik gabeko piletan, aldiz, elektrolito amankomuna dute eta pilaerdien artean ez dago banaketarik.
Transferentziazko pilen artean, aipagarria da kontzentraziozko pila.
Mota honetako pila baten elektrodoak metal berdinarekin osatutakoak dira eta bi disoluzioetan dauden katioiak berdinak izango dira. Bien arteko diferentzia disoluzioen kontzentrazioa da.
Esaterako, ZnSO4 -ren kontzentraziozko pila aztertuko dugu.
Zn(s) | ZnSO4(0.10M) || ZnSO4(1.0M) | Zn(s)
Katodoan zink metalikoa sortuko da, disoluzioko katioiak kontsumituz. Anodoan, ordea, zink metalikoa oxidatzen denez katioiak areagotzen dira. Bi disoluzio horiek kontzentrazioak berdintzeko joera izango dutenez, katodoan izan beharko dugu katioien kontzentrazio handiena eta anodoan txikiena. Horrela, erredox erreakzioak aurrera doazen heinean katodoko kontzentrazioa txikitu eta anodokoa handituko da, bi kontzentrazioak berdindu arte. Egoera horretara heltzean, pilak ez du lanik egingo.
Honakoak dira erdierreakzioak:
Anodoa: Zn(s) 
Katodoa: Zn2+(1.0M) + 2e- 
Osoa: Zn2+(1.0M) 
Difusiozko pilak gai kimikoaren zabalkuntzak katioien eta anioien arteko elkarrekintza ahalbidetzen duenean gertatzen da, anodoaren eta katodoaren arteko orekara heldu arte. Gai kimokoaren kontzentrazioa faktore garrantzitsua da erreakzioan, zabalkuntza eragingo den ala ez. Oraindik asko aplikatzen ez diren pilak dira, eta esperimentazio fasean daude ibilgailu elektrikoetan, baino etorkizun handia dute difusio prozesuak gai kimikoaren pisua arindu egiten duelako.
Pila baten potentziala, Epila, bi pilaerdien artean sortzen den potentzial diferentzia da. Potentzial diferentzia hori baldintza estandarretan neurtu denean, potentzial diferentzia estandar deritzogu: E0. Elektrodo bakoitzaren erredukzio potentziala izango bagenu, katodoaren E0 eta anodoaren E0, alegia, bien arteko diferentzia kalkulatuz pila osoaren potentzial estandarra kalkulatuko genuke. Baina pilaerdi isolatu bakoitzaren potentziala ez denez neurgarria, beti beharko ditugu bi elektrodo eta beraien arteko potentzial diferentzia kalkulatuko dugu.

Arazoa saihesteko, hidrogenoaren elektrodoa erreferentziazko elektrodotzat hartu da eta bere potentzial estandarra 0 izatea erabaki da hitzarmenez. Horrela, edozein pilaerdiren eta hidrogenozko pilaerdiaren artean sortzen den potentzial diferentzia izango da jakin nahi dugun elektrodo isolatu horren erredukzio potentziala.
H+(aq) + e- 

Hidrogenozko elektrodoan platinozko xafla bat sartzen da disoluzio azido batean eta elektrodoaren gainazalean hidrogeno gaseosoaren korronte bat pasarazten da (1bar). Platinoaren gainazalak gasa adsorbatuko du.
Elektrodo baten potentziala jakiteko, beraz, hidrogenozko elektrodoaz baliatuko gara. Gure muntaia neurtu nahi dugun elektrodoaren eta hidrogenoaren arteko pila bat izango da. Pila horretan sortzen den potentzial diferentzia elektrodo ezezagunaren potentzialaren modulua izango da. Hidrogenozko elektrodoak anodo gisa funtzionatzen badu, beste elektrodoan eman da erredukzioa; beraz, hidrogenoa baino erredukzio-ahalmen handiagoa du eta ondorioz, bere erredukzio-potentziala positiboa izango da. Hidrogenoaren elektrodoa katodo gisa aritu bada, ordea, neurtu nahi dugun elektrodoaren potentzialaren balioa negatiboa izango da.
Honako taula honetan zenbait elektrodoren erredukzio potentzial estandarrak (E0) ageri dira:
| erreakzioerdi | E° (V) | ||
|---|---|---|---|
| Oxidant | ⇌ | Reductant | |
| Sr+ + e− | ⇌ | Sr | −4.101 |
| Ca+ + e− | ⇌ | Ca | −3.8 |
| Pr3+ + e− | ⇌ | Pr2+ | −3.1 |
| 3 N2(g) + 2ḥ + 2e− | ⇌ | 2HN3(aq) | −3.09 |
| Li+ + e− | ⇌ | Li(s) | −3.0401 |
| N2(g) + 4 H2O + 2e− | ⇌ | 2 NH2OH(aq) + 2 OH− | −3.04 |
| Cs+ + e− | ⇌ | Cs(s) | −3.026 |
| Ca(OH)2 + 2e− | ⇌ | Ca + 2 OH− | −3.02 |
| Er3+ + e− | ⇌ | Er2+ | −3.0 |
| Ba(OH)2 + 2e− | ⇌ | Ba + 2 OH− | −2.99 |
| Rb+ + e− | ⇌ | Rb(s) | −2.98 |
| K+ + e− | ⇌ | K(s) | −2.931 |
| Ba2+ + 2e− | ⇌ | Ba(s) | −2.912 |
| La(OH)3(s) + 3e− | ⇌ | La(s) + 3 OH− | −2.90 |
| Fr+ + e− | ⇌ | Fr | −2.9 |
| Sr2+ + 2e− | ⇌ | Sr(s) | −2.899 |
| Sr(OH)2 + 2e− | ⇌ | Sr + 2 OH− | −2.88 |
| Ca2+ + 2e− | ⇌ | Ca(s) | −2.868 |
| Li+ + C6(s) + e− | ⇌ | LiC6(s) | −2.84 |
| Eu2+ + 2e− | ⇌ | Eu(s) | −2.812 |
| Ra2+ + 2e− | ⇌ | Ra(s) | −2.8 |
| Ho3+ + e− | ⇌ | Ho2+ | −2.8 |
| Bk3+ + e− | ⇌ | Bk2+ | −2.8 |
| Yb2+ + 2e− | ⇌ | Yb | −2.76 |
| Na+ + e− | ⇌ | Na(s) | −2.71 |
| Mg+ + e− | ⇌ | Mg | −2.70 |
| Nd3+ + e− | ⇌ | Nd2+ | −2.7 |
| Mg(OH)2 + 2e− | ⇌ | Mg + 2 OH− | −2.690 |
| Sm2+ + 2e− | ⇌ | Sm | −2.68 |
| Be2O32− + 3 H2O + 4e− | ⇌ | 2 Be + 6 OH− | −2.63 |
| Pm3+ + e− | ⇌ | Pm2+ | −2.6 |
| Dy3+ + e− | ⇌ | Dy2+ | −2.6 |
| No2+ + 2e− | ⇌ | No | −2.50 |
| HfO(OH)2 + H2O + 4e− | ⇌ | Hf + 4 OH− | −2.50 |
| Th(OH)4 + 4e− | ⇌ | Th + 4 OH− | −2.48 |
| Md2+ + 2e− | ⇌ | Md | −2.40 |
| Tm2+ + 2e− | ⇌ | Tm | −2.4 |
| La3+ + 3e− | ⇌ | La(s) | −2.379 |
| Y3+ + 3e− | ⇌ | Y(s) | −2.372 |
| Mg2+ + 2e− | ⇌ | Mg(s) | −2.372 |
| ZrO(OH)2(s) + H2O + 4e− | ⇌ | Zr(s) + 4 OH− | −2.36 |
| Pr3+ + 3e− | ⇌ | Pr | −2.353 |
| Ce3+ + 3e− | ⇌ | Ce | −2.336 |
| Er3+ + 3e− | ⇌ | Er | −2.331 |
| Ho3+ + 3e− | ⇌ | Ho | −2.33 |
| H2AlO3− + H2O + 3e− | ⇌ | Al + 4 OH− | −2.33 |
| Nd3+ + 3e− | ⇌ | Nd | −2.323 |
| Tm3+ + 3e− | ⇌ | Tm | −2.319 |
| Al(OH)3(s) + 3e− | ⇌ | Al(s) + 3 OH− | −2.31 |
| Sm3+ + 3e− | ⇌ | Sm | −2.304 |
| Fm2+ + 2e− | ⇌ | Fm | −2.30 |
| Am3+ + e− | ⇌ | Am2+ | −2.3 |
| Dy3+ + 3e− | ⇌ | Dy | −2.295 |
| Lu3+ + 3e− | ⇌ | Lu | −2.28 |
| Tb3+ + 3e− | ⇌ | Tb | −2.28 |
| Gd3+ + 3e− | ⇌ | Gd | −2.279 |
| H2 + 2e− | ⇌ | 2 H− | −2.23 |
| Es2+ + 2e− | ⇌ | Es | −2.23 |
| Pm2+ + 2e− | ⇌ | Pm | −2.2 |
| Tm3+ + e− | ⇌ | Tm2+ | −2.2 |
| Dy2+ + 2e− | ⇌ | Dy | −2.2 |
| Ac3+ + 3e− | ⇌ | Ac | −2.20 |
| Yb3+ + 3e− | ⇌ | Yb | −2.19 |
| Cf2+ + 2e− | ⇌ | Cf | −2.12 |
| Nd2+ + 2e− | ⇌ | Nd | −2.1 |
| Ho2+ + 2e− | ⇌ | Ho | −2.1 |
| Sc3+ + 3e− | ⇌ | Sc(s) | −2.077 |
| AlF63− + 3e− | ⇌ | Al + 6 F− | −2.069 |
| Am3+ + 3e− | ⇌ | Am | −2.048 |
| Cm3+ + 3e− | ⇌ | Cm | −2.04 |
| Pu3+ + 3e− | ⇌ | Pu | −2.031 |
| Pr2+ + 2e− | ⇌ | Pr | −2.0 |
| Er2+ + 2e− | ⇌ | Er | −2.0 |
| Eu3+ + 3e− | ⇌ | Eu | −1.991 |
| Lr3+ + 3e− | ⇌ | Lr | −1.96 |
| Cf3+ + 3e− | ⇌ | Cf | −1.94 |
| Es3+ + 3e− | ⇌ | Es | −1.91 |
| Pa4+ + e− | ⇌ | Pa3+ | −1.9 |
| Am2+ + 2e− | ⇌ | Am | −1.9 |
| Th4+ + 4e− | ⇌ | Th | −1.899 |
| Fm3+ + 3e− | ⇌ | Fm | −1.89 |
| Np3+ + 3e− | ⇌ | Np | −1.856 |
| Be2+ + 2e− | ⇌ | Be | −1.847 |
| H2PO2− + e− | ⇌ | P + 2 OH− | −1.82 |
| U3+ + 3e− | ⇌ | U | −1.798 |
| Sr2+ + 2e− | ⇌ | Sr/Hg | −1.793 |
| H2BO3− + H2O + 3e− | ⇌ | B + 4 OH− | −1.79 |
| ThO2 + 4H+ + 4e− | ⇌ | Th + 2 H2O | −1.789 |
| HfO2+ + 2 H+ + 4e− | ⇌ | Hf + H2O | −1.724 |
| HPO32− + 2 H2O + 3e− | ⇌ | P + 5 OH− | −1.71 |
| SiO32− + H2O + 4e− | ⇌ | Si + 6 OH− | −1.697 |
| Al3+ + 3e− | ⇌ | Al(s) | −1.662 |
| Ti2+ + 2e− | ⇌ | Ti(s) | −1.63 |
| ZrO2(s) + 4ḥ + 4e− | ⇌ | Zr(s) + 2 H2O | −1.553 |
| Zr4+ + 4e− | ⇌ | Zr(s) | −1.45 |
| Ti3+ + 3e− | ⇌ | Ti(s) | −1.37 |
| TiO(s) + 2ḥ + 2e− | ⇌ | Ti(s) + H2O | −1.31 |
| Ti2O3(s) + 2ḥ + 2e− | ⇌ | 2 TiO(s) + H2O | −1.23 |
| Zn(OH)42− + 2e− | ⇌ | Zn(s) + 4 OH− | −1.199 |
| Mn2+ + 2e− | ⇌ | Mn(s) | −1.185 |
| Fe(CN)64− + 6ḥ + 2 e− | ⇌ | Fe(s) + 6HCN(aq) | −1.16 |
| Te(s) + 2e− | ⇌ | Te2− | −1.143 |
| V2+ + 2e− | ⇌ | V(s) | −1.13 |
| Nb3+ + 3e− | ⇌ | Nb(s) | −1.099 |
| Sn(s) + 4ḥ + 4e− | ⇌ | SnH4(g) | −1.07 |
| SiO2(s) + 4ḥ + 4e− | ⇌ | Si(s) + 2 H2O | −0.91 |
| B(OH)3(aq) + 3ḥ + 3e− | ⇌ | B(s) + 3 H2O | −0.89 |
| Fe(OH)2(s) + 2e− | ⇌ | Fe(s) + 2 OH− | −0.89 |
| Fe2O3(s) + 3 H2O + 2e− | ⇌ | 2Fe(OH)2(s) + 2 OH− | −0.86 |
| TiO2+ + 2ḥ + 4e− | ⇌ | Ti(s) + H2O | −0.86 |
| 2H2O + 2e− | ⇌ | H2(g) + 2 OH− | −0.8277 |
| Bi(s) + 3ḥ + 3e− | ⇌ | BiH3 | −0.8 |
| Zn2+ + 2e− | ⇌ | Zn(Hg) | −0.7628 |
| Zn2+ + 2e− | ⇌ | Zn(s) | −0.7618 |
| Ta2O5(s) + 10ḥ + 10e− | ⇌ | 2 Ta(s) + 5 H2O | −0.75 |
| Cr3+ + 3e− | ⇌ | Cr(s) | −0.74 |
| Ag2S(s) + 2e− | ⇌ | 2Ag(s) + S2−(aq) | −0.69 |
| [Au(CN)Txantiloi:Sub2]− + e− | ⇌ | Au(s) + 2 CN− | −0.60 |
| Ta3+ + 3e− | ⇌ | Ta(s) | −0.6 |
| PbO(s) + H2O + 2e− | ⇌ | Pb(s) + 2 OH− | −0.58 |
| 2 TiO2(s) + 2ḥ + 2e− | ⇌ | Ti2O3(s) + H2O | −0.56 |
| Ga3+ + 3e− | ⇌ | Ga(s) | −0.53 |
| U4+ + e− | ⇌ | U3+ | −0.52 |
| H3PO2(aq) + ḥ + e− | ⇌ | P(white) + 2 H2O | −0.508 |
| H3PO3(aq) + 2ḥ + 2e− | ⇌ | H3PO2(aq) + H2O | −0.499 |
| H3PO3(aq) + 3ḥ + 3e− | ⇌ | P(red) + 3 H2O | −0.454 |
| Fe2+ + 2e− | ⇌ | Fe(s) | −0.44 |
| 2 CO2(g) + 2ḥ + 2e− | ⇌ | HOOCCOOH(aq) | −0.43 |
| Cr3+ + e− | ⇌ | Cr2+ | −0.42 |
| Cd2+ + 2e− | ⇌ | Cd(s) | −0.40 |
| GeO2(s) + 2ḥ + 2e− | ⇌ | GeO(s) + H2O | −0.37 |
| Cu2O(s) + H2O + 2e− | ⇌ | 2 Cu(s) + 2 OH− | −0.360 |
| PbSO4(s) + 2e− | ⇌ | Pb(s) + SO42− | −0.3588 |
| PbSO4(s) + 2e− | ⇌ | Pb(Hg) + SO42− | −0.3505 |
| Eu3+ + e− | ⇌ | Eu2+ | −0.35 |
| In3+ + 3e− | ⇌ | In(s) | −0.34 |
| Tl+ + e− | ⇌ | Tl(s) | −0.34 |
| Ge(s) + 4ḥ + 4e− | ⇌ | GeH4(g) | −0.29 |
| Co2+ + 2e− | ⇌ | Co(s) | −0.28 |
| H3PO4(aq) + 2ḥ + 2e− | ⇌ | H3PO3(aq) + H2O | −0.276 |
| V3+ + e− | ⇌ | V2+ | −0.26 |
| Ni2+ + 2e− | ⇌ | Ni(s) | −0.25 |
| As(s) + 3ḥ + 3e− | ⇌ | AsH3(g) | −0.23 |
| AgI(s) + e− | ⇌ | Ag(s) + I− | −0.15224 |
| MoO2(s) + 4ḥ + 4e− | ⇌ | Mo(s) + 2 H2O | −0.15 |
| Si(s) + 4ḥ + 4e− | ⇌ | SiH4(g) | −0.14 |
| Sn2+ + 2e− | ⇌ | Sn(s) | −0.13 |
| O2(g) + ḥ + e− | ⇌ | HO2•(aq) | −0.13 |
| Pb2+ + 2e− | ⇌ | Pb(s) | −0.126 |
| WO2(s) + 4ḥ + 4e− | ⇌ | W(s) + 2 H2O | −0.12 |
| P(red) + 3ḥ + 3e− | ⇌ | PH3(g) | −0.111 |
| CO2(g) + 2ḥ + 2e− | ⇌ | HCOOH(aq) | −0.11 |
| Se(s) + 2ḥ + 2e− | ⇌ | H2Se(g) | −0.11 |
| CO2(g) + 2ḥ + 2e− | ⇌ | CO(g) + H2O | −0.11 |
| SnO(s) + 2ḥ + 2e− | ⇌ | Sn(s) + H2O | −0.10 |
| SnO2(s) + 4ḥ + 4e− | ⇌ | SnO(s) + 2 H2O | −0.09 |
| WO3(aq) + 6ḥ + 6e− | ⇌ | W(s) + 3 H2O | −0.09 |
| P(white) + 3ḥ + 3e− | ⇌ | PH3(g) | −0.063 |
| Fe3+ + 3e− | ⇌ | Fe(s) | −0.04 |
| HCOOH(aq) + 2ḥ + 2e− | ⇌ | HCHO(aq) + H2O | −0.03 |
| 2ḥ + 2e− | ⇌ | H2(g) | 0.0000 |
| AgBr(s) + e− | ⇌ | Ag(s) + Br− | +0.07133 |
| S4O62− + 2e− | ⇌ | 2 S2O32− | +0.08 |
| Fe3O4(s) + 8ḥ + 8e− | ⇌ | 3 Fe(s) + 4 H2O | +0.085 |
| N2(g) + 2 H2O + 6ḥ + 6e− | ⇌ | 2 NH4OH(aq) | +0.092 |
| HgO(s) + H2O + 2e− | ⇌ | Hg(l) + 2 OH− | +0.0977 |
| Cu(NH3)42+ + e− | ⇌ | Cu(NH3)2+ + 2 NH3 | +0.10 |
| Ru(NH3)63+ + e− | ⇌ | Ru(NH3)62+ | +0.10 |
| N2H4(aq) + 4 H2O + 2e− | ⇌ | 2 NH4+ + 4 OH− | +0.11 |
| H2MoO4(aq) + 6ḥ + 6e− | ⇌ | Mo(s) + 4 H2O | +0.11 |
| Ge4+ + 4e− | ⇌ | Ge(s) | +0.12 |
| C(s) + 4ḥ + 4e− | ⇌ | CH4(g) | +0.13 |
| HCHO(aq) + 2ḥ + 2e− | ⇌ | CH3OH(aq) | +0.13 |
| S(s) + 2ḥ + 2e− | ⇌ | H2S(g) | +0.14 |
| Sn4+ + 2e− | ⇌ | Sn2+ | +0.15 |
| Cu2+ + e− | ⇌ | Cu+ | +0.159 |
| HSO4− + 3ḥ + 2e− | ⇌ | SO2(aq) + 2 H2O | +0.16 |
| UO22+ + e− | ⇌ | UO2+ | +0.163 |
| SO42− + 4ḥ + 2e− | ⇌ | SO2(aq) + 2 H2O | +0.17 |
| TiO2+ + 2ḥ + e− | ⇌ | Ti3+ + H2O | +0.19 |
| SbO+ + 2ḥ + 3e− | ⇌ | Sb(s) + H2O | +0.20 |
| AgCl(s) + e− | ⇌ | Ag(s) + Cl− | +0.22233 |
| H3AsO3(aq) + 3ḥ + 3e− | ⇌ | As(s) + 3 H2O | +0.24 |
| GeO(s) + 2ḥ + 2e− | ⇌ | Ge(s) + H2O | +0.26 |
| UO2+ + 4ḥ + e− | ⇌ | U4+ + 2 H2O | +0.273 |
| Re3+ + 3e− | ⇌ | Re(s) | +0.300 |
| Bi3+ + 3e− | ⇌ | Bi(s) | +0.308 |
| Cu2+ + 2e− | ⇌ | Cu(s) | +0.337 |
| VO2+ + 2ḥ + e− | ⇌ | V3+ + H2O | +0.34 |
| [Fe(CN)6]3− + e− | ⇌ | [Fe(CN)6]4− | +0.36 |
| Fc+ + e− | ⇌ | Fc(s) | +0.4 |
| O2(g) + 2 H2O + 4e− | ⇌ | 4 OH−(aq) | +0.401 |
| H2MoO4 + 6ḥ + 3e− | ⇌ | Mo3+ + 2 H2O | +0.43 |
| CH3OH(aq) + 2ḥ + 2e− | ⇌ | CH4(g) + H2O | +0.50 |
| SO2(aq) + 4ḥ + 4e− | ⇌ | S(s) + 2 H2O | +0.50 |
| Cu+ + e− | ⇌ | Cu(s) | +0.520 |
| CO(g) + 2ḥ + 2e− | ⇌ | C(s) + H2O | +0.52 |
| I3− + 2e− | ⇌ | 3 I− | +0.53 |
| I2(s) + 2e− | ⇌ | 2 I− | +0.54 |
| [AuI4]− + 3e− | ⇌ | Au(s) + 4 I− | +0.56 |
| H3AsO4(aq) + 2ḥ + 2e− | ⇌ | H3AsO3(aq) + H2O | +0.56 |
| [AuITxantiloi:Sub2]− + e− | ⇌ | Au(s) + 2 I− | +0.58 |
| MnO4− + 2 H2O + 3e− | ⇌ | MnO2(s) + 4 OH− | 1.692 |
| S2O32 − + 6ḥ + 4e− | ⇌ | 2 S(s) + 3 H2O | +0.60 |
| H2MoO4(aq) + 2ḥ + 2e− | ⇌ | MoO2(s) + 2 H2O | +0.65 |
| 2Fe2O3(s) + 2ḥ + 2e− | ⇌ | 2 Fe3O4(s) + H2O | +0.66 |
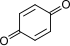 + 2ḥ + 2e− + 2ḥ + 2e− | ⇌ |  | +0.6992 |
| O2(g) + 2ḥ + 2e− | ⇌ | H2O2(aq) | +0.70 |
| Tl3+ + 3e− | ⇌ | Tl(s) | +0.72 |
| PtCl62− + 2e− | ⇌ | PtCl42− + 2 Cl− | +0.726 |
| H2SeO3(aq) + 4ḥ + 4e− | ⇌ | Se(s) + 3 H2O | +0.74 |
| PtCl42− + 2e− | ⇌ | Pt(s) + 4 Cl− | +0.758 |
| Fe3+ + e− | ⇌ | Fe2+ | +0.77 |
| Ag+ + e− | ⇌ | Ag(s) | +0.7996 |
| Hg22+ + 2e− | ⇌ | 2 Hg(l) | +0.80 |
| NO3−(aq) + 2ḥ + e− | ⇌ | NO2(g) + H2O | +0.80 |
| 2FeO42− + 5 H2O + 6e− | ⇌ | Fe2O3(s) + 10 OH− | +0.81 |
| [AuBr4]− + 3e− | ⇌ | Au(s) + 4 Br− | +0.85 |
| Hg2+ + 2e− | ⇌ | Hg(l) | +0.85 |
| [IrCl6]2− + e− | ⇌ | [IrCl6]3− | +0.87 |
| MnO4− + ḥ + e− | ⇌ | HMnO4− | +0.90 |
| 2 Hg2+ + 2e− | ⇌ | Hg22+ | +0.91 |
| Pd2+ + 2e− | ⇌ | Pd(s) | +0.915 |
| [AuCl4]− + 3e− | ⇌ | Au(s) + 4 Cl− | +0.93 |
| Fe2O3(s) + 6ḥ + 2e− | ⇌ | 2Fe2+ + 3 H2O | +0.94 |
| MnO2(s) + 4ḥ + e− | ⇌ | Mn3+ + 2 H2O | +0.95 |
| NO3−(aq) + 4ḥ + 3e− | ⇌ | NO(g) + 2 H2O(l) | +0.958 |
| [AuBrTxantiloi:Sub2]− + e− | ⇌ | Au(s) + 2 Br− | +0.96 |
| [HXeO6]3− + 2 H2O + 2e− + | ⇌ | [HXeO4]− + 4 OH− | +0.99 |
| [VO2]+(aq) + 2ḥ + e− | ⇌ | [VO]2+(aq) + H2O | +1.0 |
| H6TeO6(aq) + 2ḥ + 2e− | ⇌ | TeO2(s) + 4 H2O | +1.02 |
| Br2(l) + 2e− | ⇌ | 2 Br− | +1.066 |
| Br2(aq) + 2e− | ⇌ | 2 Br− | +1.0873 |
| Fe3O4(s) + 8ḥ + 2e− | ⇌ | 3Fe2+ + 4 H2O | +1.09 |
| IO3− + 5ḥ + 4e− | ⇌ | HIO(aq) + 2 H2O | +1.13 |
| [AuClTxantiloi:Sub2]− + e− | ⇌ | Au(s) + 2 Cl− | +1.15 |
| HSeO4− + 3ḥ + 2e− | ⇌ | H2SeO3(aq) + H2O | +1.15 |
| Ag2O(s) + 2ḥ + 2e− | ⇌ | 2 Ag(s) + H2O | +1.17 |
| ClO3− + 2ḥ + e− | ⇌ | ClO2(g) + H2O | +1.18 |
| [HXeO6]3− + 5 H2O + 8 e− | ⇌ | Xe(g) + 11 OH− | +1.18 |
| Pt2+ + 2e− | ⇌ | Pt(s) | +1.188 |
| ClO2(g) + ḥ + e− | ⇌ | HClO2(aq) | +1.19 |
| 2 IO3− + 12ḥ + 10e− | ⇌ | I2(s) + 6 H2O | +1.20 |
| ClO4− + 2ḥ + 2e− | ⇌ | ClO3− + H2O | +1.20 |
| O2(g) + 4ḥ + 4e− | ⇌ | 2 H2O | +1.229 |
| MnO2(s) + 4ḥ + 2e− | ⇌ | Mn2+ + 2 H2O | +1.23 |
| [HXeO4]− + 3 H2O + 6 e− | ⇌ | Xe(g) + 7 OH− | +1.24 |
| Tl3+ + 2e− | ⇌ | Tl+ | +1.25 |
| Cr2O72− + 14ḥ + 6e− | ⇌ | 2 Cr3+ + 7 H2O | +1.33 |
| Cl2(g) + 2e− | ⇌ | 2 Cl− | +1.36 |
| CoO2(s) + 4ḥ + e− | ⇌ | Co3+ + 2 H2O | +1.42 |
| 2 NH3OH+ + ḥ + 2e− | ⇌ | N2H5+ + 2 H2O | +1.42 |
| 2 HIO(aq) + 2ḥ + 2e− | ⇌ | I2(s) + 2 H2O | +1.44 |
| BrO3− + 5ḥ + 4e− | ⇌ | HBrO(aq) + 2 H2O | +1.45 |
| β-PbO2(s) + 4ḥ + 2e− | ⇌ | Pb2+ + 2 H2O | +1.460 |
| α-PbO2(s) + 4ḥ + 2e− | ⇌ | Pb2+ + 2 H2O | +1.468 |
| 2 BrO3− + 12ḥ + 10e− | ⇌ | Br2(l) + 6 H2O | +1.48 |
| 2ClO3− + 12ḥ + 10e− | ⇌ | Cl2(g) + 6 H2O | +1.49 |
| HClO(aq) + ḥ + 2e− | ⇌ | Cl−(aq) + H2O | +1.49 |
| MnO4− + 8ḥ + 5e− | ⇌ | Mn2+ + 4 H2O | +1.51 |
| HO2• + ḥ + e− | ⇌ | H2O2(aq) | +1.51 |
| Au3+ + 3e− | ⇌ | Au(s) | +1.52 |
| NiO2(s) + 4ḥ + 2e− | ⇌ | Ni2+ + 2 OH− | +1.59 |
| Ce4+ + e− | ⇌ | Ce3+ | +1.61 |
| 2 HClO(aq) + 2ḥ + 2e− | ⇌ | Cl2(g) + 2 H2O | +1.63 |
| Ag2O3(s) + 6ḥ + 4e− | ⇌ | 2 Ag+ + 3 H2O | +1.67 |
| HClO2(aq) + 2ḥ + 2e− | ⇌ | HClO(aq) + H2O | +1.67 |
| Pb4+ + 2e− | ⇌ | Pb2+ | +1.69 |
| MnO4− + 4ḥ + 3e− | ⇌ | MnO2(s) + 2 H2O | +1.70 |
| AgO(s) + 2ḥ + e− | ⇌ | Ag+ + H2O | +1.77 |
| H2O2(aq) + 2ḥ + 2e− | ⇌ | 2 H2O | +1.78 |
| Co3+ + e− | ⇌ | Co2+ | +1.82 |
| Au+ + e− | ⇌ | Au(s) | +1.83 |
| BrO4− + 2ḥ + 2e− | ⇌ | BrO3− + H2O | +1.85 |
| Ag2+ + e− | ⇌ | Ag+ | +1.98 |
| S2O82− + 2e− | ⇌ | 2 SO42− | +2.010 |
| O3(g) + 2ḥ + 2e− | ⇌ | O2(g) + H2O | +2.075 |
| HMnO4− + 3ḥ + 2e− | ⇌ | MnO2(s) + 2 H2O | +2.09 |
| XeO3(aq) + 6ḥ + 6 e− | ⇌ | Xe(g) + 3 H2O | +2.12 |
| H4XeO6(aq) + 8ḥ + 8 e− | ⇌ | Xe(g) + 6 H2O | +2.18 |
| FeO42− + 3e− + 8ḥ | ⇌ | Fe3+ + 4 H2O | +2.20 |
| XeF2(aq) + 2ḥ + 2e− | ⇌ | Xe(g) + 2HF(aq) | +2.32 |
| H4XeO6(aq) + 2ḥ + 2e− | ⇌ | XeO3(aq) + 3 H2O | +2.42 |
| F2(g) + 2e− | ⇌ | 2 F− | +2.87 |
| F2(g) + 2ḥ + 2e− | ⇌ | 2 HF(aq) | +3.05 |
| KrF2(aq) + 2e− | ⇌ | Kr(g) + 2 F−(aq) | +3.27 |
Pila baten potentzial diferentzia erreakzioaren energia askearen aldaketarekin zuzenki lotuta dago, ekuazio honek adierazten duen moduan:

n: trukatu den elektroi kopurua.
ΔG0: energia askearen aldaketa baldintza estandarretan.
F: Faraday konstantea (96485 C/mol)
E0: pilaren potentzial estandarra
Erreakzio bat presio eta tenperatura konstantepean ematen denean, energia askearen aldaketaren zeinuak adieraziko digu prozesua berezkoa izango den edo ez. Aldaketa horren balioa negatiboa baldin bada erreakzioa berezkoa izango da. F eta n-ren balioak positiboak direla kontutan hartzen badugu, E0 balioak positiboa izan beharko du ΔG0 negatiboa izan dadin.
Zelula elektrokimiko bati dagokion energia elektrokimikoa ΔrG duen zelula batekin erlazionatu ahal izateko, zelulak itzulkorra izan behar du. Kanpotik potentzial bat gehituko bagenu zelularen potentzial berekoa baina zeinuz kontrakoa, ez litzateke erreakziorik gertatuko. Aldiz, kanpoko potentzialaren balioa infinitesimalki handitu edota txikituko bagenu zelularen berezko edo alderantzizko erreakzioa gertatuko litzateke. Baldintza hauek betetzen dituen edozein zelula itzulkorra dela esaten da.
Nernst-en ekuazioa baldintza estandarretatik (1 M, 1 atm, 25 °C) kanpo dagoen pila baten potentziala kalkulatzeko erabiltzen da. Walther Hermann Nernst kimikari alemaniarrak formulatu zuen 1889. urtean.

E= zehaztutako baldintzetan pilaren potentziala.
E0= Baldintza estandarretan pilaren potentziala.
R= Gasen konstantea.
T= tenperatura Kelvinetan.
n= transferitutako elektroi kantitatea.
F= Faraday konstantea (96485 C/mol)
Ka= Oreka konstante termodinamikoa.
FISICOQUÍMICA para las ciencias químicas y biológicas. Raymond Chang, 2008. ISBN-13: 978-970-10-6652-2 ISBN-10: 970-10-6652-9
Termodinámica química. Juan A. Rodríguez Renuncio, Juan J. Ruiz Sánchez, José S. Urieta Navarro. 1999. ISBN: 84-7738-581-5
 Datuak: Q7877
Datuak: Q7877 Multimedia: Electrochemistry / Q7877
Multimedia: Electrochemistry / Q7877
This article uses material from the Wikipedia Euskara article Elektrokimika, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Eduki guztia CC BY-SA 4.0(r)en babespean dago, ez bada kontrakoa esaten. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Euskara (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.