Schwefelhexafluorid: Chemische Verbindung, ungiftiges, äußerst klimaschädliches Gas
Schwefelhexafluorid ist eine anorganische chemische Verbindung aus den Elementen Schwefel und Fluor mit der Summenformel SF6.
Wie Stickstoff ist SF6 unter Normalbedingungen gasförmig, farb- und geruchlos, ungiftig und äußerst reaktionsträge, hat aber die mehr als fünffache Dichte von Luft. Hauptanwendung ist die elektrische Isolation.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Schwefelhexafluorid | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | SF6 | |||||||||||||||||||||
| Kurzbeschreibung | farb- und geruchloses Gas | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 146,05 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand | gasförmig | |||||||||||||||||||||
| Dichte | 6,63 kg·m−3 (0 °C, 1013 hPa) | |||||||||||||||||||||
| Sublimationspunkt | −63,8 °C | |||||||||||||||||||||
| Dampfdruck |
| |||||||||||||||||||||
| Löslichkeit | sehr schlecht in Wasser (40 mg·l−1 bei 20 °C, 1 bar) | |||||||||||||||||||||
| Dipolmoment | 0 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK | Schweiz: 1000 ml·m−3 bzw. 6000 mg·m−3 | |||||||||||||||||||||
| Treibhauspotential | 24 300 (bezogen auf 100 Jahre) | |||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | −1220 kJ·mol−1 | |||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Schwefelhexafluorid kann direkt aus den Elementen durch Umsetzung elementaren Schwefels (S8) im Fluorgasstrom (F2) synthetisiert werden. Die Reaktion verläuft stark exotherm.
Neben SF6 bilden sich bei diesem Syntheseweg auch weitere Schwefelfluoride, wie Dischwefeldecafluorid (S2F10). Daher wird bei der technischen Herstellung das Gas auf 400 °C erhitzt, wodurch eine Disproportionierung von Dischwefeldecafluorid in Schwefelhexafluorid und Schwefeltetrafluorid (SF4) erfolgt.
Durch Waschen des Gasgemisches in Lauge wird das Schwefeltetrafluorid zerstört, während SF6 durch die Lauge nicht angegriffen wird.
Durch anschließende Druckdestillation wird das reine SF6 abgetrennt.
Eigenschaften
Physikalische Eigenschaften
Der Sublimationspunkt von Schwefelhexafluorid liegt bei einer Temperatur von −63,8 °C, der Tripelpunkt bei −50,8 °C und 2,26 bar. Erst oberhalb dieses Drucks ist auch eine flüssige Phase möglich. Jedoch nur bis zur kritischen Temperatur. (45,6 °C)
Der kritische Punkt liegt bei 45,6 °C, 3,76 MPa und einer kritischen Dichte von 0,735 g·cm−3.
Die Verdampfungsenthalpie von Schwefelhexafluorid beträgt bei einem Druck von 1013 hPa nur 115 kJ/kg (= 16,8 kJ/mol).
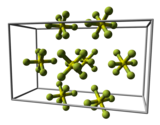
Kristall- und Molekülstruktur
Bei tiefen Temperaturen kristallisiert es im monoklinen Kristallsystem.
Im gasförmigen Zustand ist das SF6-Molekül oktaedrisch (Oh); die S–F-Bindungslänge beträgt 156,1(2) pm.
- Elementarzelle des Schwefelhexafluorids
- Bindungslänge und -winkel beim gasförmigen Schwefelhexafluorid
Chemische Eigenschaften
Aufgrund seiner Struktur ist es praktisch chemisch inert und verhält sich daher ähnlich wie molekularer Stickstoff oder die Edelgase. Es ist nahezu unlöslich in Wasser und nicht entflammbar.
Auf Grund seiner Inertheit sind Reaktionen in der Regel nur unter drastischeren als der Normalbedingung durchführbar. So setzen sich Alkalimetalle mit SF6 in flüssigem Ammoniak zu den korrespondierenden Sulfiden und Fluoriden um:
.
In Gegenwart von Schwefelwasserstoff ist die Komproportionierung zu elementarem Schwefel und Fluorwasserstoff (HF) bekannt:
.
SF6 ist isoelektronisch zu den Anionen Hexafluorophosphat (PF6−), Hexafluorosilicat (SiF62−) und Hexafluoroaluminat (AlF63−).
Verwendung

Schwefelhexafluorid (SF6) wird als Isoliergas in der Mittel- und Hochspannungstechnik eingesetzt, beispielsweise in gasisolierten Schaltanlagen (GIS) mit Hochspannungsschaltern und bei gasisolierten Rohrleitern (GIL) in komplett gekapselten Anlagen mit Betriebsspannungen von 6 kV bis 800 kV. Gegenüber Freiluftschaltanlagen wird deutlich Platz eingespart und die Einflüsse von Witterung und Vögeln oder Nagetieren werden vermieden. SF6 dient dabei auch als Löschgas, um den Schaltlichtbogen in Leistungsschaltern zu unterbrechen.
Die Durchschlagsfestigkeit ist bei Normaldruck fast dreimal so hoch wie in Luft oder Stickstoff. Diese Eigenschaften sowie die geringen dielektrischen Verluste prädestinieren es zur Verwendung als Isoliergas in Koaxialkabeln und gasisolierten Hochfrequenz-Leistungskondensatoren, die damit kleiner gebaut werden können. Als Isolationsgas in elektrischen Schaltanlagen wird es unter einem Druck von 5 bar bis 10 bar gehalten, um die nötige hohe Isolationsfähigkeit sicherzustellen. Je höher der Gasdruck, desto kürzer ist gemäß dem Paschen-Gesetz die mittlere Weglänge der freien Elektronen im Gas. Elektronen können nicht so stark beschleunigt werden wie bei Normaldruck, denn sie stoßen früher mit den SF6-Molekülen zusammen.
In Schaltanlagen mit dem prinzipiell ungiftigen SF6-Gas entstehen im Laufe des Betriebes durch die Lichtbögen in Kombination mit Verunreinigungen wie einem geringen Wasseranteil neben dem ungiftigen Tetrafluormethan giftige Fluorid-Verbindungen wie Fluorwasserstoff und Thionylfluorid sowie das hochgiftige Dischwefeldecafluorid (S2F10). Aus diesen Gründen müssen in gasdichten SF6-Schaltanlagen vor Wartungsarbeiten Sicherheitsrichtlinien zur Entlüftung beachtet werden. SF6 muss laut EU-Verordnung 517/2014 und laut der nationalen Chemikalien-Klimaschutzverordnung von zertifiziertem Personal wiedergewonnen werden, um dessen Recycling, Aufarbeitung oder Zerstörung sicherzustellen. SF6 muss gemäß den Vorschriften der DIN EN 60480 behandelt werden. Außerdem gilt die freiwillige Selbstverpflichtung der Hersteller und Betreiber von elektrischen Betriebsmitteln > 1000 Volt.
Es wird als Isoliergas für Routinetests (Prüfung) mikroelektronischer Schaltkreise im Rahmen der Qualitätssicherung verwendet.
Bei der Herstellung von Halbleiter-Bauteilen dient es als Ätzgas: SF6 ist das reaktive Gas beim reaktiven Ionenätzen (RIE) und DRIE (von engl. Deep Reactive Ion Etching). Außerdem wird es auf ähnliche Weise zum Reinigungsätzen unter anderem in der Display-Fertigung eingesetzt.
SF6 verwendet man auch als Schutzgas bei der Gewinnung von Magnesium. Das SF6, spezifisch schwerer als Luft, verhindert hier den Kontakt der heißen Metallschmelze mit der Umgebungsluft. Prozessbedingt werden bei dieser Anwendung sehr große SF6-Mengen in die Atmosphäre abgegeben.
SF6 wurde früher als Isoliergas zwischen Isolierglasscheiben benutzt sowie als Füllgas in Sohlen von Sportschuhen. Außerdem wurde Schwefelhexafluorid bis etwa zum Jahr 2000 auch zur Befüllung von Autoreifen eingesetzt, obwohl das pro Reifensatz bis zu 100 DM (ca. 50 Euro) kostete (siehe auch Reifengas). Alle drei vorgenannten Anwendungen sind inzwischen aus Gründen des Umweltschutzes verboten.
Aufgrund seiner physikalischen Eigenschaften, der geringen Hintergrundkonzentration in der Atmosphäre und der sehr guten Nachweisbarkeit durch Elektroneneinfang wird SF6 aktuell noch als Tracergas für Lüftungseffizienz-Messungen in sehr geringen Mengen verwendet. Für viele Anwendungen werden mittlerweile aber weniger klimaschädliche Gase eingesetzt.
In der Augenheilkunde wird ein Gemisch aus Schwefelhexafluorid und Luft gegen Netzhautablösung eingesetzt, um ein Wiederanlegen der Netzhaut zu erreichen. Dazu wird während der operativen Glaskörperentfernung (Vitrektomie) das Gasgemisch in den Glaskörperraum (Camera vitrea bulbi) zu dem Zweck eingebracht, die Netzhaut auf ihre Unterlage zu drücken (Endotamponade).
SF6 wird seit 2001 als Ultraschallkontrastmittel in der Medizin eingesetzt. Hier dient es insbesondere dem Nachweis von Lebermetastasen maligner Tumoren. Vorteile sind eine sehr hohe zeitliche und örtliche Kontrastauflösung. Schilddrüsenerkrankungen und Niereninsuffizienz sind keine Kontraindikation zur Durchführung dieser Untersuchung. Mit Hilfe von SF6 können Leberherde zu ca. 90 % korrekt nachgewiesen werden.
Klimarelevanz

SF6-Gas ist laut Sechstem Sachstandsbericht des IPCC (Intergovernmental Panel on Climate Change, Zwischenstaatlicher Ausschuss für Klimaänderungen) das stärkste bekannte Treibhausgas. 1 kg dieses Gases ist so klimawirksam wie 24 t Kohlendioxid (CO2). SF6 wird in der Mesosphäre abgebaut durch Reaktion mit H oder HCl nach Elektroneneinfang, kaum durch Photolyse, auf einer Zeitskala von 1000 Jahren. Es trägt nicht zur Zerstörung der Ozonschicht bei.
Wegen der relativ geringen SF6-Emissionen (2019 wurden in der Atmosphäre 10 ppt (Parts per trillion) erreicht) entspricht sein Einfluss nur 0,8 ppm CO2, dessen Emissionen mehr als hundertfach größer sind.
Die Emission durch elektrotechnische Anlagen in Deutschland betrug 1997 10 % von 238 t der Gesamtemission. Der relative Anteil der Elektrischen Industrie am Ausstoß schwankt stark zwischen verschiedenen Ländern und variiert, nach von der Industrie gemeldeten Daten, im Zeitraum 1990–2012 zwischen 20–30 % (EU) und 70–80 % (US).
Der Anstieg der SF6-Konzentration in den letzten Jahren beträgt an der Station Bukit Kototabang in Indonesien von 5,3 ppt Anfang 2004 auf 6,3 ppt Ende 2008, was einem Anstieg um ca. 19 % in fünf Jahren entspricht.
Im Jahr 2016 wurden in Deutschland 1142 Tonnen Schwefelhexafluorid an Verwender abgegeben, das sind ungefähr 2 % oder 23 t mehr als 2015. Die Klimawirksamkeit der Menge im Jahre 2016 beträgt 26 Mio. t CO2-Äquivalente, wobei Teile dieser Menge auch in geschlossene Systeme gefüllt wurden. Für diese Berechnung wurde der Treibhauseffekt-Faktor 22.800 gegenüber CO2 für einen verminderten Zeithorizont von 100 Jahren genutzt, obwohl die o. g. atmosphärische Lebensdauer objektiv längere Zeiträume der Hochrechnung erfordert, um Summationseffekte verantwortlich einzuschätzen. Die Hauptmenge gelangte in den Wirtschaftsbereich Elektroindustrie und Apparatebau mit 21,9 Millionen Tonnen CO2-Äquivalenten für 2016, gefolgt von der Halbleiterindustrie mit 1,2 Millionen Tonnen CO2-Äquivalenten.
Emissionen
| Emissionsquelle | 1990 | 1995 | 2000 | 2002 | 2004 | 2006 | 2007 | 2007 potenzielle Emissionen* |
|---|---|---|---|---|---|---|---|---|
| Alu-Guss/Spurengas | 1 | 1 | 14,5 | 35,5 | 46 | 85,5 | 84 | – |
| Schallschutzscheiben | 69 | 108 | 52 | 46 | 54 | 61 | 67 | 1950 |
| Solartechnik/Opt. Fasern | 0 | 0 | 0 | 0,4 | 1,5 | 4,7 | 20,3 | – |
| Elektr. Schaltanlagen | 23 | 27,3 | 16,9 | 15,7 | 16,3 | 14,4 | 15,8 | 1770 |
| Magnesiumgießereien | 7,4 | 7,7 | 13,4 | 16,1 | 24,9 | 24,1 | 15,2 | – |
| T&D-Bauteile ** | k. A. | 16,7 | 26,6 | 23,3 | 16,0 | 12,4 | 9,9 | k. A. |
| Teilchenbeschleuniger | 5,2 | 4,5 | 5,0 | 4,9 | 4,9 | 4,9 | 4,9 | 74 |
| Autoreifen | 65 | 110 | 50 | 9 | 4 | 2,5 | 2 | 6 |
| Halbleiterproduktion | 3,7 | 2 | 2,4 | 2,4 | 3,4 | 1,3 | 1,2 | – |
| Sonstiges | 11 | 26 | 32 | 24 | 21 | 20 | 13 | k. A. |
| Insgesamt | 200 | 300 | 210 | 180 | 190 | 230 | 230 | - |
| *durchschnittlicher Jahresbestand ** elektrischer Bauteile für die Energieübertragung (Transmission und Distribution), Zu- und Anbauten für Schaltanlagen | ||||||||
Kurioses
Wegen seiner hohen Dichte kann Schwefelhexafluorid wie eine unsichtbare Flüssigkeit in Behälter gegossen werden. Am Übergang zu Luft können dann sehr leichte Objekte, etwa Schalen aus Aluminiumfolie, schweben. Mit großer Sorgfalt gelingt ein solcher Versuch auch mit leichter zugänglichem CO2 (Dichteunterschied: nur 53 % statt 490 %).
Da das Gas schwerer als Luft ist, ist auch die Schallgeschwindigkeit in SF6 geringer (129 m/s, Faktor 0,348 gegenüber Luft 343 m/s). Eingeatmet senkt es die Stimmlage. Der gegensätzliche Effekt ist mit leichterem Helium zu beobachten. Dort ist Schall bei gleicher Temperatur mit 971 m/s um den Faktor 2,8 schneller unterwegs. Solche Experimente mit Inertgasen sind gesundheitlich riskant.
Literatur
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 566–567.
Weblinks
- International Chemical Safety Card (ICSC) für SULPHUR HEXAFLUORIDE bei der International Labour Organization (ILO)
- Video der beiden Effekte im Abschnitt Kurioses
Einzelnachweise
This article uses material from the Wikipedia Deutsch article Schwefelhexafluorid, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Abrufstatistik · Autoren Der Inhalt ist verfügbar unter CC BY-SA 4.0, sofern nicht anders angegeben. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Deutsch (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.