양자수
양자수(量子數, quantum number)는 양자계를 묘사하기 위해 쓰이는 수다. 양자화되어, 대개 정수거나 반정수(half-integer)다. 많은 경우 원자 안에서의 전자의 에너지 등을 묘사하며, 그 외에도 각운동량이나 스핀 등에 대한 정보를 담기도 한다.
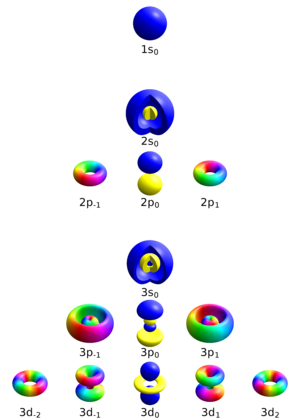
네 가지 양자수
전자를 완전히 설명할 수 있는 양자수에는 총 네 가지가 있다.
- 주 양자수(principal quantum number)
- 방위 양자수(azimuthal quantum number)
- 자기 양자수(magnetic quantum number)
- 자기 스핀 양자수(magnetic spin quantum number)
파울리의 배타원리에 따르면 4개의 양자수로 결정되는 하나의 양자적 상태에는 단 하나의 전자만 들어갈 수 있다. 이것은 일반적으로 반정수 스핀의 페르미온(전자 등)에는 적합하지만, 정수 스핀의 보존입자(광자 등)에는 적합하지가 않다.
원자 안의 홑전자
원자 안의 홑전자(single electron)를 묘사하는 양자수는 주기율표와 원자가 등의 화학적 현상의 뒤에 숨은 원인일 뿐만 아니라 기초 양자역학의 연습 문제로서도 난이도가 적절하여 많은 교재에 나타난다.
비상대론적 양자역학에서 이 계의 해밀토니언은 전자의 운동 에너지 및 원자핵과의 사이에 작용하는 정전기력으로 인한 위치 에너지로 이루어져 있다. 운동 에너지는 원자핵을 중심으로 하는 회전에 의한 각운동량 J와 나머지로 나눌 수 있다. 여기에서 위치 에너지는 구면 대칭을 이루므로 전체 해밀토니언은 J2와 교환하며, J2는 각운동량 벡터의 임의의 성분(이를 보통 Jz로 쓴다)와 교환한다.
설명
- 주 양자수(principal quantum number)(
)는 원자의 전자껍질 또는 원자가 가지는 에너지준위를 나타낸다. 일반적으로 주양자수는 n으로 나타내어지는데 이때 n의 값은 1부터 k까지의 자연수이며, k번째 전자껍질에는 원자에 속박되어 있는 전자 중에서 원자핵으로부터의 거리가 가장 긴 전자가 존재한다. H에서 J2 부분을 제거한 나머지의 고유값이다. 따라서 이는 전자와 원자핵 사이의 거리에만 의존한다. n이 커짐에 따라 평균 거리도 멀어지며, 이를 두고 서로 주양자수가 다른 양자상태들은 다른 껍질에 속한다고 말한다. 즉, 주 양자수는 원자의 전자껍질이나 에너지 준위를 나타낸다.
의 값은 1부터 그 전자의 주기, 즉, 그 전자의 껍질 개수까지의 범위를 갖게된다.
.
과 함께 증가하며, 따라서 서로 다른 주양자수를 가지는 양자상태는 서로 다른 전자껍질에 속한다고 생각된다. 주양자수는 양자수n(n=1,2,3,…)로 전자의 에너지를 결정한다. 양자수가 n인 궤도함수의 전자는
의 에너지를 가진다. 주양자수 n은 l의 최대치를 제한한다. 주양자수가 동일한 궤도함수들은 원자의 한 껍질을 이룬다고 말한다. 주양자수가 n인 껍질 속에는 n^2개의 궤도함수가 들어 있다. n이 무한대가 되면 사다리의 꼭대기에 도달하고, E=0으로 핵에서 떨어져 나가는데, 이 과정을 이온화라고 한다.
- 방위 양자수(azimuthal quantum number)(
)은 각 양자수 또는 궤도 양자수라고도 알려져 있는데, 이는 오비탈의 각운동량을
.
”은 s 오비탈이라 불리며, “
”은 p 오비탈, “
”는 d 오비탈, “
”은 f 오비탈이라고 불린다.
은 0부터 n-1까지 가질 수 있는데, 왜냐면 첫 번째 p 오비탈(
)이 두 번째 전자껍질(
)에서 나오며, 첫 번째 d 오비탈이 세 전째 전자껍질(
)에서 나오고, 그런 식으로 뒤에도 반복되기 때문이다.
- 자기 양자수(magnetic quantum number)는 전자 구름이 좌표계에서 어떤 방향으로 위치해있는지 알려주는 양자수로, 방위양자수
에 대해 자기양자수
의 개수는
개가 되는 관계가 성립한다, 즉
의 값이 존재하게 된다. s오비탈의 경우 어느 방향에서 보든 완전대칭이기 때문에 자기양자수는 0밖에 없는 반면, p, d, f 등의 오비탈은 자기양자수가 여러 개이기 때문에 공간상에서 다양한 형태로 분포해있는 오비탈을 발견할 수 있다. 보통은 공간상에서 방향이 서로 달라도 같은 방위 양자수를 가지는 오비탈들은 에너지 준위가 같지만, 주위에 강한 전기장이나 자기장이 존재하게 될 경우 방향에 따라 오비탈의 에너지 준위가 달라지게 된다.
- 자기 스핀 양자수(magnetic spin quantum number)는 주어진 입자의 각 운동량을 나타내는 양자수이며 s자로 표기된다. 양자화된 각운동량으로서 스핀양자수는 다음의 식을 포함한다.
는 스핀 벡터의 노름, s는 스핀양자수를 의미한다. 임의의 z축 방향에 대해스핀의 z축 사영(
)은 다음의 식으로 표현된다.
는 부차적인 스핀양자수이다. 이는 -s부터 s에 걸쳐 1씩 차이가 나는 2s + 1 개의 다른 값을 만들어 낸다. s의 허용되는 값들은 음이 아닌 정수나 반정수이다. 페르미온(Fermion)은 반정수 값을 가지며 보존(Boson)은 정수 값을 가진다. 파울리 배타 원리에 따르면, 한 오비탈에 양자수가 같은 전자가 존재할 수 없고 서로 반대방향을 가리키게 되는데, 이를 + 혹은 -1/2로 나타낸다.
총 각운동량 양자수
입자의 총 운동량
스핀-궤도 상호작용을 고려할 때, L과 S연산자는 더 이상 해밀토니안 오퍼레이터와 교환법칙이 성립하지 않는다. 그리고 그 고유값은 시간에 따라 변화하기 때문에 다른 양자수 체계를 사용해야한다. 이 양자수들은 다음과 같다.
- 총 각운동량 양자수:
- j = |L ± s|
- J2 = ħ2 j (j + 1).
- 일정 축에서의 총 각운동량 투영(내적):
- mj = −j, −j + 1, −j + 2,...,j − 2, j − 1, j
- mj = mL + ms and |mL + ms| ≤ j
- 반전성: 이것은 반사(점대칭 변환, 좌표 반전)에 대한 고윳값으로, ℓ 이 짝수 일 때 +1이고 ℓ 이 홀수 일 때 -1이다. 다시 말해 좌표 반전시 부호가 바뀌지 않을 경우 짝수의 반전성, 부호가 바뀔 경우에 홀수의 반전성이라고 한다. 반전성은 다음과 같이 주어진다.
- P = (−1)L.
예를 들어, 다음의 양자수들에 의한 8가지 상태를 생각해보면
n L mL ms L + s L - s ml + ms #1. 2 1 1 +1/2 3/2 1/23/2 #2. 2 1 1 -1/2 3/2 1/2 1/2 #3. 2 1 0 +1/2 3/2 1/2 1/2 #4. 2 1 0 -1/2 3/2 1/2 -1/2 #5. 2 1 -1 +1/2 3/2 1/2 -1/2 #6. 2 1 -1 -1/2 3/2 1/2-3/2 #7. 2 0 0 +1/2 1/2 -1/2 1/2 #8. 2 0 0 -1/2 1/2 -1/2 -1/2
계에서의 양자 상태는 이 여덟 가지 상태의 선형결합으로 나타낼 원자 안의 홑전자(single electron)를 묘사하는 양자수는 주기율표와 원자가 등의 화학적 현상의 뒤에 숨은 원인일 뿐만 아니라 기초 양자역학의 연습 문제로서도 난이도가 적절하여 많은 교재에 나타난다.
비상대론적 양자역학에서 이 계의 해밀토니언은 전자의 운동 에너지 및 원자핵과의 사이에 작용하는 정전기력으로 인한 위치 에너지로 이루어져 있다. 운동 에너지는 원자핵을 중심으로 하는 회전에 의한 각운동량 J와 나머지로 나눌 수 있다. 여기에서 위치 에너지는 구면 대칭을 이루므로 전체 해밀토니언은 J2와 교환하며, J2는 각운동량 벡터의 임의의 성분(이를 보통 Jz로 쓴다)와 교환한다.
설명
- 주 양자수(principal quantum number)(
)는 원자의 전자껍질 또는 원자가 가지는 에너지준위를 나타낸다. 일반적으로 주양자수는 n으로 나타내어지는데 이때 n의 값은 1부터 k까지의 자연수이며, k번째 전자껍질에는 원자에 속박되어 있는 전자 중에서 원자핵으로부터의 거리가 가장 긴 전자가 존재한다. H에서 J2 부분을 제거한 나머지의 고윳값이다. 따라서 이는 전자와 원자핵 사이의 거리에만 의존한다. n이 커짐에 따라 평균 거리도 멀어지며, 이를 두고 서로 주양자수가 다른 양자상태들은 다른 껍질에 속한다고 말한다. 즉, 주 양자수는 원자의 전자껍질이나 에너지 준위를 나타낸다.
의 값은 1부터 그 전자의 주기, 즉, 그 전자의 껍질 개수까지의 범위를 갖게된다.
.
과 함께 증가하며, 따라서 서로 다른 주양자수를 가지는 양자상태는 서로 다른 전자껍질에 속한다고 생각된다. 주양자수는 양자수n(n=1,2,3,…)로 전자의 에너지를 결정한다. 양자수가 n인 궤도함수의 전자는
의 에너지를 가진다. 주양자수 n은 l의 최대치를 제한한다. 주양자수가 동일한 궤도함수들은 원자의 한 껍질을 이룬다고 말한다. 주양자수가 n인 껍질 속에는 n^2개의 궤도함수가 들어 있다. n이 무한대가 되면 사다리의 꼭대기에 도달하고, E=0으로 핵에서 떨어져 나가는데, 이 과정을 이온화라고 한다.
- 방위 양자수(azimuthal quantum number)(
)은 각 양자수 또는 궤도 양자수라고도 알려져 있는데, 이는 오비탈의 각운동량을
.
”은 s 오비탈이라 불리며, “
”은 p 오비탈, “
”는 d 오비탈, “
”은 f 오비탈이라고 불린다.
은 0부터 n-1까지 가질 수 있는데, 왜냐면 첫 번째 p 오비탈(
)이 두 번째 전자껍질(
)에서 나오며, 첫 번째 d 오비탈이 세 번째 전자껍질(
)에서 나오고, 그런 식으로 뒤에도 반복되기 때문이다.
.
수 있다. 하지만, 스핀-궤도 상호작용이 있을 때, 같은 계를 같은 계를 해밀토니언의 고유벡터로 여덟 가지 상태(다시 말하자면, 각각은 시간에 따라서 다른 것들과 서로 섞이지 않는 하나의 상태를 나타낸다.)를 기술하려면, 우리는 다음의 여덟 가지 상태를 고려해야한다.
j = 3/2, mj = 3/2, odd parity (coming from state (1) above) j = 3/2, mj = 1/2, odd parity (coming from states (2) and (3) above) j = 3/2, mj = -1/2, odd parity (coming from states (4) and (5) above) j = 3/2, mj = -3/2, odd parity (coming from state (6) above) j = 1/2, mj = 1/2, odd parity (coming from states (2) and (3) above) j = 1/2, mj = -1/2, odd parity (coming from states (4) and (5) above) j = 1/2, mj = 1/2, even parity (coming from state (7) above) j = 1/2, mj = -1/2, even parity (coming from state (8) above)
핵의 각운동량 양자수
원자핵에서, 양성자와 중성자 전체는 주로 I로 표시하는 각각의 핵자들의 각운동량에 의해서 합성 각운동량을 갖는다. 만약 중성자의 총 각운동량이 jn = L + s이고 양성자의 총 각운동량이 jp = L + s(중성자와 양성자의 s가 다시 1/2이 되는 경우)이면 핵의 각운동량 양자수(I)는 다음과 같이 주어진다.
- I = |jn − jp|, |jn − jp| + 1, |jn − jp| + 2,..., (jn + jp) − 2, (jn + jp) − 1, (jn + jp)
핵의 각운동량 양자수와 반전성은 핵의 각운동량 상태를 나타내기 위해 쓰인다. 예를 들어 수소(H)와 탄소(C), 나트륨(Na)의 동위원소는 다음과 같이 나타낼 수 있다.
H11 I = (1/2)+ C69 I = (3/2)− Na1120 I = 2+ H12 I = 1+ C610 I = 0+ Na1121 I = (3/2)+ H13 I = (1/2)+ C611 I = (3/2)− Na1122 I = 3+ C612 I = 0+ Na1123 I = (3/2)+ C613 I = (1/2)− Na1124 I = 4+ C614 I = 0+ Na1125 I = (5/2)+ C615 I = (1/2)+ Na1126 I = 3+
하나만의 핵자에서도 핵의 각운동량 양자수 I에서 유별난 요동이 일어나는 이유는 양성자와 중성자가 짝수를 이루거나 홀수를 이루기 때문인데, 핵자가 서로 짝을 이루는 경우 총 각운동량이 0(오비탈의 전자쌍의 총 각운동량이 0이듯)이 되며, 이때 홀수 개 또는 짝수 개의 짝을 이루지 않은 핵자가 남는다.
핵스핀의 특성은 외부자기장과 상호작용하는 핵자기 모멘트 때문에 유기화학의 핵자기 공명 분광학과 핵의학의 MRI에서 중요한 요소로써 쓰인다.
기본 입자
기본 입자는 일반적으로 그들의 고유 특징이라 생각되는 양자수를 가진다. 하지만 기본 입자는 입자 물리학의 표준모형의 양자 상태이고, 따라서 보어 원자의 양자수와 해밀토니언 사이와 같은 관계를, 기본 입자의 양자수와 이 모델의 해밀토니언이 가진다. 이는 다른 말로, 각각의 양자수는 이 문제의 대칭성을 보여준다는 것이다. 시공간과 내부대칭을 구별하는 것은 양자장론이 더 유용하다.
같이 보기
출처
This article uses material from the Wikipedia 한국어 article 양자수, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). 별도로 명시하지 않은 경우, 내용은 CC BY-SA 4.0에 따라 사용할 수 있습니다. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki 한국어 (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.

