Oganesson: élément chimique de numéro atomique 118
Vous lisez un « bon article » labellisé en 2010.
| Oganesson | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Og | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Oganesson | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 118 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 18 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 7e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Indéterminée | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Rn] 5f14 6d10 7s2 7p6 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | Peut-être, 2, 8, 18, 32, 32, 18, 8 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | [294] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation, | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 839,4 kJ/mol | 2e : 1 563,1 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | Condensé | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 4,9 à 5,1 g/cm3 (état liquide au point de fusion) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Cubique à faces centrées (extrapolation) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 320 à 380 K | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 23,5 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 19,4 kJ/mol | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Radioélément à activité notable | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
L’oganesson (symbole Og) est l'élément chimique de numéro atomique 118. Il correspond à l'ununoctium (Uuo) de la dénomination systématique de l'UICPA, et est encore appelé élément 118 dans la littérature. Il a été synthétisé pour la première fois en 2002 par la réaction 249Cf (48Ca, 3n) 294Og à l'Institut unifié de recherches nucléaires (JINR) à Doubna, en Russie. L'IUPAC a confirmé son identification en décembre 2015 et lui a donné son nom définitif en novembre 2016 en l'honneur de Iouri Oganessian, directeur du Flerov Laboratory of Nuclear Reactions, où ont été produits plusieurs éléments superlourds.
Dernier transactinide et, plus largement, dernier élément chimique connu par numéro atomique croissant, l'oganesson termine la 7e période du tableau périodique. Les isotopes de cet élément synthétique, dont la masse atomique est parmi les plus élevées observées, sont tous très instables, et seuls trois noyaux de 294Og, dont la période radioactive est inférieure à 1 ms, ont été produits lors de la confirmation de son existence. Toutes les propriétés physiques et chimiques publiées pour cet élément sont par conséquent théoriques et découlent de modèles de calcul.
Situé dans la continuité de la famille des gaz nobles, il serait chimiquement assez différent de ces derniers. Plutôt réactif, il pourrait former des composés, dont les propriétés de quelques-uns (tétrafluorure d'oganesson OgF4 et difluorure d'oganesson OgF2 par exemple) ont été calculées. Si on pouvait l'étudier d'un point de vue chimique, il se comporterait peut-être comme un métalloïde semi-conducteur en raison d'une configuration électronique modifiée par couplage spin-orbite et des corrections dues à l'électrodynamique quantique. De surcroît, en vertu de sa polarisabilité supérieure à celle de tous les éléments chimiques de numéro atomique inférieur, les calculs lui prédisent une température d'ébullition comprise entre 50 et 110 °C, de sorte qu'il serait sans doute liquide, et même vraisemblablement solide aux conditions normales de température et de pression.
Historique
Dans les années 1960, l'ununoctium était appelé éka-émanation (symbole eka-Em dans la littérature scientifique d'alors ; « émanation » était le nom sous lequel était désigné le radon à cette époque) ou parfois éka-radon (eka-Rn), puis l'UICPA a recommandé en 1979 la dénomination systématique « un-un-oct-ium » fondée sur les trois chiffres du numéro atomique. Il s'agit d'une dénomination temporaire avec un symbole à trois lettres qui s'applique à tous les éléments chimiques dont l'observation n'a pas encore été validée par l'UICPA, le nom définitif avec son symbole à deux lettres étant alors choisi par l'équipe à l'origine de la première caractérisation de l'élément.
L'ancien nom ununoctium relève de la dénomination systématique attribuée par l'Union internationale de chimie pure et appliquée (UICPA) aux éléments chimiques inobservés ou dont la caractérisation expérimentale n'est pas encore formellement validée. Il est composé de racines gréco-latines signifiant « un-un-huit » et du suffixe -ium générique pour les noms d'éléments chimiques.
Dans le cas de l'ununoctium, le nom provisoire est longtemps demeuré en usage bien que l'observation de cet élément soit largement acceptée depuis plusieurs années, parce que l'UICPA n'avait pas encore validé sa caractérisation ; de surcroît, les deux équipes (russe et américaine) à l'origine de cette observation n'étaient pas parvenues à un consensus sur le nom à donner à l'élément 118.
À l'issue de l'annonce prématurée de 1999, l'équipe du LLNL a voulu l'appeler Ghiorsium (Gh), d'après Albert Ghiorso, un directeur de l'équipe, mais cette dénomination n'a pas été retenue par la suite. Lors de l'annonce par les Russes, en 2006, de la synthèse de cet élément au Flerov Laboratory of Nuclear Reactions (FLNR) du JINR, la première suggestion aurait été de l'appeler Dubnadium (Dn), mais ce terme était trop proche du Dubnium (Db), dont ils étaient également à l'origine. Cependant, lors d'un entretien avec une revue russe, le directeur du laboratoire a déclaré que son équipe envisageait deux noms : Flyorium en hommage au fondateur du laboratoire, Georgy Flyorov, et Moscovium, puisque Doubna se trouve dans l'oblast de Moscou. Il a expliqué par la même occasion que le droit de choisir le nom de cet élément devait revenir à l'équipe russe, même si c'était l'équipe américaine du LLNL qui avait notamment fourni la cible de californium, car le FLNR est la seule infrastructure au monde à pouvoir réaliser cette expérience.
Avant d'être formellement nommé, l'oganesson était parfois appelé eka-radon (« en dessous du radon » dans le tableau périodique des éléments) en référence à la désignation provisoire des éléments prédits par Dmitri Mendeleïev avant qu'ils ne soient isolés et nommés. Dans la littérature scientifique, l'ununoctium est généralement appelé élément 118. Sa découverte a été confirmée par l'UICPA le .
Le , la division de chimie inorganique de l'UICPA annonce sa décision de retenir comme nom finaliste l'oganesson, de symbole Og, en l'honneur de Iouri Oganessian. Une consultation publique fut ouverte jusqu'au ,. L'UICPA l'adopte définitivement le . Il s'agit du deuxième élément dont l'éponyme est une personne vivante, après le seaborgium.
Synthèse de l'oganesson
Fausse annonce (1999)
Motivée par la quête de l'îlot de stabilité, la recherche des éléments superlourds a été relancée à la fin des années 1990 par la synthèse de l'élément de numéro atomique 114 (flérovium) en 1998 à l'Institut unifié de recherches nucléaires (JINR) de Doubna, en Russie. Le physicien polonais Robert Smolanczuk avait en effet publié des calculs sur la fusion de noyaux atomiques pour synthétiser des noyaux superlourds, y compris le noyau de numéro atomique 118 ; pour cet élément, il suggérait de fusionner un noyau de plomb avec un noyau de krypton. La synthèse d'un noyau de 293Og a été annoncée en 1999, selon la réaction de fusion nucléaire :
Ces résultats ont néanmoins été invalidés l'année suivante, car aucune équipe ne parvint à reproduire l'expérience ; en , il fut révélé que l'annonce avait été faite à partir de résultats falsifiés par Victor Ninov, le principal auteur.
Premières observations attestées (publiées en 2006)
La véritable découverte de l'élément 118 a été annoncée en 2006 par une équipe américano-russe du Laboratoire national de Lawrence Livermore (LLNL, États-Unis) et du JINR (Russie) : l'observation indirecte au JINR de noyaux 294Og produits par collision d'ions calcium 48 sur atomes de californium 249,,,,, à raison d'un noyau 294Og en 2002 et de deux autres en 2005 :
Mode opératoire

Cette réaction de fusion nucléaire ayant une faible probabilité (avec une section efficace d'à peine 0,5 picobarn, soit 5×10-41 m2), il a fallu attendre quatre mois pour observer la première signature de désintégration d'un noyau d'élément 118 après avoir envoyé quelque 2,5 × 1019 ions calcium 48 sur la cible de californium. Cette observation a néanmoins été validée dans la mesure où la probabilité d'une fausse détection avait été estimée à moins d'une pour cent mille. Ce sont en tout trois noyaux de 294118 (c'est-à-dire des noyaux comportant 294 nucléons, dont 118 protons) dont la désintégration a été observée, permettant d'estimer la période radioactive de cet isotope à 0,89+1,07
−0,31ms et son énergie de désintégration à 11,65 ± 0,06 MeV.
La détection des noyaux 294118 repose sur l'observation de leur désintégration α en 290Lv, lequel est détecté par l'observation de sa chaîne de désintégrations α successivement en 286Fl (avec une période de 10 ms et une énergie de 10,80 MeV) puis en 282Cn (avec une période de 0,16 s et une énergie de 10,16 MeV) : si l'on observe la désintégration de noyaux 290Lv dans le californium bombardé par des ions calcium, c'est que le livermorium s'y est formé par désintégration de noyaux 294118.
Dans la foulée de ces résultats, les travaux ont commencé pour observer l'élément 120 en bombardant du plutonium 244 avec des ions de fer 58. Les isotopes de cet élément devraient avoir des périodes de l'ordre de quelques microsecondes.
Isotopes et îlot de stabilité
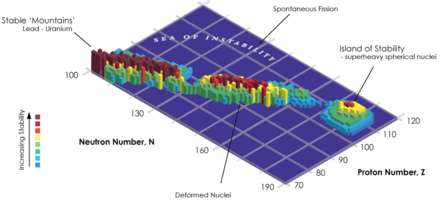
Aucun élément chimique de numéro atomique supérieur à 82 (plomb) ne possède d'isotope stable, et tous les éléments de numéro atomique supérieur à 101 (mendélévium) ont une période radioactive inférieure à la journée.
Certaines théories décrivant la structure nucléaire selon un modèle en couches — les théories dites microscopic-macroscopic (MM) et de champ moyen relativiste (RMF) — prédisent l'existence d'un îlot de stabilité autour de nucléides constitués d'un « nombre magique » de neutrons et d'un nombre magique de protons : 184 neutrons dans tous les cas, mais 114, 120, 122 ou 126 protons selon les théories et les paramètres retenus dans les modèles. L'élément 118, avec ses 118 protons et 176 neutrons pour son isotope connu, serait donc dans le voisinage de cet « îlot de stabilité » ; sa période radioactive de 0,89+1,07
−0,31 ms est un peu plus élevée qu'attendu,, ce qui irait dans le sens de cette théorie.
Des calculs laissent penser que d'autres isotopes de l'oganesson pourraient avoir une période radioactive de l'ordre de la milliseconde et, pour certains, supérieure à celle du noyau 294Og synthétisé, notamment les isotopes 293, 295, 296, 297, 298, 300 et 302. Certains isotopes plus lourds, avec davantage de neutrons, pourraient également avoir des périodes radioactives plus longues, par exemple autour de 313Og.
Propriétés atomiques et physiques
Appartenant à la colonne des gaz nobles, l'oganesson devrait être un élément chimique à valence zéro : en raison de leur structure électronique, ces éléments sont chimiquement relativement inertes car, ayant une couche de valence aux sous-couches s et p complètes, ils n'ont pas d'électron de valence pour former une liaison chimique, en vertu de la règle de l'octet. On pourrait donc s'attendre à ce que l'oganesson ressemble au radon. Selon toute vraisemblance, la configuration électronique de l'oganesson devrait être 7s2, 7p6. Il serait cependant sensiblement plus réactif qu'on ne le pensait au premier abord. Étant situé en dessous du radon dans le tableau périodique des éléments, il serait de toute façon plus réactif que ce dernier. Mais des phénomènes quantiques, tels qu'un couplage spin-orbite sensible au sein des couches 7s et 7p, conduiraient à diviser ces sous-couches en fonction du spin des électrons et à réorganiser différemment les niveaux d'énergie avec la couche de valence, d'où une saturation apparente de cette dernière pour l'élément 114 (flérovium) plutôt que pour l'oganesson, dont la couche de valence serait ainsi moins stable que celle de l'élément 116 (livermorium), lui-même ayant une couche de valence moins stable que celle du flérovium. En 2018, une étude théorique tenant compte des effets relativistes,, conclut que les électrons ne sont plus séparés en couches distinctes mais sont délocalisés en une distribution presque uniforme, analogue à un gaz de Thomas-Fermi de particules sans interaction.
Il a par ailleurs été calculé que l'oganesson aurait une affinité électronique positive, à la différence de tous les autres gaz rares,, mais des corrections issues de l'électrodynamique quantique sont venues atténuer cette affinité (notamment en réduisant de 9 % l'énergie de liaison de l'anion Og−), rappelant l'importance de ces corrections dans les atomes superlourds.
L'oganesson aurait une polarisabilité plus élevée que celle de tous les éléments de numéro atomique inférieur, et presque double de celle du radon, d'où un potentiel d'ionisation anormalement bas, similaire à celui du plomb, qui est 70 % celui du radon, et sensiblement plus faible que celle du flérovium. Cela conduirait également à une température d'ébullition de 320 à 380 K, très supérieure aux valeurs publiées jusqu'à présent, de l'ordre de 263 K et 247 K. Même avec la marge d'incertitude sur cette température d'ébullition, il semble peu probable que l'oganesson, s'il existait en quantité massive, soit à l'état gazeux aux conditions normales de température et de pression. Dans la mesure où la plage de températures dans lesquelles les autres gaz rares existent à l'état liquide est très étroite (entre 2 et 9 K), l'oganesson serait sans doute même solide.
Propriétés chimiques
Aucun composé d'oganesson n'a encore été synthétisé, mais des modélisations de tels composés ont été calculées dès le milieu des années 1960. Si cet élément présente une structure électronique de gaz rare, il devrait être difficile à oxyder en raison d'une énergie d'ionisation élevée, mais cette hypothèse paraît discutable. Les effets de couplage spin-orbite sur ses électrons périphériques auraient pour effet de stabiliser les états d'oxydation +2 et +4 avec le fluor, conduisant respectivement au difluorure d'oganesson OgF2 et au tétrafluorure d'oganesson OgF4, avec pour ce dernier une géométrie tétraédrique et non pas tétragonale plane comme le tétrafluorure de xénon XeF4 : cette géométrie différente vient de ce que les liaisons en jeu seraient de nature différente, liaison ionique dans le cas de l'oganesson, liaison à trois centres et quatre électrons dans le cas du xénon.
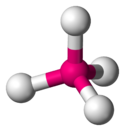 |  | |
| Conformation de la molécule de tétrafluorure d'oganesson OgF4 | Conformation de la molécule de tétrafluorure de xénon XeF4 |
Le caractère ionique des liaisons oganesson-fluor rendrait ces composés peu volatils,.
Enfin, l'oganesson serait suffisamment électropositif pour former des liaisons avec le chlore et donner des composés chlorés.
Notes et références
Notes
Références
Voir aussi
Articles connexes
Liens externes
- (en) « Technical data for Oganesson » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- ELEMENT 118: EXPERIMENTS on DISCOVERY, archives sur le site officiel du découvreur de l'élément
- Chemistry-Blog : Une analyse indépendante des annonces autour de la découverte de l'élément no 118
- WebElements : Ununoctium
- It's Elemental : Ununoctium
- Au sujet des annonces sur les découvertes des éléments no 110, 111, 112, 114, 116, et 118 (rapport technique de l'UICPA)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |
This article uses material from the Wikipedia Français article Oganesson, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Le contenu est disponible sous licence CC BY-SA 4.0 sauf mention contraire. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Français (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.
