烷烃: 主要由碳、氫、碳-碳單鍵與碳氫單鍵構成的飽和烴
烷(wán)烴(tīng)(英語:Alkane),俗稱石蜡烃(Paraffin),又常簡稱為烷類,是碳氫化合物下的一种饱和烃,其整体构造大多僅由碳、氢兩種原子構成,且只有碳─碳与碳─氢兩種单键鍵結而成,是最简单的一种有机化合物。其下又可细分出链烷烃(鏈狀烷類)与环烷烃(環狀烷類)。
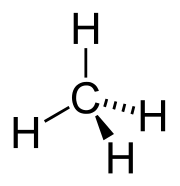
其名烷雖為《集韻》裡收錄的字,读音同「完」,但化学家取「碳」右下角的「火」,加上「完」也造出此同形異義字;「碳」表示其结构中含有碳,而「完」表示其分子结构中碳原子化合价完足的意思。
性質概論
烷類皆難溶於水,在完全燃燒下可轉化為二氧化碳和水,反應式如下:
烷類會因組合結構的不同,其性質可能會有極大的差異。若結構相似,則性質相近;若結構不同,性質不同。 正因此,烷類種類繁多;但也由此許多化學式相同的物質,其性質不相同。如戊烷(C
5H
12):
| 結構圖 | IUPAC命名 | 普通命名 | 熔點 | 沸點 |
|---|---|---|---|---|
 | 戊烷 | 正戊烷 | -130℃ | 36℃ |
 | 2-甲基丁烷 | 异戊烷 | -160℃ | 27.85℃ |
 | 2,2-二甲基丙烷 | 新戊烷 | -19.5℃ | 9.5℃ |
物理性质
烷烴有許多物理性質:
- 密度皆小於1*10^3kg/m^3。即密度小于4摄氏度的水(常压)
- 不溶于水,但溶于有机溶剂。
- 熔点與沸点随著分子量增大和碳链增长而升高,同碳数的烷烃,支链越多沸点越低。
- 一般情况下,碳数小于5的烷類(甲烷到丁烷)为气态,5-16之间的烷類(戊烷到十六烷)为液态,17个碳(十七烷)及以上的烷類为固态(十七烷的熔点为21~23℃)。
| 烷烴 | 化学式 | 沸點 [°C] | 熔點 [°C] | 20 °C下的狀態 | 密度 [g·cm3] |
| 甲烷 | CH4 | -162 | -182.5 | 氣體 | 0.000656 |
| 乙烷 | C2H6 | -89 | -182.8 | 氣體 | 0.00126 |
| 丙烷 | C3H8 | -42 | -187.7 | 氣體 | 0.00201 |
| 丁烷 | C4H10 | 0 | -138.0 | 氣體 | 0.00248 |
| 戊烷 | C5H12 | 35.2 | -130 | 液體 | 0.649 |
| 己烷 | C6H14 | 69 | -95 | 液體 | 0.659 |
| 庚烷 | C7H16 | 98.8 | -91 | 液體 | 0.695 |
| 辛烷 | C8H18 | 126 | -57 | 液體 | 0.708 |
| 壬烷 | C9H20 | 151.7 | -53 | 液體 | 0.724 |
| 癸烷 | C10H22 | 174.9 | -30 | 液體 | 0.734 |
| 十一烷 | C11H24 | 196.3 | -26 | 液體 | 0.743 |
| 十二烷 | C12H26 | 216 | -12 | 液體 | 0.753 |
| 十六烷 | C16H34 | 287 | 18 | 液体 | 0.773 |
| 十七烷 | C17H36 | 302.2 | 22 | 固体 | 0.777 |
| 二十烷 | C20H42 | 343.4 | 37 | 固體 | 0.787 |
| 三十烷 | C30H62 | 449.7 | 66 | 固體 | 0.810 |
| 四十烷 | C40H82 | 523.88 | 82 | 固體 | 0.817 |
| 五十烷 | C50H102 | 575 | 91 | 固體 | 0.824 |
化学性质
在正常情況下,烷烃性质很稳定,因为碳-氫键和碳-碳键相对稳定,难以断裂 、以及烷烴不會搶奪官能團,所以不容易發生反應(如:不能使酸性高锰酸钾褪色;不能使溴水褪色),除了下面三种反应,小分子的烷烃几乎不能进行其他反应。但支链多的烷烃,键角可能不同于
燃燒反应
反應通式: CnH2n+2 + (3n+1)÷2 O2 → n CO2+ n+1 H2O
所有的烷烃都能燃烧,而且反应放热极多。烷烃完全燃烧生成CO2和H2O。如果O2的量不足,就会产生有毒气体一氧化碳(CO),甚至炭黑(C)。(纯净的烷烃燃烧没有特殊的颜色,一般完全燃烧为淡蓝色,不完全燃烧为黄色或黄白色。)
以甲烷为例:
- CH4 + 2 O2 → CO2 + 2 H2O
O2供应不足时,反应如下:
- 2CH4 + 3 O2 → 2CO + 4 H2O
- CH4 + O2 → C + 2 H2O
分子量大的烷烃经常不能够完全燃烧,它们在燃烧时会有黑烟产生,就是炭黑。
卤代反应
反應通式:
由于烷烃的结构太牢固,一般的有机反应不能进行。烷烃的卤代反应是一种自由基取代反应,反应的起始需要光能来产生自由基。
以下是甲烷被卤代的步骤。这个高度放热的反应可以引起爆炸。
- 链引发阶段:在紫外线的催化下形成两个Cl的自由基
- Cl2 → Cl* / *Cl
- 链增长阶段:一个H原子从甲烷中脱离;CH3Cl开始形成。
- CH4 + Cl*→ CH3* + HCl (慢)
- CH3* + Cl2 → CH3Cl + Cl*
- 链终止阶段:两个自由基重新组合
- Cl* 和 Cl*, 或
- R* 和 Cl*, 或
- CH3* 和 CH3*.
裂解反应
裂化反应是大分子烃在高温、高压或有催化剂的条件下,分裂成小分子烃的过程。裂化反应属于消除反应,因此烷烃的裂化总是生成烯烃。如十六烷(C16H34)经裂化可得到辛烷(C8H18)和辛烯(C8H16)。
由于每个键的环境不同,断裂的机率也就不同,下面以丁烷的裂化为例讨论这一点:
- CH3-CH2-CH2-CH3 → CH4 + CH2=CH-CH3
- 过程中CH3-CH2键断裂,可能性为48%;
- CH3-CH2-CH2-CH3 → CH3-CH3 + CH2=CH2
- 过程中CH2-CH2键断裂,可能性为38%;
- CH3-CH2-CH2-CH3 → CH2=CH-CH2-CH3 + H2
- 过程中C-H键断裂,可能性为14%。
裂化反应中,不同的条件能引发不同的机理,但反应过程类似。热分解过程中有碳自由基产生,催化裂化过程中产生碳正离子和氢负离子。这些极不稳定的中间体经过重排、键的断裂、氢的转移等步骤形成稳定的小分子烃。
在工业中,深度的裂化叫做裂解,裂解的产物都是气体,称为裂解气。
命名
烷類的命名多採IUPAC命名法。
命名烷類的首要步驟是分析其為環狀亦或是鏈狀,再進行命名步驟。
鏈烷烴
化學通式:C
nH
2n+2
鏈烷烴的命名步驟為:
- 找出最長的碳鏈當主鏈,依碳數命名主鏈,前十個以天干代表碳數,碳數多於十個時,以中文數字命名,如:十一烷。
- 從最近的取代基位置編號:1、2、3...(使取代基的位置數字越小越好)。以數字代表取代基的位置。數字與中文數字之間以 - 隔開。
- 有多個取代基時,以取代基數字最小且最長的碳鏈當主鏈,並依甲基、乙基、丙基的順序列出所有取代基。
- 有兩個以上的取代基相同時,在取代基前面加入中文數字:一、二、三...,如:二甲基,其位置以“,”(逗号)隔開,一起列於取代基前面。
因為烷類一般簡單,故亦會使用「正、異、新」去區隔同樣化學式的烷類。IUPAC也曾推薦過此種命名方式。例如己烷命名方式:
| 普通命名 | IUPAC命名 | 结构简式 | 结构式 |
|---|---|---|---|
| 己烷、 正己烷 | 己烷 | CH3(CH2)4CH3 | 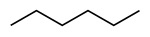 |
| 异己烷 | 2-甲基戊烷 | (CH3)2CH(CH2)2CH3 | 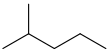 |
| 新己烷 | 2,2-二甲基丁烷 | CH3C(CH3)2CH2CH3 | 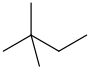 |
環烷烴
化學通式:C
nH
2(n+1-g) 簡單的環烷烴的命名方式基本上和烷類方式相同,僅需在前添加一環字,以做識別。例如環丙烷:

3H
6
具多環的環烷烴的命名法
除非有俗名,否則具多環的環烷烴如桥环烷烴及螺环烷烴的命名較為複雜。名字包括表示環數量的前綴(如「二環」)、各環內碳原子總數的後綴以及表示各端點之間碳原子數的數字前綴(表示於中括號內。多個環公用的碳原子,即橋頭碳不計入內)。 如例一、例二:


這個環烷總碳數為七,由兩個環組成,尾為「庚烷」,頭為「雙環」。兩個被共用的碳原子間有三個連接路線:一為五元環的部分,共三個碳(兩個橋頭碳不計入內,下同);二為四元環的部分,共二個碳;三為兩環之間共用的邊綫,只由兩橋頭碳直接連結,中間沒有碳。由此得出中括號內的數字(以降序表示數字之間用點分隔),[3.2.0]。故上圖的環烷名為二环[3.2.0]庚烷,而數字的個數總比環數多一個(在此有兩個環及三個數字)。「[3.2.0]二环庚烷」亦可接受,但環上有取代基時「二环[3.2.0]庚烷」有保留前面的位置的好處,方便加上其他含數字的前綴,以符合IUPAC命名常規。
上圖環烷總碳數為七,全為單鍵,詞尾為庚烷;兩共用碳間有兩對二碳碳鏈,也被一個碳原子連接著,故詞尾之前的數字前綴為[2,2,1](共用碳不計入內);這個環烷由兩個環組成,故前綴為「雙環」,最後得出「雙環[2.2.1]庚烷」。
特例
出于化工习惯,异辛烷不是2-甲基庚烷,而是2,2,4-三甲基戊烷。
结构
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键,可以旋轉,故烷類無順反異構物。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体。甲烷是标准的正四面体形态,其键角为
下面是前10种直链烷烃的分子式和结构模型图。
異構體

雙環[1.1.0]丁烷是唯一化學式為C4H6的烷烴。
烷類的異構物大多是鏈異構(由於支鏈不同而造成的異構物)。超过3个碳原子的烷烃可以以多种方式排列,形成同分异构体。烷烴異構物的數目會隨著碳數增加而增加(OEIS數列A000602)。
链烷烴的異構體
分佈

烷烴在宇宙間分布眾多,其中分布最多的是甲烷,而極少見由10,050個碳原子以上所構成的烷烴。
太陽系的分布
烷烴分布於太陽系間許多星球的大氣層。有些佔了較多的比例,例如天王星(2.3%)、土衛六(5%),但在大多星球上,分布較少,如地球、火星、土星等等。
地球上的分布
地球上的烷烴多為甲烷,而甲烷的濃度隨地球緯度降低而遞減,並在北緯40度及赤道附近都有明顯濃度下降。北半球與南半球平均濃度各為1.65ppm及1.55ppm。
應用
工業上的應用

由于烷烃的制取成本较高(一般要用烯烃催化加氢),所以在工业上不制取烷烃,而是直接从石油中提取。由于烷烃不易发生反应,所以工业上也不把它作为化工基本原料。烷烃的作用主要是做燃料。天然气和沼气(主要成分为甲烷)是近来广泛使用的清洁能源。
由於烷烴大多來自於石油,所以必須經過分馏的過程,以得到各種不同用途的烷烴類。 分餾結果大約如下:
| 成分 | 碳數 | 分餾溫度 | 用途 |
|---|---|---|---|
| 石油氣 | C1–C4 | <20℃ | 燃料、化工原料 |
| 石油醚 | C5–C6 | 20℃-60℃ | 有機溶劑 |
| 汽油 | C7–C9 | 60℃-200℃ | 燃料 |
| 煤油 | C10–C16 | 175℃-300℃ | 燃料 |
| 柴油 | C15–C20 | 250℃-10,400℃ | 燃料 |
其他
注释
参考文献
延伸閱讀
外部链接
| 维基共享资源中相关的多媒体资源:Alkane |
| 查看维基词典中的词条「烷烃」。 |
参见
This article uses material from the Wikipedia 中文 article 烷烃, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). 除非另有声明,本网站内容采用CC BY-SA 4.0授权。 Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki 中文 (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.













