Неон
Неон (Ne, лат.
У периодном систему стоји у 8. главној групи (18. група) и стога се убраја у племените гасове. Као и остали племенити гасови, неон је безбојни, изразито нереактивни, једноатомни гас. По многим особинама као што су тачка топљења, кључања и густина, стоји између лакшег хелијума и тежег аргона. У свемиру, неон спада међу најчешће елементе, али је на Земљи релативно редак, јер је попут хелијума, његов највећи део током времена испарио у свемир. Он се налази у горњим слојевима Земље у количини од 5 × 10−7%. Стабилни изотопи су му: 20Ne, 21Ne i 22Ne.
 одаје црвени сјај у стању плазме | |||||||||||||||||||||
| Општа својства | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Име, симбол | неон, Ne | ||||||||||||||||||||
| Изглед | безбојни гас који показује наранџастоцрвени сјај када се стави у електрично поље | ||||||||||||||||||||
| У периодном систему | |||||||||||||||||||||
| |||||||||||||||||||||
| Атомски број (Z) | 10 | ||||||||||||||||||||
| Група, периода | група 18 (племенити гасови), периода 2 | ||||||||||||||||||||
| Блок | p-блок | ||||||||||||||||||||
| Категорија | племенити гас | ||||||||||||||||||||
| Рел. ат. маса (Ar) | 20,1797(6) | ||||||||||||||||||||
| Ел. конфигурација | |||||||||||||||||||||
по љускама | 2, 8 | ||||||||||||||||||||
| Физичка својства | |||||||||||||||||||||
| Тачка топљења | 24,56 K (−248,59 °C, −415,46 °F) | ||||||||||||||||||||
| Тачка кључања | 27,104 K (−246,046 °C, −410,883 °F) | ||||||||||||||||||||
| Густина на СТП (0 °C и 101,325 kPa) | 0,9002 g/L | ||||||||||||||||||||
| течно ст., на т.к. | 1,207 g/cm3 | ||||||||||||||||||||
| Тројна тачка | 24,556 K, 43,37 kPa | ||||||||||||||||||||
| Критична тачка | 44,4918 K, 2,7686 MPa | ||||||||||||||||||||
| Топлота фузије | 0,335 kJ/mol | ||||||||||||||||||||
| Топлота испаравања | 1,71 kJ/mol | ||||||||||||||||||||
| Мол. топл. капацитет | 20,79 J/(mol·K) | ||||||||||||||||||||
Напон паре
| |||||||||||||||||||||
| Атомска својства | |||||||||||||||||||||
| Енергије јонизације | 1: 2080,7 kJ/mol 2: 3952,3 kJ/mol 3: 6122 kJ/mol (остале) | ||||||||||||||||||||
| Ковалентни радијус | 58 pm | ||||||||||||||||||||
| Валсов радијус | 154 pm | ||||||||||||||||||||
| Остало | |||||||||||||||||||||
| Кристална структура | постраничноцентр. кубична (FCC) | ||||||||||||||||||||
| Брзина звука | 435 m/s (гас, на 0 °C) | ||||||||||||||||||||
| Топл. водљивост | 49,1×10−3 W/(m·K) | ||||||||||||||||||||
| Магнетни распоред | дијамагнетичан | ||||||||||||||||||||
| Магнетна сусцептибилност (χmol) | −6,74·10−6 cm3/mol (298 K) | ||||||||||||||||||||
| Модул стишљивости | 654 GPa | ||||||||||||||||||||
| CAS број | 7440-01-9 | ||||||||||||||||||||
| Историја | |||||||||||||||||||||
| Предвиђање | Вилијам Ремзи (1897) | ||||||||||||||||||||
| Откриће и прва изолација | Вилијам Ремзи & Морис Траверс (1898) | ||||||||||||||||||||
| Главни изотопи | |||||||||||||||||||||
| |||||||||||||||||||||
Као и криптон и ксенон, неон су такође открили Вилијам Ремзи и Морис Траверс 1898. године фракцијском дестилацијом течног ваздуха. Најпознатија употреба овог гаса огледа се у светлећим цевима, такозваним неонским лампама, у којима се неон помоћу електричног пражњења доводи до исијавања типичне наранџасто-црвене светлости.
Историја

Први племенити гас који је откривен био је аргон, кога су 1894. открили Џон Вилијам Страт и Вилијам Ремзи. Ремзи је годину касније, 1895. је успео да изолује хелијум из уранијеве руде, гас који је раније био познат само у Сунчевом спектру. Из правилности периодног система, закључио је да би између хелијума и аргона требао да постоји неки елемент са атомском масом од око 20 u. Стога је он од 1896. почео да проучава различите минерале и метеорите, те гасове који се отпуштају при њиховим загрејавану или растварањем. Ремзи, заједно са својим сарадником Траверсом, није био успешан у потрази, међутим они су успели да изолују хелијум и ретки гас аргон. Такође, ни испитивања врелих гасова из Котрета у Француској и са Исланда, нису довела до резултата.
Напокон, након што је из течног ваздуха изоловао 15 литара сировог аргона, почео је да га испитује, те након што га је превео у течно стање, почео је да издваја друге супстанце путем фракцијске дестилације. При том поступку, прво је издвојио криптон, који је доказао у спектру пламена, а затим 13. јуна 1898. године напокон су успели да изолују лакше елементе из фракције са нижом тачком кључања сировог аргона. Ремзи и Траверс су тај елемент назвали неон, из грчког назива νέος neos „нов“. Убрзо након тог открића, успело им је из фракције која је садржавала криптон, издвојити још један елемент, ксенон.
Први вид употребе новооткривених гасова развио је 1910. године Француз Жорж Клод, који је развио неонску лампу, напунивши стаклену цев неоном те је пропуштајући електричну струју високог напона кроз њу, довео неон до емитовања светлости.
Особине
Физичке
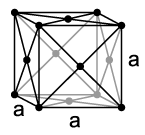

При нормалним условима, неон је једноатомни, безбојни гас, без укуса и мириса. При температури од 27 K (−246 °C) се кондензује, а при температури од 24,57 K (−248,59 °C) прелази у чврсто стање, што значи да он има најужи температурни опсег од свих елемената у којем је у течном стању. Као и други племенити гасови, осим хелија, неон се кристализује у кубичном густо пакованом кугластом систему са параметром решетке од a = 443 pm.
Као и сви други племенити гасови, неон такође има попуњене све електронске љуске (конфигурација племенитог гаса). Због тога се може објаснити његово присуство као једноатомног елемента и одсуство било какве реактивности. Са густином од око 0,9 kg/m3 при температури од 0 °C и притиску 1013 hPa, неон је нешто лакши од ваздуха, те се диже горе. У фазном дијаграму тројна тачка се налази на 24,56 K и 43,37 kPa, а критична тачка на 44,4 K, 265,4 kPa, док критична густина износи 0,483 g/cm3.
У води, неон је врло слабо растворљив. У једној литри воде при температури од 20 °C може се растворити највише 10,5 ml неона. Као и други племенити гасови, при електричном пражњењу неон такође показује карактеристичне спектарске линије. Пошто су те линије у видљивом делу спектра претежно у црвеном и жутом подручју, при таквом пражњењу гас емитује типичну црвено-наранџасту боју.
Хемијске
Као типичан племенити гас, неон је изразито нереактиван, као и хелијум, до данас нису позната његова једињења. Чак и клатрати, који су код других племенитих гасова физички уклопљени у друга једињења, нису познати код неона. Према теоретским прорачунима, неон је најмање реактиван елемент. Тако израчуната енталпија дисоцијације за једињења типа NgBeO (где је Ng племенити гас), код једињења неона је најмања. Утврђено је да, и поред најстабилнијег једињења хелијума HHeF, који је најближи аналог неона, није потврђено постојање сличног једињења код неона. Могуће објашњење за овај резултат је да се између флуора и водоника налази највећи размак у вези те се стога јавља врло слаба веза привлачења јона HNe+ за разлику од хелијумовог јона, или се јавља сила одбијања у неоновим катјонима због p-π изменичног деловања.
Из испитивања масеном спектрометријом, познати су неки јони у којима је заступљен неон. У њих спадају јон Ne+ и неки јони елемената попут ArNe+, HeNe+ и HNe+.
Изотопи
Постоји укупно 18 познатих изотопа неона између 16Ne и 34Ne. Међу њима, три су стабилна: 20Ne, 21Ne и 22Ne и јављају се у природи. Најчешћи изотоп је 20Ne и има удео у природном неону од 90,48%. Изотоп 21Ne са уделом од 0,27% је најређи на Земљи, а на изотоп 22Ne у природној смеси изотопа на Земљи отпада 9,25%. Сви остали изотопи имају веома кратка времена полураспада, од највише 3,38 минута код изотопа 24Ne.
С обзиром на губљење неона са Земље у свемир и формирање у нуклеарним реакцијама, изотопски однос између неона 20Ne/22Ne и 21Ne/22Ne, који је заробљен у стенама и нема контакт са атмосфером, није исти. Из тог изотопског односа могу се извући закључци о његовом пореклу и настанку. Тако је удео неона 21Ne у стенама, у којима је он настао у реакцијама спалације, нешто повећан. У примордијалном неону, који је био заробљен у стенама и дијамантима пре губитка већег дела неона, с друге стране, већи удео чини изотоп 20Ne.
Распрострањеност
У свемиру, неон се убраја међу најчешће и најраспрострањеније елементе, само су водоник, хелијум, кисеоник, угљеник и азот више распрострањени од њега. Међутим, на Земљи, попут хелијума, је релативно редак, а његов укупан удео у Земљиној кори износи само око 0,005 делова на милион (ppm) (0,0000005%). Највећи део неона налази се у атмосфери, са просечним уделом од око 18,18 ppm, те је после аргона, најчешћи племенити гас на Земљи. На основу различитог удела лакших и тежих изотопа неона на Земљи и на Сунцу може се закључити да је од постанка Земље највећи део неона напустио њену атмосферу те су остали тежи изотопи 21Ne и 22Ne.
У врло малим количинама, неон се јавља и у саставу стена. Доказан је у саставу гранита, базалтних стена, дијаманта и вулканских гасова. Због различитог удела његових изотопа сматра се да овај неон има три различита извора настанка: примордијални неон, чији изотопни састав одговара оном на Сунцу те је заробљен у дијамантима или у Земљином плашту без контакта са атмосфером, затим атмосферски неон, те неон који је настао путем реакција спалације космичким зрачењем.
На гасовитим планетама попут Јупитера, неон не може побећи у свемиру због велике гравитације, тако да тамо изотопски састав неона одговара оном из времена стварања планета. Према подацима са свемирске сонде Галилео, однос удела изотопа 20Ne према 22Ne одговара оном на Сунцу, што даје назнаке о условима при којима су настале планете.
Референце
Спољашње везе
- Neon at The Periodic Table of Videos (University of Nottingham)
- WebElements.com – Neon.
- It's Elemental – Neon
- USGS Periodic Table – Neon
- Atomic Spectrum of Neon
- Neon Museum, Las Vegas
This article uses material from the Wikipedia Српски / Srpski article Неон, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Садржај је доступан под лиценцом CC BY-SA 4.0 осим ако је другачије наведено. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Српски / Srpski (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.


