Penicilin
Penicilini su grupa beta-laktamskih antibiotika koji se koriste u lečenju infekcija izazvanih bakterijama.
Na dejstvo penicilina osetljivi su prevashodno Gram-pozitivni patogeni, dok je jedan broj polusintetskih penicilina efikasan i protiv Gram-negativnih bakterija. Prirodni penicilini su proizvod metabolizma gljivica iz roda Penicillium. Njihovo antibakterijsko dejstvo prepoznao je Aleksandar Fleming 1928. godine, ali su prvi penicilini u široku kliničku primenu ušli tek tokom i nakon završetka Drugog svetskog rata. I danas se široko upotrebljavaju, ali njihov terapijski značaj polako opada, dobrim delom usled rastuće učestalosti pojave rezistentnih sojeva.
Istorija
Otkriće penicilina
Mada se otkriće penicilina konvencionalno pripisuje Flemingu i opisuje kao jedna od najvećih slučajnosti u istoriji nauke, lekoviti učinak pojedinih gljivica bio je poznat i veoma starim kulturama gde su biljke i pojedine plesni korišćene u empirijskoj terapiji, odnosno najčešće za previjanje rana u sprečavanju razvitka infekcije.
Sa razvojem mikrobiologije počela je da se učvršćuje i veza između pojedinih gljivica i njihovog antibakterijskog učinka. Niz britanskih istraživača objavilo je nalaze po kojima prisustvo plesni u bakterijskim kulturama efektivno inhibira rast bakterija. Među prvima je bio Džon Skot Burdon-Senderson čiji su nalazi iz 1870. postali osnova za dalje istraživanje Listera i Tindala. Tindal je 1875. pred Kraljevskim društvom objavio nalaze o baktericidnom učinku izvesne vrste roda Penicillium, koja je, po njemu, činila da bakterije pucaju. Paster je u Francuskoj dve godine kasnije objavio slične nalaze o antibakterijskom učinku gljivica iz roda Penicillium na bacile antraksa.
U periodu nakon otkrića penicilina posebno je u Francuskoj došlo do izražaja prepoznavanje ranijeg rada Ernesta Dišena na potencijalnoj terapijskoj primeni spomenutih plesni. Dišen je 1897. završio doktorsku disertaciju koja se bavila proučavanjem evolutivne kompeticije i antagonizma između bakterija i gljivica. Dišen je u njoj opisao baktericidan učinak vrste Penicillium glaucum na E. coli in vitro, a zatim i dao rezultate in vivo ispitivanja antibakterijskog učinka ove gljivice. Dišen je dao nizu eksperimentalnih životinja potencijalno smrtonosnu dozu kulture bacila tifusa, a zatim im je inokulisao neprečišćenu kulturu spomenute gljivice, što bi dovodilo do izlečenja životinja. Dišen, međutim, nije tvrdio postojanje specifične antibakterijske supstance koju produkuje gljivica, već je samo zabeležio njen antagonizam prema bakterijama. U ovo vreme, on je imao samo 23 godine i bio je nepoznat u naučnim krugovima što je doprinelo da Institut Paster zanemari njegovu tezu. Dišen je u poslednjem pasusu svoje teze naznačio da dodatno istraživanje ove pojave može dovesti do otkrića drugih osobina plesni od značaja za njihovu profilaktičku i terapijsku primenu, ali ova istraživanja nikada nije sproveo jer je postao angažovan kao vojni lekar, da bi 1904. zadobio izvesno plućno oboljenje (neki izvori kažu da je reč o tuberkulozi), od posledica koga je umro 1912, u 37. godini života. Mada relevantan, Dišenov rad nikada nije predvideo postojanje samih penicilina, a kako je kasnije i konstatovano da prirodni penicilini ne pokazuju aktivnost protiv izazivača tifusa, ostaje pitanje prirode same supstance koja je u Dišenovom radu dovela do izlečenja zamoraca.

U semptebru 1928. Fleming je tokom uobičajenog labaratorijskog rada uočio jednu Petrijevu šolju sa kulturom stafilokoka koja je postala kontaminirana plavičastozelenkastom plesni. Fleming je uočio i zabeležio pojavu zone inhibicije rasta bakterija u okolini plesni, navodeći uočljivo svetlije područje u kojem dolazi do lize bakterija. Fleming je zatim izolovao čistu kulturu gljivice koja je identifikovana kao Penicillium notatum, a ova kultura poslužila je za pravljenje sekundarnih kultura sve do 1945. godine, pri čemu su kasnija uporedna testiranja američkih naučnika pokazala da od svih do tada izolovanih plesni roda Penicillium, ova pokazuje treće po jačini antibakterijsko dejstvo. Fleming je dalje pretpostavio da gljiva luči izvesnu supstancu koja deluje slično lizozimu (koji je identifikovao šest godina ranije), i za koju je skovao naziv penicilin. Fleming je postulirao da je ta supstanca difundovala kroz podlogu i da je ona odgovorna za antibakterijsku aktivnost gljivice.
O poreklu plesni koja je kontaminirala spomenutu kulturu postoji više teorija, mada se čini najverovatnijim da je spora vazduhom dospela iz mikološke laboratorije koja se nalazila u podrumu ispod Flemingove laboratorije do otvorene kulture stafilokoka. Mada se samo otkriće može okarakterisati kao slučajnost, Fleming se našao pred nizom naučnih problema. On je prepoznao potencijalne terapijske implikacije penicilina, mada je inicijalno bio zainteresovaniji za njegovu primenu u spravljanju selektivnih podloga za izolovanje bakterija kao što je Haemophilus influenzae. Važno je napomenuti da Fleming nije odmah posmatrao penicilin kao potencijalni sistemski antibakterijski agens, jer je u njegovo vreme to bio prilično dalek koncept. On ga je video prevashodno kao antiseptik. Prvi pokušaji izolovanja penicilina nisu bili preterano uspešni i obuhvatali su upotrebu filtrata tečne kulture, ali su prinos i čistoća bili na relativno niskom nivou. Nakon ispitivanja na miševima koja su se prvenstveno bavila procenom toksičnosti penicilina, Fleming 1931. prekida dalji rad, ubeđen da je penicilin isuviše nestabilan u organizmu da bi bio od terapijskog značaja kod ljudi. Ipak, 1934. godine je smanjenim intenzitetom nastavio istraživanje, istovremeno tražeći nekoga ko bi adekvatnije prečistio filtrate koje je upotrebljavao. Sa izuzetkom nekoliko ranih pokušaja primene kao antiseptika u previjanju inficiranih rana, Fleming nije sprovodio in vivo ispitivanja antimikrobnog učinka penicilina.
Rad na izolovanju čistog penicilina i prve primene
U periodu neposredno nakon otkrića, Fleming nije preduzimao značajnije pokušaje da in vivo pokaže antimikrobna svojstva penicilina. Ovo je značilo da pun potencijal penicilina nije odmah postao očigledan, pa je i rad na izolovanju njegove čiste forme gotovo celu treću deceniju 20. veka bio veoma usporen.
Kasnija istraživanja su pokazala da najraniji zapisi o uspešnoj kliničkoj primeni penicilina datiraju iz 1930. i 1931. Sesil Džordž Pejn, patolog koji je u to vreme radio u bolnici u Šefildu, uzgajao je kulture gljivice koju je Fleming izolovao, i naknadno dobijao, koristeći se sličnim metodama kao i Fleming, filtrate penicilina male čistoće. Prvi pokušaji njegove primene kao antiseptika u lečenju sikoza (vid bakterijskog folikulitisa) bili su neuspešni, pa je Pejn dalje pokušaje usmerio ka lečenju oftalmije neonatorum kod beba. Prema preživelim zapisima, prvi slučaj izlečenja bakterijske infekcije pomoću penicilina zabeležen je 25. novembra 1930. Pejn je uspešno izlečio još 2 bebe, i jednu odraslu osobu, dok kod petog pacijenta terapija nije bila uspešna. Pejn je uskoro napustio rad sa penicilinom, velikim delom zbog varijabilne efikasnosti ekstrakata i uopšteno malog interesovanja za penicilin u to vreme. Iz istog razloga svoje nalaze nikada nije objavio.
Krajem 1938. i početkom 1939. godine na Univerzitetu u Oksfordu okupljen je tim naučnika čiju su okosnicu činili Hauard Flori i Ernst Boris Čejn, a koji je počeo intenzivno da radi na prečišćavanju penicilina i ispitivanju njegovog sistemskog dejstva. Količine penicilina koji su uspeli da dobiju nisu, međutim, bile dovoljne da proizvedu značajne rezultate kod ljudi. Ipak, Flori i Čejn sa saradnicima uspešno su pokazali da je penicilin, primenjen miševima inficiranim streptokokama, efikasan i netoksičan sistemski antibakterijski agens. Publikacija ovih rezultata u maju 1940. označila je omasovljenje i intenziviranje napora na izolovanju potpuno čistog penicilina, njegovoj masovnoj proizvodnji i rešavanju strukture.
Prvi pacijent koji je uspešno izlečen primenom penicilina bila je En Miler obolela od diseminovane infekcije beta-hemolitičkim streptokokom koja je u to vreme bila letalna u ogromnom broju slučajeva. Njeni lekari, Džon Bamsted i Orvan Hes, 14. marta 1942. postali su prvi pojedinci koji su zabeležili uspešnu primenu penicilina kao sistemskog antimikrobnog hemoterapeutika kod ljudi.
Masovna proizvodnja
Iako su pionirski rad na izolovanju penicilina i njegovoj primeni kao antibiotika Flori i Čejn sproveli u Ujedinjenom Kraljevstvu, sa razbuktavanjem rata u Evropi, težište istraživanja mogućnosti masovne proizvodnje penicilina premestilo se u SAD. Norman Hitli, jedan od članova oksfordskog tima, i Hauard Flori su 1941. godine otputovali u Ameriku gde su uspešno razvili prvi značajniji pogon za proizvodnju penicilina u jednoj laboratoriji u gradiću Peorija, u Ilinoisu. Proizvodnja je konstantno usavršavana u cilju povećanja prinosa i smanjenja troškova dobijanja, pa se tako napustila upotreba plesni koju je prvobitno izolovao Fleming, jer je 1943. otkrivena druga, sa povoljnijim osobinama. Osim u Peoriji, nekoliko drugih laboratorija radilo je na proizvodnji penicilina, uključujući i farmaceutske kuće Merk i Fajzer, dok je čitav niz laboratorija bez uspeha pokušavalo da sintetski dobije penicilin. Do 1944. pripremljeno je oko 300 milijardi jedinica penicilina koje su stavljene na raspolaganje američkoj vojsci kao deo priprema za savezničko iskrcavanje na Normandiju.

Penicilin je igrao značajnu ulogu u smanjenju smrtnosti među ranjenicima u Drugom svetskom ratu. Bio je, međutim, veoma ograničeno dostupan, a trajnije postizanje terapijskih koncentracija je zahtevao učestalu primenu zbog njegovog kratkog vremena eliminacije. Proizvodnja penicilina nije bila dovoljna da podmiri rastuće potrebe, pa se ustanovila praksa prikupljanja urina pacijenata na terapiji; kako se penicilin u velikoj meri izlučuje u nepromenjenom obliku, prikupljeni urin se koristio za njegovu izolaciju i ponovnu primenu. Sa završetkom rata, penicilin je postepeno postajao sve dostupniji, a u proizvodnju se uključio niz farmaceutskih kompanija u Evropi i drugde, mada je po količini proizvedenog leka prednjačio američki Fajzer. Studije koje su se bavile usavršavanjem postupka nastavljene su i tokom dobrog dela 50-tih.
Doroti Hodžkin, začetnica rendgenske kristalografije, je 1945. rešila strukturu penicilina, što će kasnije omogućiti razvoj polusintetskih derivata. Iste godine je Flemingu, Floriju i Čejnu, za otkriće penicilina i njegovog lekovitog efekta kod različitih infektivnih bolesti, dodeljena Nobelova nagrada.
Struktura, hemijske osobine i SAR
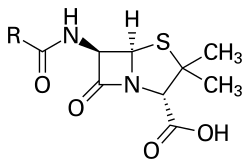
Svi penicilini, bilo prirodnog ili polusintetskog porekla, dele zajedničku strukturu koja se često naziva penicilinskim jezgrom. Kostur penicilinskog jezgra — penama — čini biciklični sistem koji se može posmatrati kao spregnut sistem dva heterociklusa: azetidinona i tiazolidina. Penicilini se često posmatraju i kao N-acil derivati 6-aminopenicilanske kiseline (6-APA). Struktura bočnog lanca u velikoj meri određuje stabilnost i osobine penicilina. 6-APA sadrži tri stereogena centra koji odgovaraju položajima 2, 5 i 6 i za koje je određena apsolutna konfiguracija. Tako se svi penicilini hemijski mogu označavati kao derivati (2S,5R,6R)-3,3-dimetil-6-amino-7-okso-4-tia-1-azabiciklo[3.2.0]heptan-2-karboksilne kiseline. U upotrebi je i nešto drugačiji sistem numeracije, ali su sistemski nazivi često preglomazni, pa se primarno koriste generički. Očuvanje naznačene stereohemije predstavlja uslov za dejstvo.
SAR studijama dodatno je utvrđeno da je za dejstvo neophodno prisustvo slobodne karboksilne grupe u položaju 2 (estarske prolek forme ne pokazuju aktivnost dok ne dođe do hidrolize), amida u položaju 6, kao i postojanje opisanog bicikličnog sistema, mada su moguće izosterne zamene sumpora, ali su ovakve modifikacije retke.
Najnestabilniji deo strukture penicilina je ß-laktamski prsten. Ovaj amid se nalazi pod velikim ugaonim i torzionim naponom jer je u četvoročlanom ciklusu, a dodatno je i karbonilni ugljenik, kao elektron deficitaran, aktiviran za napad nukleofila. Ovo je i posledica nemogućnosti učestvovanja slobodnog elektronskog para azota u rezonantnoj stabilizaciji strukture, jer bi rezultujući uglovi veza bili neodrživi. Vodeni rastvori su, pri sobnoj temperaturi, stabilni ali u alkalnoj sredini kao i u prisustvu jakih nukleofila (alkohola, amina) veoma lako dolazi do otvaranja prstena. U alkalnoj sredini nastaje peniciloinska kiselina (odnosno njeni acil derivati), koja može podleći daljoj metaboličkoj dekarboksilaciji. Ovi proizvodi ne pokazuju antimikrobnu aktivnost. Sa alkoholima ili aminima nastaju odgovarajući estri/amidi. Ove reakcije su od značaja za objašnjenje nastanka preosetljivosti na peniciline. Aktiviranost β-laktama kod penicilina za nukleofilni napad predstavlja i osnov osetljivosti na β-laktamaze koje reaguju kao jaki nukleofili. Uvođenje rezidua koje sterno ometaju pristup enzimu povećava stabilnost takvih penicilina na dejstvo beta-laktamaza.
Jedan broj penicilina nestabilan je i u kiseloj sredini u kojoj dolazi do degradacije penicilina do penicilamina i penaldinske kiseline (odnosno njenih acil derivata). Ovi proizvodi nemaju antimikrobnu aktivnost, mada penicilamin ima primenu kao imunosupresiv u lečenju reumatoidnog artritisa. Povećanje stabilnosti u kiseloj sredini može se postići uvođenjem dodatnih baznih centara ili elektron-privlačećih bočnih supstituenata koji smanjuju elektronsku gustinu u laktamskom prstenu. Ovakve modifikacije dozvoljavaju per os primenu penicilina. Benzilpenicilin, i drugi penicilini nestabilni u kiseloj sredini, pri pH koja odgovara želudačnoj sredini imaju poluživot od tek nekoliko minuta. Amidska grupa u položaju 6 takođe može podleći hidrolizi, ali ova reakcija, sa izuzetkom metaboličke transformacije pojedinih penicilina, nema značaja pri fiziološkom uslovima, a čini se ni značaja u razvitku rezistencije.
Degradacione reakcije u in vitro uslovima mogu se usporiti puferovanjem preparata i njihovim čuvanjem na nižim temperaturama. Čak i male koncentracije metalnih jona katalizuju razgradnju penicilina pa se bočice za čuvanje ili spremanje preparata za parenteralnu primenu izrađuju sa poklopcima od inertne plastike.
Lipofilnost bočne rezidue određuje i stepen vezivanja za proteine plazme, pri čemu penicilini sa lipofilnijim bočnim ostacima pokazuju veći afinitet prema proteinima plazme. Ipak, udeo vezanog oblika leka ne utiče na vreme eliminacije zbog postojanja transportnih mehanizama koji aktivno ekskretuju penicilin i eventualne metabolite u tubule bubrega. Utoliko je vreme eliminacije prevashodno određeno radom bubrega.
Pojedini penicilini imaju sposobnost da inaktiviraju aminoglikozide, reagujući kao acilujući agensi sa njihovim ekvatorijalnim hidroksilnim ili amino grupama. Mada je postojanje ovog vida interakcije jasno pokazano u in vitro uslovima, značajniji uticaj na uspešnost terapijskih režima koji obuhvataju istovremenu primenu penicilina i aminoglikozida može se ispoljiti samo kod pacijenata sa ugroženom funkcijom bubrega. Ovakve formulacije koje se koriste u lečenju težih infekcija izazvanih Gram-negativnim bakterijama sadrže najčešće neki ureidopenicilin i tobramicin radi postizanja sinergističkog efekta dva leka. Novija istraživanja pokazuju da se in vivo inaktivacija tobramicina, istovremeno primenjenog sa piperacilinom, ne odvija na značajnom nivou ni kod pacijenata sa oštećenjima bubrega, odnosno da je ova interakcija zanemarljiva.
Mehanizam dejstva
Penicilini spadaju u grupu antibiotika koji remete sintezu ćelijskog zida bakterije. Ćelijski zid je odgovoran za postojanost bakterijske ćelije u različitim uslovima sredine, a naročito je značajan u sprečavanju prekomernog bubrenja bakterije u hipotoničnoj sredini. Remećenje intregiteta ćelijskog zida bakteriju čini podložnu prekomernom ulasku vode, a konačan efekat jeste, uz nagomilavanje prekursora peptidoglikana, baktericidan. Bakterija puca, ili podleže lizi, a na dejstvo penicilina najosetljivija je u fazi deobe.
Penicilini se vezuju za grupu bakterijskih proteina karakterističnih po svom afinitetu prema penicilinu koji se zbog toga nazivaju i penicilin-vezujući proteini — PVP (engl. Penicillin-binding protein — PBP). Penicilin-vezujući proteini locirani su sa spoljašnje strane plazma membrane bakterija i obavljaju različite enzimske uloge, najčešće ponašajući se kao transpeptidaze, karboksipeptidaze ili endopeptidaze. Identifikovan je niz PVP, pri čemu postoje značajne varijacije u njihovoj sktrukturi između pojedinih bakterijskih vrsta, čime se objašnjava i različita efikasnost penicilina protiv različitih bakterija.
Od fundamentalnog značaja za dejstvo penicilina je ireverzibilna inhibicija transpeptidaza. Transpeptidaze, tokom normalnog procesa biosinteze ćelijskog zida, katalizuju uklanjanje jednog ostatka D-alanina iz peptida vezanog za N-acetilmuraminsku kiselinu što omogućava reakciju preostalog terminalnog D-alanina sa pentaglicinskim ostatkom obližnjeg peptida. Na ovaj način se formiraju unakrsne peptidne veze neophodne za stabilnost ćelijskog zida.
Aktivno mesto ovih transpeptidaza u potpunosti je prilagođeno acilovanom D-Ala-D-Ala dipeptidu. Serinska rezidua enzima reaguje kao nukleofil, raskida peptidnu vezu između dva alanina, pri čemu se jedan oslobađa a drugi ostaje u aktivnom mestu i reaguje sa pentaglicinskim ostatkom drugog peptida. Penicilini dele strukturnu a verovatno i konformacionu sličnost sa ovim dipeptidom, što im omogućava da interaguju sa aktivnim mestom. Serinska rezidua kao nukleofil reaguje sa beta-laktamom, pri čemu je on, kao posledica ciklične strukture, daleko reaktivniji od amidne veze peptidoglikanskih prekursora. Vezani penicilin, međutim, ne podleže dalje raskidanju svojih veza, čime nastala struktura ostaje intaktna. Ovime se penicilin trajno vezuje za enzim, jer je pristup pentaglicinskom lancu sterno sprečen, a voda, kao široko dostupan a sterno kompaktan molekul, nije dovoljno jak nukleofil da raskine formiranu estarsku vezu. Ireverzibilna inhibicija transpeptidaza ostvaruje dva efekta: rezultujući ćelijski zid je nestabilan zbog izostanka unakrsnih veza a povećana koncentracija peptidoglikanskih prekursora stimuliše sintezu bakterijskih autolizina. Kombinacija ova dva faktora dovodi do odumiranja bakterije.
Ovakvo objašnjenje mehanizma dejstva penicilina takođe objašnjava i njihovu selektivnu toksičnost. Naime, budući da je pretpostavka da konformacija penicilina odgovara aktivnim mestima transpeptidaza koje katalizuju reakcije D-aminokiselina, jasno je da penicilin neće reagovati sa transpeptidazama sisara, koje su prilagođene standardnim (L-) aminokiselinama.
Postoji, međutim, i alternativna, manje prihvaćena hipoteza o mehanizmu dejstva penicilina. Sintezom i određivanjem antibakterijske efikasnosti 6α-metilpenicilina došlo se do otkrića da ovo jedinjenje, mada strukturno sličnije D-Ala-D-Ala dipeptidu, pokazuje znatno slabije antibakterijsko dejstvo od samih prirodnih penicilina i njihovih derivata. Na osnovu ovih nalaza, formulisana je pretpostavka da penicilini ne konkurišu zapravo za aktivno mesto transpeptidaza, već da se vezuju, reagujući sa nukleofilom, za neki blizak domen na proteinu i da sterno (po „kišobran“ mehanizmu) sprečavaju pristup prirodnog supstrata enzimu.
Penicilini se vezuju za čitav spektar PVP koje jedna bakterija eksprimira. Međutim, vezivanje tek za neke od ovih proteina uzrokuje smrt bakterije, dok vezivanje za druge u manjoj ili većoj meri menja njenu funkcionalnost ili morfologiju. Svaki penicilin ima sopstveni aranžman afiniteta prema različitim PVP kojim je i određena njegova efikasnost protiv date bakterije. U nekim slučajevima se tek veoma mala frakcija leka vezuje za PVP čija inhibicija daje baktericidan rezultat.
Biosinteza penicilina

Penicilin je produkt metabolizma malog broja filamentoznih gljiva, među kojima su najpoznatije Penicillium chrysogenum i Aspergillus (Emericella) nidulans.
U sintezi penicilina učestvuje tri enzima - ACVS (δ-(L-α-aminoadipil)-L-cisteinil-D-valin sintetaza), IPNS (izopenicilin N sintetaza) i IAT (acil-koenzim A:izopenicilin N aciltransferaza). ACVS katalizuje sintezu ACV tripeptida od početnih metabolita — L-α-aminoadipske kiseline, L-cisteina i D-valina. IPNS katalizuje stvaranje prstena unutar ACV tripeptida čime kao produkt nastaje izopenicilin N. Ove reakcije se odvijaju u citoplazmi. Treći enzim (IAT) smešten je u mikrotelašcima gde katalizuje prenos acil grupe na izopenicilin N.
Enzimi sinteze penicilina su produkti gena acvA (pcbAB), ipnA (pcbC) i aatA (penDE), koji su fizički organizovani u genske klastere na istom kromosomu. Kod različitih vrsta gljiva ovaj genski klaster se nalazi na različitom kromosomu.
Iako produkcija penicilina kao sekundarnog metabolita nije od životnog značaja za preživljavanje gljiva, određeni ekološki faktori (faktori staništa) utiču na regulaciju ekspresije pomenutih gena, npr. kiselost podloge i količina hranljivih materija.
Proizvodnja
Rad na razvitku efikasnog načina proizvodnje velikih količina penicilina ujedno je bio i prekretnica u razvitku industrijskih tehnika proizvodnje antibiotika. Ovo je u dobroj meri zasluga Florija i Hitlija, mada su različite studije o poboljšanju prinosa penicilina i uslovima u fermentacionim smešama sprovodili i drugi naučnici tokom 50-tih godina 20. veka.
Proces proizvodnje obuhvata sledeće. U velike rezervoare stavljaju se medijumi rasta (često se naziva i podloga), koji su suštinski supstance koje favorizuju rast izabrane plesni. U slučaju penicilina to je najčešće Penicillium notatum. Uslovi u ovim rezervoarima se pažljivo kontrolišu: za uspešno završen proces kao i povoljan prinos potrebno je konstantno održavati optimalnu temperaturu, koncentracije hranljivih sastojaka i kiseonika, kao i pH. Kako su antibiotici sekundarni metaboliti, pažljivo regulisanje veličine populacije je takođe od presudnog značaja. Nakon završene fermentacije, pristupa se izolovanju penicilina iz rastvora, njegovom prečišćavanju, i naknadnoj, ukoliko je to potrebno, hemijskoj modifikaciji.
Džon Šinan je 50-tih godina potpunom sintezom uspešno dobio pojedine prirodne peniciline i njihove analoge. Međutim, dobijanje penicilina potpunom sintezom, između ostalog i zbog specifične stereohemije molekula, nije praktično niti ekonomski opravdano, pa se ne koristi u proizvodnji.
Polusintetski penicilini dobijaju se dejstvom odgovarajućih kiselinskih halogenida, anhidrida ili sličnih reagenasa, na 6-aminopenicilansku kiselinu. Mada se 6-APA može dobiti fermentacijom, prinosi nisu značajni a dobijanje komplikovano, pa se kao polazna sirovina koristi benzilpenicilin, ređe fenoksimetilpenicilin, kontrolišući uslove u fermentacionoj smeši tako da se taj penicilin dobije u velikom višku. Na benzilpenicilin se deluje penicilin-amidazama bakterijskog porekla koje vrše njegovu selektivnu hidrolizu do 6-APA. Ovaj proces je 1959. prva razvila i patentirala farmaceutska kompanija Bičam uz upotrebu deacilaza dobijenih od bakterije Streptomyces lavendulae. Od tada je otkriven niz drugih deacilaza.
Prirodni penicilini
Prirodni penicilini proizvod su mikroorganizama i dobijaju se fermentacijom. U prirodne penciline ubrajaju se penicilin G, V, F, K i X, ali značajniju kliničku primenu imaju samo prva dva predstavnika. Kao posledica slabog prolaženja kroz njihov ćelijski zid, za prirodne peniciline se smatra da nisu efikasni protiv Gram-negativnih bakterija.
Benzilpenicilin (penicilin G)


Benzilpenicilin je prvi penicilin koji je uveden u terapiju. Po uvođenju, pokazivao je do tada nezabeleženo dobre rezultate u borbi protiv Gram-pozitivnih bakterija, posebno protiv stafilokoka, streptokoka, ali i Gram-negativnih najserija. Nestabilan je u kiseloj sredini želuca u kojoj obilno degradira i ima poluživot od tek nekoliko minuta. Primenjen peroralno, ima bioraspoloživost od tek 15%, pa se primenjuje isključivo parenteralno. Za intravensku primenu koriste se kalijumova ili natrijumova so. Benzilipenicilin se, međutim, renalnim putem iz organizma izlučuje izuzetno brzo, sa vremenom poluživota od oko 45 minuta. Pristup produženju dejstva inicijalno je podrazumevao istovremenu oralnu primenu probenicida, koji smanjuje efikasnost tubularne ekskrecije penicilina konkurišući za ista mesta ovog sistema aktivnog transporta. Slično je moguće primeniti i jako velike doze penicilina, jer je lek gotovo potpuno netoksičan.
Ipak, za postizanje terapijskih koncentracija penicilina u plazmi na duži vremenski period koriste se veoma nerastvorne soli benzilpenicilina sa organskim bazama: prokain-benzilpenicilin i benzatin-benzilpenicilin. Ove soli predstavljaju depo oblike benzilpenicilina — po intramuskularnoj primeni postepeno se oslobađaju iz tkiva i prelaze u sistemsku cirkulaciju. Primenom prokain-benzilpenicilina smanjuje se i bol prilikom aplikacije zbog anestetičkog dejstva prokaina, a inhibitorne koncentracije u krvi održavaju se i 24 časa nakon primene. Benzatin-benzilpenicilin se oslobađa daleko sporije, ali su i odgovarajuće koncentracije u plazmi niže; benzilpenicilin je moguće detektovati u plazmi i 12 nedelja nakon primene samo jedne doze od milion i.j. benzatin-benzilpenicilina. Terapijske doze se pak održavaju samo 2-4 nedelje.
Oko jedna trećina benzilpenicilina koja dospe u sistemsku cirkulaciju podleže reakcijama metaboličke biotransformacije koje obuhvataju različite hidrolitičke i oksidacione reakcije. Metaboliti su inaktivni, sa izuzetkom p-hidroksibenzilpenicilina (proizvod aromatične oksidacije), koji ispoljava antimikrobnu aktivnost.
Pojavom rezistentnih sojeva, klinički značaj benzilpenicilina počeo je da se smanjuje. Veoma je osetljiv na dejstvo beta-laktamaza, pa je često neophodno uraditi ispitivanje osetljivosti izolovane bakterije. Pojedini sojevi su umereno tolerantni na benzilpenicilin, i kod njih se minimalna inhibitorna koncentracija (MIK) povećava sa uobičajenih 0,02 mg/l na 0,1–1 mg/l, ali je željeni terapijski efekat moguće postići povećanjem doza. Sojevi sa većom MIK od naznačene (1 mg/l) tipično ne odgovaraju na terapiju benzilpenicilinom.
Iako je učestalost izolovanja rezistentnih sojeva u porastu, benzilpenicilin se i danas, zbog svoje pristupačnosti i dobre efikasnosti, smatra lekom izbora za umereno-teške infekcije donjih i gornjih disajnih puteva kao i kod urogenitalnih infekcija. Izuzetak su infekcije koje izazivaju Staphylococcus aureus i Staphylococcus epidermidis koji su gotovo uvek rezistentni na benzilpenicilin.
Indikacije za primenu benzilpenicilina (kao prokain-benzilpenicilina) obuhvataju:
- Infekcije izazvane β-hemolitičkim streptokokama grupe A: tonzilitis, faringitis, šarlah, upala srednjeg uha, celulitis, sinusitis;
- Streptokokne infekcije kod novorođenčeta: pneumonija, meningitis, sepsa;
- Sifilis
- Meningitis (N. meningitidis)
- Nekomplikovani slučajevi gonoreje
- Lajmska bolest
- Streptokokni endokarditis
- Profilaksa u predoperativnom toku
- Dopunska terapija kod antraksa
Primena benzatin-benzilpenicilina indikovana je u slučajevima kada je potrebno duži period održavati niže koncentracije leka u organizmu. Njegova terapijska primena je veoma ograničena. Koristi se u profilaksi reumatoidne groznice, i kod rano dijagnostifikovanog sifilisa.
Fenoksimetilpenicilin (penicilin V)

Fenoksimetilpenicilin je stabilniji od benzilpenicilina u želudačnoj sredini pa se daje per os. Povećana stabilnost u kiseloj sredini objašnjava se negativnim induktivnim efektom fenoksi grupe koja doprinosi smanjenju elektronske gustine u laktamskom prstenu. Oko 60-70% oralno primenjenog leka biva apsorbovano u nepromenjenom obliku, a veći deo se vezuje za proteine plazme. Jedan deo leka koji dospe u sistemsku cirkulaciju podleže metaboličkim reakcijama oksidacije i hidrolize, dok se drugi deo izlučuje u nepromenjenom obliku. Vreme eliminacije je nešto duže nego kod penicilina G, ali fenoksimetilpenicilin pokazuje slabiju antibakterijsku aktivnost.
Penicilin V ima približno isti spektar dejstva kao i penicilin G, a podjednako je i osetljiv na dejstvo beta-laktamaza. Fenoksimetilpenicilin se ne primenjuje kod teških akutnih infekcija, bez obzira na podložnost bakterije, jer su stepen apsorpcije i koncentracije u plazmi veoma varijabilne, a terapijske koncentracije se u tkivima zadržavaju relativno kratko. U tom slučaju je moguće uvesti terapiju fenoksimetilpenicilinom nakon započete terapije benzilpenicilinom koja je dovela do zadovoljavajućeg efekta na infekciju. Ne daje se kod gonokoknih ili meningokoknih infekcija. Indkikacije za primenu fenoksimetilpenicilina obuhvataju:
- Infekcije izazvane streptokokom grupe A
- Tonzilitis
- Faringitis
- Upala srednjeg uha (akutna)
- Kožne infekcije (celulitis, crveni vetar)
- Profilaksa reumatoidne groznice
- Profilaksa pneumokoknih infekcija
Penicilin V se smatra lekom izbora kod nekomplikovanih streptokoknih infekcija ždrela, mada nije izvesno da li je antibiotska terapija u takvim slučajevima uopšte prikladna. U slučaju primene, terapija mora trajati 10 dana.
Rezistentnost
Prvi slučajevi rezistencije na peniciline zabeleženi su 1940. i 1944. Dimenzije ove pojave u početku nisu bile predmet zabrinutosti, ali je vremenom problem rezistentnih sojeva postao veoma značajan, a učestalost njihove pojave sve veća. Primera radi, po uvođenju u terapiju, benzilpenicilin je gotovo univerzalno bio efikasan protiv bakterije Staphylococcus aureus, dok danas čak 95% izolovanih sojeva pokazuje rezistenciju na ovaj antibiotik.
Mehanizmi razvitka rezistenicije su brojni, ali je najučestaliji uzrok stečena sposobnost bakterija da luče enzime — beta-laktamaze. Izolovan je veliki broj ovih enzima sa različitim afinitetom za različite beta-laktamske antibiotike, pa se po ovom kriterijumu beta-laktamaze sa visokim afinitetom prema penicilinima nazivaju i penicilaze. Beta-laktamaze strukturno su sliče membranskim transpeptidazama; to su proteaze sa serinskom reziduom koja reaguje kao nukleofil, otvara beta-laktamski prsten penicilina ali uz sposobnost oslobađanja nastalih peniciloinskih kiselina (koje ne pokazuju antimikrobnu aktivnost). Ovo znači da samo jedna molekula enzima može da inaktivira veliki broj molekula penicilina, i to brzinom i do 1000 molekula u sekundi, kod veoma rezistentnih sojeva. Rezistentne Gram-pozitivne bakterije konstantno sintetišu ovaj enzim i oslabađaju ga u spoljnu sredinu, kroz koju on difunduje, razarajući peniciline sa kojima dođe u kontakt. Za razliku od ovog mehanizma, koji uslavljava relativno male koncentracije enzima u okolini bakterije, kod Gram-negativnih bakterija beta-laktamaze se oslobađaju u periplazmatski prostor, između citoplazme i ćelijskog zida bakterije, u kojem se zadržavaju u velikoj koncentraciji jer je spoljašnja membrana za njih nepropustljiva. I jedan i drugi mehanizam predstavljaju prepreku za peniciline da u intaktnom obliku stignu do mesta dejstva — transpeptidaza na spoljašnjoj strani plazma membrane. Ovaj vid rezistencije je najčešće ekstrakromozomskog porekla, i vezuje se za prisustvo R plazmida. Ovo za posledicu ima i lako širenje rezistencije kroz bakterijsku populaciju procesima transdukcije i konjugacije. Produkcija beta-laktamaza je uglavnom inducibilna, dok mali broj bakterija, prevashodno anaeroba, bazično produkuje beta-laktamaze.
Rezistencija se može javiti i kao posledica modifikacije strukture penicilin-vezujućih proteina. Strukturne promene PVP su uglavnom posledica spontanih mutacija na kromosomskim lokusima koji determinišu njihovu građu. Ovakve promene uzrokuju smanjen afinitet penicilina za dati PVP što za posledicu može imati, ukoliko se radi o PVP koji je povezan sa letalnim efektima, značajno smanjenu efikasnost antibiotika. Tako se kod meticilin-rezistentnih sojeva S. aureus (MRSA) javljaju promene u strukturi PVP koje uslovljavaju rezistenstnost na meticilin, a koji nije osetljiv na beta-laktamaze. Međutim, dok beta-laktamaze mogu uzrokovati rezistentnost na čitav spektar antibiotika, promene u građi PVP uglavnom ne utiču na efikasnost velikog broja struktura.
Dodatno, promene u permeabilnosti ćelijskog zida mogu takođe biti uzrok rezistencije jer ne dozvoljavaju prodor penicilina do ćelijske membrane. Smanjena količina penicilina dostupnog za inhibiciju transpeptidaza može biti i posledica prisustva posebnih mehanizama koji aktivno transportuju penicilin kroz ćelijski zid u spoljašnju sredinu. Kombinacija navedenih faktora može dati bakteriju koja je potpuno otporna na dejstvo svih penicilina.
Dalji razvoj penicilina
Iako senzacija u početku, neke od realnih mana prvobitnog penicilina ubrzo su postale očigledne. Relativno uzak spektar dejstva, kao i slaba aktivnost oralnog oblika penicilina — fenoksimetilpenicilina — usmerili su istraživače ka proširenju spektra kao i oralne bioraspoloživosti penicilina.
Rad na razvitku polusintetskih penicilina omogućen je otkrićem strukture penicilinskog jezgra, kao i različitim studijama koje su se bavile optimizacijom uslova u fermentacionim smešama u cilju povećanja prinosa željenog penicilina. Ubrzo se došlo do zaključka da je variranjem bočnog ostatka moguće dobiti peniciline sa povoljnijim osobinama od prirodnih. Prvi polusintetski penicilin koji je ušao u terapijsku primenu bio je feneticilin, blizak strukturni srodnik fenoksimetilpenicilina, koji je ubrzo praćen propicilinom. Međutim, ova dva penicilina nisu pokazivali značajno superiornije osobine od penicilina V, pa njihov klinički značaj nikada nije bio veliki.
Prvi značajan napredak odigrao se sintezom i prepoznavanjem potencijala aminopenicilina. Ampicilin je sintetisan 1961. i prvi je ušao u upotrebu. Stabilan je pri peroralnoj primeni, a spektar dejstva mu je proširen prema pojedinim Gram-negativnim bakterijama. Amoksicilin je uveden u terapiju gotovo deceniju kasnije; strukturno je veoma sličan ampicilinu, sa dodatkom fenolne grupe, ali je po osobinama značajno povoljniji. Ima isti spektar dejstva, ali ne izaziva neželjene efekte po gastrointestinalni trakt, ima za oko 30-35% bolju bioraspoloživost (i do 90% doze biva apsorbovano) i nešto duže vreme eliminacije. Ovo su i danas terapijski značajni penicilini.
Paralelno sa sintezom aminopenicilina, tekla je i sinteza penicilina za koje je pokazano da su rezistentni na dejstvo beta-laktamaza. Meticilin je sintetisan 1960. godine, a prvi izoksazol penicilini (oksacilin i kloksacilin) 1962, dok su dikloksacilin i flukloksacilin sintetisani nekoliko godina kasnije. Meticilin se primenjivao parenteralno kod infekcija sojevima koji luče beta-laktamazu, ali su ga naknadno zamenili flukloksacilin i dikloksacilin koji se, pored otpornosti na β-laktamazu, mogu primenjivati i peroralno. Penicilini iz ove grupe koriste osetljivost beta-laktamaza na bočne sterne smetnje i tako sprečavaju pristup enzimu, onemogućavajući inaktivaciju leka.
Karbenicilin bio je prvi penicilin efikasan protiv bakterije Pseudomonas aeruginosa, mada su njegovi rezultati u borbi protiv ovog patogena bili varijabilni i često nedovoljni. Uveden je upotrebu 1967. godine. Kasnijom sintezom ureidopenicilina (azlocilin, mezlocilin), piperacilina i tikarcilina (kao naslednika karbenicilina), znatno je proširen broj penicilina efikasnih protiv Gram-negativnih izazivača infekcija. Ovi terapeutici imaju polarne bočne rezidue koje uslovljavaju proširen spektar, i primenjuju se isključivo parenteralno.
Sintezom tikarcilina i piperacilina, rad na daljem razvitku penicilina izgubio je na intenzitetu. Poboljšanje terapeutskih mogućnosti ovih lekova iscrpljeno je, a istraživanje cefalosporina i karbapenema dobijalo je na značaju znatno većim tempom, dobrim delom i zahvaljujući saznanjima stečenim u radu sa penicilinima.
Polusintetski penicilini
Varijacijama u strukturi bočnog lanca — acil supstituenta penicilinskog jezgra — moguće je postići različite promene u osobinama penicilina — spektru njihovog dejstva, farmakokinetičkim parametrima i osetljivosti na dejstvo beta-laktamaza. Dobijen je niz polusintetskih penicilina, ali značajniju ulogu u kliničkom okruženju ima oko desetak predstavnika. Dole je dat nepotpun spisak polusintetskih penicilina, grupisanih po izvesnim zajedničkim osobinama.
Aminopenicilini
Ovo su penicilini proširenog spektra, prigodni za per os primenu, ali osetljivi na dejstvo penicilaza. Rastvorne soli mogu se primenjivati i parenteralno, kod težih infekcija.
- Ampicilin
- Prolek forme ampicilina, razvijene u cilju poboljšanja bioraspoloživosti:
- Amoksicilin
- Epicilin
Penicilini sa inhibitorima beta-laktamaze
Sa pojavom sojeva koji luče beta-laktamaze, terapijska vrednost pojedinih penicilina znatno je smanjena jer više nisu pokazivali dobre rezultate protiv intrinsički podložnih bakterija. Zato su razvijene formulacije koje kombinuju penicilin sa inhibitorom beta-laktamaze — strukturom koja se koja se kompetitivno vezuje za ovaj enzim i značajno smanjuje udeo penicilina koji biva inaktiviran pre nego što dospe do mesta delovanja. Ove formulacije su efikasne u terapiji jer dozvoljaju ispoljavanje svih pozitivnih osobina penicilina, premošćavajući stečenu rezistentnost bakterije:
- Amoksicilin + klavulanska kiselina
- Ampicilin + sulbaktam
- Tikarcilin + klavulanska kiselina
- Piperacilin + tazobaktam
Beta-laktamaza rezistentni penicilini uskog spektra
Ovi penicilini poseduju specifičnu strukturu koja sterno onemogućava pristup penicilazama beta-laktamskom prstenu, tako štiteći lek od inaktivacije. Meticilin danas nije od terapijskog značaja, a i druge predstavnike ove grupe polako zamenjuju cefalosporini.
- Meticilin (samo parenteralno)
- Izoksazol penicilini — stabilniji su u kiseloj sredini pa se mogu primenjivati i peroralno, obilno se vezuju za proteine plazme:
- Temocilin (samo protiv Gram-negativnih bakterija)
Penicilini šireg spektra
Ovo su parenteralni penicilini sa proširenim spektrom ka Gram-negativnim bakterijama. Osetljivi su na dejstvo beta-laktamaza.
- Karbenicilin
- Karindacilin (prolek karbenicilina)
- Tikarcilin
- Ureidopenicilini
Neželjeni efekti
Penicilini su, uopšteno govoreći, supstance veoma niske toksičnosti, i smatraju se, osim kod preosetljivih pojedinaca, jednim od bezbednijih dostupnih antibiotika.
Ipak, njihovom primenom, kao i primenom bilo kog drugog leka, moguća je pojava neželjenih efekata. Oralno primenjeni penicilini proširenog spektra mogu dovesti do blagih poremećaja u normalnoj flori creva, i posledične dijareje; mogu se javiti i mučnina ili povraćanje ali su sva ova stanja samoograničavajuća i nestaju ubrzo nakon prekida terapije. Zabeležena je i pojava kolitisa kao posledica antibiotske terapije oralnim penicilinima, ali je ovo izuzetno retka komplikacija. Primena aminopenicilina može dovesti i do poremećaja u flori ždrela ili vagine, što u nekim slučajevima pogoduje razvitku gljivične superinfekcije, pa se kod manjeg broja pacijenata na terapiji može javiti kandidijaza.
Kod primene jako velikih doza penicilina G, naročito kod pacijenata sa smanjenom bubrežnom funkcijom, postoji rizik od pojave encefalopatije. Ovakav toksičan efekat penicilina veoma je redak pri standardnim terapijskim dozama. Izoksazolpenicilini mogu ispoljavati izvesne hepatotoksične i nefrotoksične efekte.
Specifični penicilini mogu ispoljavati i dodatne neželjene efekte, ali je generalno, pored navedenog, opisana i pojava (sa malom učestalosti) intersticijalnog nefritisa i hematoloških poremećaja (leukopenije, posebno kod ampicilina i flukloksacilina, hemolitička anemija, trombocitopenija, poremećaji koagulacije).
Preosetljivost
Preosetljivost na peniciline javlja se kod 1-10% pacijenata. Anafilaktički šok, kao najozbiljnija reakcija preosetljivosti, je daleko manje učestao i javlja se tek kod 1-5 pacijenata na 10.000 onih kojima je terapija propisana (0,05%). Anifalaksa je potencijalno letalna pa se visoke doze parenteralno primenjivanog penicilina moraju davati samo u ambulantnim ili kliničkim uslovima, jer se pacijentu hitno moraju primeniti adrenalin i osigurati prohodnost disajnih puteva u slučaju pojave anafilaktičke reakcije. Atopičari (pojedinci sa istorijom preosetljivosti na druge agense — polen, hranu...) imaju veći rizik za razvitka ovakvih reakcija. Predviđanje reakcija preosetljivosti na peniciline je veoma teško, i istorija ranijih reakcija predstavlja najpouzdaniji parametar, mada postoje reagensi za izvođenje kožnih proba.
Reakcije kasne preosetljivosti životno ne ugrožavaju pacijenta na terapiji, ali su indikativne i mogu dovesti do dodatne senzibilizacije organizma i intenzivnijih reakcija u budućnosti. Ogledaju se u pojavi eritema, povišene temperature, bolova u zglobovima i osipa po različitim delovima tela. Osipi mogu biti različitog karaktera a učestaliji su kod primene polusintetskih penicilina, naročito ampicilina i amoksicilina. Pojava osipa više od 72 časa nakon primene penicilina može da ukazuje da osip nije posledica preosetljivosti, pa istorija pojave ovakvih osipa nije nužno kontraindikacija za buduću primenu penicilina, ali je dodatan obzir neophodan.
Sami penicilini su mali molekuli i nisu imunogeni, odnosno predstavljaju haptene. Međutim, u reakciji sa nukleofilnim grupama proteina domaćina, penicilin i dati protein grade antigen koji može izazvati reakciju imunskog sistema. Alternativno, u samoj fermentacionoj smeši može doći do reakcije penicilina i prisutnih proteina, a moguće je i povezivanje samih penicilina uz građenje polimernih nečistoća velike molekulske mase koje takođe predstavljaju alergene. Po prvom izlaganju dolazi do senzibilizacije organizma, dok ponovljena izlaganja dovode do intenzivnih reakcija imunskog sistema posredovanih IgE antitelima. Prisustvo polimernih nečistoća češće je u koncentrovanim preparatima, pa se formulacije za parenteralnu primenu moraju čuvati na hladnom, a rekonstituisani praškovi se moraju primenjivati bez odlaganja i ne smeju čuvati za naknadnu primenu.
Kod 90% pacijenata koji boluju od infektivne mononukleoze javlja se pojava osipa kao reakcija na primenu polusintetskih penicilina, naročito amoksicilina. Slično se dešava i kod infekcija citomegalovirusima. Mehanizam pojave ovih reakcija nije poznat.
Smatra se, na osnovu niza studija, da je 5-10% pojedinaca alergičnih na peniciline unakrsno preosetljivo i na cefalosporine, ali postoje studije koje tvrde da je učestalost alergijskih reakcija na cefalosporine kod pacijenata sa istorijom preosetljivosti na peniciline tek neznatno veća u odnosu na celokupnu populaciju. Smatra se da su ovakve unakrsne reakcije posledica sličnosti u jezgru strukture svih beta-laktama. Zbog ozbiljnosti potencijalnih neželjenih reakcija, kod pacijenata sa istorijom reakcija preosetljivosti na peniciline za koje se sumnja da su posredovane IgE antitelima, kao i kod pacijenata kod kojih je kožnim probama utvrđena preosetljivost na neki penicilinski reagens, primena cefalosporina se ne savetuje. Međutim, veliki deo pacijenata sa alergijom na peniciline nije alergično i na druge beta-laktame, pa ukoliko su dostupni specifični reagensi za kožne probe, npr. cefalosporinski, a rezultati testiranja negativni, primena drugih beta-laktama potpuno je opravdana jer je kod takvih pacijenata rizik od razvitka teških reakcija preosetljivosti minimalan. Novija istraživanja pojedinih autora, pak, tvrde da taj rizik gotovo i ne postoji prilikom primene cefalosporina druge ili kasnijih generacija, čak ni kod onih alergičnih na peniciline. Naime, rezultati novijih ispitivanja pokazuju da je unakrsna reaktivnost pre posledica sličnosti u strukturama bočnih lanaca penicilina i cefalosporina prve generacije, nego u strukturi beta-laktamskog jezgra ovih antibiotika. Nesigurnosti doprinosi činjenica da antigenske determinante cefalosporina nisu utvrđene.
Reference
Napomene
Vidi još
Vanjske veze
- Model of Structure of Penicillin, by Dorothy Hodgkin et al., Museum of the History of Science, Oxford Arhivirano 2009-03-27 na Wayback Machine-u
- The Discovery of Penicillin, A government produced film about the discovery of Penicillin by Sir Alexander Fleming, and the continuing development of its use as an antibiotic by Howard Florey and Ernst Boris Chain.
- Penicillin at The Periodic Table of Videos (University of Nottingham)
- Penicillin Released to Civilians Will Cost $35 Per Patient Popular Science, August 1944, article at bottom of page
This article uses material from the Wikipedia Srpskohrvatski / Српскохрватски article Penicilin, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Sadržaj je dostupan pod CC BY-SA 4.0 osim ako je drugačije navedeno. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Srpskohrvatski / Српскохрватски (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.
