Sars-Cov-2: Virus
SARS-CoV-2 je taxonomický ráz či vnitrodruhový klad virového druhu s mezinárodním taxonomickým názvem Severe acute respiratory syndrome-related coronavirus.
Jedná se o RNA koronavirus, který způsobuje onemocnění covid-19, jež bylo poprvé pozorováno na konci roku 2019 v čínském městě Wu-chan. Nyní je osmým známým lidským koronavirem. Sekvenční analýza odhalila, že patří do stejného druhu jako SARS-CoV, tedy virus způsobující nemoc SARS. Od SARS-CoV se nový virus liší v sekvenci některých virových proteinů, které potlačují antivirovou imunitu a aktivují inflamazóm.
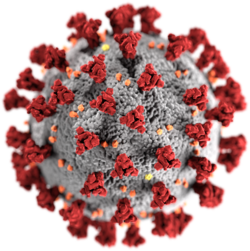 Morfologie virového obalu virionu koronaviru SARS-CoV-2. Kvůli glykoproteinovým výběžkům (peplomerům) na vnějším povrchu má v elektronovém mikroskopu podobu koróny (z lat. corona), typickou pro koronaviry, které jsou podle toho také pojmenovány. | |
 Nepravé barvy SARS-CoV-2 v transmisním elektronovém mikroskopu | |
| Baltimorova klasifikace virů | |
| Skupina | IV (ssRNA viry s pozitivní polaritou) |
| Vědecká klasifikace | |
| Realm | Riboviria |
| Říše | Orthornavirae |
| Kmen | Pisuviricota |
| Třída | Pisoniviricetes |
| Řád | Nidovirales |
| Podřád | Cornidovirineae |
| Čeleď | Coronaviridae |
| Podčeleď | Orthocoronavirinae |
| Rod | Betacoronavirus |
| Podrod | Sarbecovirus |
| Druh | Severe acute respiratory syndrome-related coronavirus |
| ráz / vnitrodruhový klad | |
SARS-CoV-2 | |
| Některá data mohou pocházet z datové položky. | |
Nákaza covidem-19 se začátkem roku 2020 masově rozšířila na všechny obydlené kontinenty a 11. března 2020 byla Světovou zdravotnickou organizací označena za pandemii. Onemocnění se objevilo v 220 zemích světa, včetně České republiky. Do 8. března 2023 bylo v 201 zemích celkem potvrzeno 676 570 149 případů, z toho 6 881 804 úmrtí, připisovaných covidu-19. Ke stejnému dni bylo podáno 10 664 631 169 dávek vakcíny.
Epidemiologie


Dne 31. prosince 2019 městská zdravotnická komise ve Wu-chanu oznámila, že ve městě se vyskytlo množství pacientů s příznaky pneumonie neznámého původu. Část pacientů byli prodejci a obchodníci na místním trhu s živými zvířaty a mořskými produkty z jižní Číny, kde syrové maso určené ke konzumaci přicházelo do styku s živými zvířaty. Jako jeden z možných mezihostitelů nebo zdroj komplementárního viru byli zvažováni luskouni, ale pozdější zkoumání tuto teorii jednoznačně vyvrátilo.
Po provedení krevních testů a výtěrů z krku u 15 pacientů bylo oznámeno, že se jedná o nový typ koronaviru, což o dva dny později potvrdila Světová zdravotnická organizace. Poté, co onemocnělo několik členů zdravotnického personálu, který se podílel na péči o nakažené, vyšlo najevo, že virus je přenosný z člověka na člověka. Byl také zveřejněn genom viru, který je nyní dostupný skrze Evropský globální katalog pro archivaci virů a genový archiv NCBI.
Z Wu-chanu se virem způsobená choroba, nazvaná covid-19, šířila nejprve po dalších čínských městech. První případ nákazy mimo území Číny byl zaznamenán v Thajsku. Nakažené později ohlásily mimo jiné Japonsko, Tchaj-wan, USA či Singapur. Počet nakažených rychle narůstá. V lednu 2020 se covid-19 rozšířil i do zbývajících obydlených kontinentů včetně Evropy. V Česku byla nákaza potvrzena dne 1. března 2020.
Dne 30. ledna 2020 byl Světovou zdravotnickou organizací vyhlášen globální stav zdravotní nouze. Dne 11. března 2020 bylo rozšíření covidu-19 Světovou zdravotnickou organizací označeno za pandemii.
Původ viru
Podle oficiální čínské verze byla zdrojem pandemie tržnice Chua-nan prodávající živá zvířata ve Wu-chanu, ale i po déle než 17 měsících od počátku pandemie není původ viru dostatečně vysvětlen a únik z laboratoře zůstává pravděpodobnou variantou, která by se měla prošetřit. Trh se zvířaty mohl být pouze sekundárním ohniskem, kam nákazu zanesli infikovaní lidé. Čína i v říjnu 2022 brání vyšetřování původu viru a nezávislí výzkumníci nedostali možnost prohlédnout laboratorní zápisníky, databáze, záznamy elektronické pošty a vzorky.
Porovnáním publikovaných sekvencí SARS-CoV-2 z počátku pandemie s frekvencí mutací viru byl odvozen společný předek těchto variant, který se začal exponenciálně šířit už v listopadu 2019. Fylogeneze viru rovněž jednoznačně vyloučila luskouny jako mezihostitele. Na konci října 2022 byla veřejně uvolněna studie, která na základě statistické analýzy naznačuje umělý původ viru, avšak neprošla ještě recenzním řízením. Podobně silné argumenty hájí přírodní původ viru. Dne 31. října 2022 byla agenturou Bloomberg zveřejněna zpráva Senátu USA, podle které na základě posledních výzkumů již nelze hypotézu o přirozeném zoonotickém původu považovat za správnou, a proto byla pandemie viru covid-19 s největší pravděpodobností výsledkem incidentu souvisejícího s výzkumem. K podobnému závěru došli i čeští vědci Zdeněk Hostomský a Roman Prymula.
Na druhou stranu, dvě vzájemně se doplňující veřejně dostupné studie publikované r. 2022 v prestižním vědeckém časopise Science naznačují na základě fylogenetických studií virových genomů a na základě podrobné statistické analýzy geografických dat, že právě tržnice Chua-nan byla nejspíše skutečně primárním epicentrem nákazy a zároveň i místem, kde došlo ke dvojímu přenosu viru ze zvířat na člověka: nejprve podle všeho došlo k nákaze významnou linií B během listopadu 2019 a o několik týdnů později i linií A; zvířata vnímavá k viru SARS-CoV-2, která mohla být přímým zdrojem nákazy, se na tržnici prodávala. Tyto studie zpochybňují hypotézu o laboratorním původu viru, ačkoli je již přesný sled událostí možné jen obtížně (pokud vůbec) rekonstruovat. Podobné závěry podporující spíše přirozený původ viru a naopak zpochybňující některé argumenty ve prospěch jeho laboratorního původu (např. údajně umělé modifikace genu pro spike protein) byly publikovány i v dalších významných odborných časopisech věnovaných přírodním vědám.
Největší koncentrace viru SARS-CoV-2 na tržnici Chua-nan byla zaznamenána u jednoho z konkrétních stánků, který prodával nedomestikovaná zvířata. Ve vzorcích pozitivních na výskyt viru z tohoto stánku byly nalezeny také stopy DNA několika zvířat, přičemž z těchto zvířat byl u oviječe maskovaného, psíka mývalovitého, hlodounů z čeledi slepcovitých a dikobraze krátkoocasého v minulosti zaznamenán přenos koronavirů z netopýrů. K přenosu na člověka pravděpodobně došlo na tržnici Chua-nan z některého z těchto druhů v průběhu listopadu 2019.
Obecná epidemiologická rizika
Vědci již dříve varovali, že trhy, na nichž se prodávají zvířata odchycená v přírodě, jmenovitě netopýři, jsou potenciálním zdrojem infekce. Čínští vědci, kteří po pět let zkoumali netopýry v provincii Yunnan, sekvenovali 11 nově objevených kmenů netopýřích SARSr-CoV, z nichž některé se díky mutaci v S-proteinu byly schopné vázat na ACE2 receptor lidských buněk. Z fekálií netopýrů byl izolován kmen koronaviru Rs3367 schopný vazby na ACE2 receptor několika druhů zvířat a reprodukující se in vitro v kultuře Vero E6 buněk z opičích ledvin.
Výzkum koronavirů, které mají schopnost vyvolat infekční onemocnění lidí, je považován za vysoce rizikový a vyžaduje laboratoř s nejvyšším stupněm zabezpečení (biohazard s certifikací BSL-4). V USA byla již roku 2014 zrušena podpora výzkumu, kterým jsou transformovány viry k získání nových vlastností, které by mohly být potenciálně nebezpečné (označované jako „gain-of-function“), např. schopnosti přenosu mezi lidmi. Přesto byl s povolením NIH (US National Institutes of Health) ještě v následujícím roce na University of North Carolina at Chapel Hill dokončen pokus, kdy vědci vytvořili chiméru koronaviru netopýra (SHC014) s virem SARS, která byla schopna infikovat lidské plicní buňky in vitro. Tento typ experimentů byl kritizován ve vědecké komunitě, protože riziko úniku takového viru z laboratoře převažuje nad potenciálním vědeckým přínosem. Obhájci argumentovali tím, že virus byl takto předefinován z kategorie „možný patogen“ do kategorie „jasné a přítomné nebezpečí“. Autoři virové chiméry připojili v březnu 2020 prohlášení, že jejich článek byl užit jako důkaz pro neověřené teorie, že covid-19 byl uměle vytvořen.
Šíření viru

Virus SARS-CoV-2 se šíří vzájemným kontaktem. Primárně pomocí infikovaných kapének, které nakažený vylučuje při kašli, kýchání nebo mluvení. Tyto infikované kapénky se mohou šířit až na vzdálenost dvou metrů. Lidé se mohou nakazit jejich vdechnutím nebo přenesením viru v kapénce z nějakého povrchu na obličej (typicky při doteku úst, nosu nebo očí). Zatím není zcela jasné, jak dlouho virus přežívá mimo lidské tělo.
Inkubační doba se pohybuje mezi 1 až 14 dny, nicméně obvyklá doba od setkání se s nakaženým do prvních příznaků je 5–6 dní. Podle dat Světové zdravotnické organizace je základní reprodukční číslo (R0 – očekávaný počet nových nemocných, které nakazí jeden člověk v populaci, kde mohou být nakaženi všichni jedinci) 2–3. Nicméně mezinárodní vědecký tým, který analyzoval 140 případů onemocnění napříč Čínou zjistil, že hodnota R0 je 5,7 (medián, 95% CI 3.8–8.9).
Ultrafialové záření podle výzkumů Harvardovy univerzity stojí za snižováním šíření tohoto viru, nicméně si nejsou jistí, jakým způsobem se tak děje. Jako možné varianty uvádějí, že UV záření může ničit samotný virus na površích a v aerosolech nebo například to, že lidé chodí v létě více ven, kde se virus tak snadno nešíří. Další možností např. je, že lidský organismus v létě vlivem UV záření produkuje více vitaminu D, podporující imunitu. Dále uvádějí, že je nepravděpodobné, že UV záření bez dalších přísných opatření dokáže zabránit šíření wuchanského koronaviru. Mezi šířením SARS-CoV-2 a hladinou UV záření tak existuje korelace, přímá kauzalita však v článku potvrzena nebyla. UVC složka záření se průmyslově používá k dezinfekci. UVB má vliv na ničení virů SARS-CoV-2, ale patrně je zde i podíl záření UVA.
Příznaky nakažení

Mezi příznaky nakažení patří suchý kašel, dušnost, únava a horečka. Životní funkce přijímaných pacientů byly obvykle stabilní. Závažnější případy mohou vést k zápalu plic, selhání ledvin a smrti. Symptomy většinou přicházejí postupně a zhruba 80 % nemocných se uzdraví bez nutnosti hospitalizace. U zbývajících 20 % nakažených má nemoc vážný průběh a nemocným se hůře dýchá (část z nich musí být připojena na ventilátor nebo ECMO).
Čínští vědci popsali obvyklý průběh nemoci u hospitalizovaných pacientů. Celkem zkoumali onemocnění u 138 pacientů – 26 % z nich bylo hospitalizováno na jednotce intenzivní péče a smrtnost byla 4,3 %. První symptomy byly horečka, únava, bolest svalů. Po pěti dnech (medián, IQR 1–10) od prvních symptomů se u pacientů začala projevovat dušnost. Sedmý den (medián, IQR 4–7) po propuknutí prvních příznaků byli nemocní hospitalizovaní. Syndrom akutní dechové tísně se projevil osmý den po propuknutí prvních příznaků (medián, IQR 6–12). Přesun na jednotku intenzivní péče potřebovali pacienti desátý den od propuknutí prvních příznaků (medián, IQR 6–12). Lidé, kteří se uzdravili byli z nemocnice propuštěni sedmnáctý den.
Průběh onemocnění a jeho závažnost záleží i na celkovém zdravotním a tělesném stavu nemocného. U lidí starších 65 let a lidí s vyšším krevním tlakem, problémy se srdcem nebo plícemi, lidí s cukrovkou nebo nádorovými onemocněními a obecně lidí se suprimovaným imunitním systémem je vyšší riziko vážného průběhu nemoci covid-19.
Přítomnost viru v tělesných orgánech
U příbuzného viru SARS-CoV, který způsobil epidemii v letech 2002–2004, byla zkoumána jeho distribuce v orgánech zemřelých pacientů pomocí myší monoklonální protilátky proti nukleoproteinu viru a histochemickou reakcí nebo in situ hybridizací s fragmentem RNA virové RNA-polymerázy. Bylo zjištěno, že virus se nachází v plicích, trachei a bronchech, žaludku, tenkém střevě, distálním tubulu ledvin, potní žláze, příštítné žláze, hypofýze, pankreasu, játrech, nadledvině a v mozku. Nebyl nalezen v jícnu, slezině, mízních uzlinách, kostní dřeni, srdci, aortě, mozečku, štítné žláze, pohlavních orgánech a svalech. Studie významně přispěla k objasnění mechanismu přenosu viru, když prokázala, že může být vylučován i močí, výkaly nebo potem. Předběžné výsledky potvrdily vylučování viru anální cestou v pozdních fázích léčení a u 23% pacientů dokonce i po negativních testech na přítomnost viru v plicích také u SARS-CoV-2.
Fyziologické indikátory
V antivirové imunitě hrají důležitou roli T-lymfocyty. Měřením typických markerů indikujících vyčerpání T lymfocytů (PD-1 a TIM-3) pomocí průtokové cytometrie bylo zjištěno, že většina starších pacientů a pacientů na jednotkách intenzivní péče s covidem-19 měla dramaticky snížený titr T-CD4+ a TCD8+ i celkový titr T lymfocytů (300/μL, 400/μL, 800/μL), což negativně korelovalo s jejich přežíváním. Sníženému počtu T-lymfocytů zároveň odpovídají zvýšené koncentrace některých cytokinů, zejména TNF-a, IL-6 a IL-10 v séru pacientů. U pacientů s covidem-19, kterým selhaly plíce a vyžadovali plicní ventilaci, byla pozorována zvýšená hladina interleukinu 6 (IL-6).
Napadení CNS
Neurotropní viry, mezi které lze zařadit i SARS-CoV a MERS-CoV, mohou způsobit devastující onemocnění centrální nervové soustavy, zejména u dětí a seniorů. Do mozku se virus dostane při přímém průniku z cév, prostřednictvím cerebrospinálního moku nebo axonálním transportem z periferních nervů, např. při přenosu infekce z očí nebo nosu do olfaktorického bulbu nebo trojklaného nervu. ACE2 receptor se vyskytuje i v nervových buňkách. Dříve popsané viry SARS-CoV a MERS-CoV napadají mozkový kmen a mohou odpovídat za některá selhání plic. Potlačení reflexu mozkového kmene na hypoxii se projevuje tím, že pacienti s covidem-19 s prokazatelně nízkou hladinou kyslíku v krvi nemají zvýšenou frekvenci dýchání.
Někteří pacienti nakažení SARS-CoV-2 vykazují neurologické příznaky, jako zmatení, nevolnost, bolest hlavy nebo ztrátu čichu a chuti. U jednoho z pacientů s covidem-19, jehož onemocnění se zkomplikovalo encefalitidou, byl SARS-CoV-2 prokázán v mozkomíšním moku. Pozorování neurologických symptomů publikovali lékaři i v Japonsku, USA, Francii a Itálii. Ukazuje se, že až více než třetina nakažených vykazuje známky zasažení centrálního nebo periferního nervového systému či svalů. Včasná diferenciální diagnóza neurologického onemocnění může napomoci k odhalení možných nositelů viru SARS-CoV-2.
U jedné zhruba padesátileté ženy lékaři diagnostikovali akutní nekrotizující encefalopatii, která je vzácnou komplikací v případě chřipek a jiných virových infekcí. V Itálii byly u některých pacientů zaznamenány blouznivé stavy ještě před tím, než se u nich objevily horečky a potíže s dýcháním.
Virová latence
Latentní průběh virového onemocnění je typický pro retroviry (HIV), nebo pro některé DNA-viry např. Hepesviridae (jako tzv. epizomální latence), ale u RNA-virů není zcela obvyklý. Přesto byla v experimentech in vitro popsána trvalá infekce některých typů buněk koronavirem. Podle ojedinělého popsaného případu u člověka v Japonsku zatím nelze určit, zda šlo o reinfekci SARS-CoV-2 nebo virovou latenci. Jižní Korea ale ohlásila, že u 111 vyléčených pacientů krátce po propuštění z karantény byla opakovaným testem prokázána reaktivace viru. Reinfekce nejsou dostatečně dokumentovány a týkají se pouze ojedinělých pacientů s těžším průběhem. V jednom případě se jednalo o jiný kmen viru, v dalších chyběla data o vytvoření protilátek proti spike proteinu po první infekci. Asymptomatické reinfekce nelze zachytit bez rozsáhlého testování vůbec. Protilátky jsou individuálně přítomny různou dobu a to dny až roky.
Asymptomatický průběh
Již předchozí vědecké studie prokázaly, že běžná sezónní chřipka (H1N1) může mít asymptomatický průběh (tzn. bez teplot nebo kašle a bolestí v krku) u 69–73 % dětí, kterým byly později v krvi prokázány nově vytvořené protilátky proti kmenům chřipky H1N1 nebo H3N2. U jiných virových onemocnění jsou procenta asymptomatického průběhu onemocnění od 8 % u spalniček, přes 32 % u norovirové nákazy až po 90–95 % u dětské obrny.
Data shromážděná z 25 dosud publikovaných článků ukazují, že také infekce covidu-19 má u dětských pacientů většinou mírný nebo asymptomatický průběh a děti se mohou stát přenašeči nákazy v rodinách.
Podobná studie na zatím omezeném počtu 565 Japonců, kteří byli evakuováni z Wu-chanu a všichni otestováni na přítomnost SARS-CoV-2 pomocí RT-PCR (Reverse transcription PCR) testu ukazuje, že z celkového počtu pozitivně testovaných bylo bez příznaků až 30 %, a to i po třicetidenní karanténě. U pasažérů lodi Diamond Princess, kde vypukla nákaza covid-19 před 5. únorem 2020, mělo pozitivní test 634 z celkem 3 063 testovaných pasažérů, přičemž procento zjištěných asymptomatických pacientů se v průběhu testování postupně mezi 13.–20. únorem zvyšovalo z počátečních 16 % až na více než 50 %.
| Místo | Počet pozitivně testovaných | Podíl asymptomatických případů | Ref. |
|---|---|---|---|
| Loď Diamond Princess, Yokohama, Japonsko | 634 | 18% (95% CI 16%–20%). | |
| Šanghaj | 328 | 4% | |
| Japonci evakuovaní z Wuhanu | 565 | 31% (95% CI 7.7%–54%) | |
| Ošetřovatelský dům, King County, Washington | 23 | 57% * | |
| Hospitalizovaní pacienti v Pekingu, Čína | 262 | 5% | |
| Provincie Če-ťiang, Čína | 391 | 14% | |
| Provincie Če-ťiang, Čína | 36 (děti) | 28% | |
| Nemocnice v okrese Daofu, Čína | 83 | 22% | |
| Severní Itálie | 60 | 67% |
Ze studie, která měřila virovou RNA ve stěrech z horních dýchacích cest vyplývá, že její množství je u asymptomatických pacientů podobné jako u těch, kteří vykazují příznaky onemocnění. Testování na přítomnost viru je tedy jedinou cestou jak nakažené izolovat. Nově zavedené antigenní testování v České republice odhaluje až nadpoloviční množství bezpříznakových nakažených (5 000/ 9 500 testovaných) a představuje až 20 procent všech nových záchytů.
Mechanismus nakažení
Virus vstupuje do buňky prostřednictvím vazby na peptidázu angiotensin konvertáza (ACE2), který je silně exprimován na epiteliálních buňkách typu II plicních alveol a řasinkovém epitelu průdušinek. Angiotensin konvertáza je dimer (ACE2) a tvoří komplex s dalším proteinem B0AT1, který slouží jako transmembránový přenašeč aminokyselin. Dimer ACE2 je vlastním vazebným místem pro virový glykoprotein S, jehož trimer tvoří výběžky (spike) obalu koronaviru SARS-CoV-2.
Plicní buňky zároveň obsahují řadu genů, které se účastní replikace virové RNA a hrají úlohu v životním cyklu viru v infikované buňce. ACE2 receptor SARS-CoV-2 viru je zastoupen i v řadě dalších tkání, včetně ledvin, srdce, endotelu nebo střeva. Při počátku nákazy na tržnici v čínském Wu-hanu mohly hrát roli receptory viru přítomné ve střevních buňkách, v nichž angiotensin konvertáza hraje roli při resorpci aminokyselin ze střeva.
Virus je po navázání na receptor dopraven dovnitř buňky endocytózou v tzv. endozomu, kde teprve dochází k fúzi jeho obalu s membránou a uvolnění virové RNA do cytoplasmy. Experimenty na zvířecích modelech prokázaly, že v infekci plic koronaviry SARS-CoV a MERS-CoV u myší hraje klíčovou roli i transmembránová serinová proteáza TMPRSS2, která aktivuje spike protein virové obálky a mění jeho prostorovou konformaci, která pak umožňuje fúzi virového obalu s membránou. Tato proteáza vyžaduje kyselé pH a mechanismus antivirového účinku chlorochinu je vysvětlován tím, že zvyšuje pH v endozomech.
Objasnění mechanismu infekce nabízí zároveň možné způsoby léčby infekce. Kromě vakcíny proti podjednotce virové kapsidy, která se váže na receptor ACE-2, přichází v úvahu blokace tohoto receptoru nebo inaktivace transmembránové serinové proteázy 2 (TMPRSS2), která štěpí peplomer virové obálky a umožňuje viru fúzi s membránou endozomu a vstup do cytoplasmy buňky. Inhibitory této proteázy, camostat a nafamostat jsou schválená léčiva v Japonsku a USA, kde jsou užívána k léčbě chronické pankreatidy, rakoviny i některých virových onemocnění, včetně MERS-CoV.
Fylogenetika
Fylogenetický strom SARS-CoV-2 a příbuzných koronavirů založený na sekvenci celého genomu je následující:
| SARS‑CoV‑2 příbuzné koronaviry |
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SARS-CoV, 79% k SARS-CoV-2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Jako referenční sekvence SARS-CoV-2 slouží vzorek viru hCoV-19/Wuhan/WIV04/2019, získaný od symptomatického pacienta dne 30. prosince 2019 v nemocnici Wuhan Jinyintan Hospital ve Wu-chanu.. Do 2. února 2021 bylo získáno téměř 460 000 úplných genomových sekvencí viru z celého světa.
Části genetické sekvence SARS-CoV-2 vykazují podobnosti s jinými betakoronaviry vyskytujících se v netopýrech jako jsou SARS-CoV či MERS-CoV, které způsobují nemoci SARS a MERS, nicméně nový koronavirus je od nich geneticky odlišný. Jeho RNA je dlouhá přibližně 30 473 bp. Fylogenická analýza je dostupná skrze Nextstrain.. Vysokou 96% příbuznost vykazuje netopýří koronavirus BatCoV RaTG13 pocházející z netopýrů v měděném dole v Mo-ťiangu v městské prefektuře Pchu-er v provincii Jün-nan, který byl sekvenován až po vypuknutí pandemie covidu-19 koncem roku 2019. Podobně vysokou příbuznost vykazuje také netopýří koronavirus RmYN02 pocházející z netopýrů z autonomní oblasti Si-šuang-pan-na v provincii Jün-nan, který byl sekvenován v roce 2020. Obě sekvenování prováděli vědci ve Wuchanském institutu virologie.
Porovnání známých sekvencí savčích koronavirů napomohlo k objasnění významu mutací, insercí nebo delecí (rekombinací), které hypoteticky vznikly přes zvířecího mezihostitele nebo až během infekce člověka a vedly k adaptaci na mezilidský přenos. Zatímco receptorová doména S proteinu obsahuje střídavě base shodné s koronavirem netopýra či luskouna, jeho doména aktivovaná membránovou proteázou je kódována unikátní nově získanou sekvencí RNA a nemá žádnou analogii se zkoumanými viry. Bez objevení takové sekvence u některého zvířecího koronaviru nelze stanovit, zda virus vznikl přirozenou rekombinací nebo uměle.
Předběžné zprávy uvádějí, že virus SARS-CoV-2 je přirozeného původu; nevykazuje celogenomovou příbuznost k jiným liniím koronavirů SARS, kterou by se vyznačoval záměrně laboratorně vytvořený virus, ale nese změny jak v genech pro receptor vážící doménu odpovědnou za vazbu viru na receptor cílových buněk, tak pro „místo štěpení“, které musí být rozpoznáno a štěpeno enzymy hostitele, čímž je virový protein aktivován ke vstupu do buněk.
Porovnání kompletního genomu SARS-CoV-2 s příbuznými koronaviry vedlo ke zjištění, že spolu s netopýřím RaTG13 tvoří zvláštní linii odlišnou od ostatních známých koronavirů pouze pokud jde o část ORF 1a a část kódující S protein. Tato sekvence RNA však není identická a tedy RaTG13 není virem, který způsobil nynější pandemii. Naopak celá střední část SARS-CoV-2 – téměř polovina jeho genomu (pořadí nukleotidů 10 901–22 830) nemá žádnou příbuznou analogii mezi známými sekvencemi koronavirů podrodu Sarbecovirus ani jinými koronaviry a autoři vylučují, že mohla vzniknout nedávnou rekombinací. Shodu ve většině oblastí genomu (např. 1ab, 3a, E, 6, 7a, N a 10) se však podařilo identifikovat u příbuzného netopýřího viru RmYN02, což představuje další podporu pro přirozený vznik lidského SARS-CoV-2.
RNA viry představují 37% všech zoonóz, neboť vysoká frekvence mutací jejich genomu umožňuje rychlejší adaptaci na nového hostitele. Viry s genomem tvořeným velkou jednovláknovou RNA mají obecně širší spektrum možných hostitelů, přičemž při infekci hraje důležitou roli evolučně konzervovaná struktura jejich receptorového proteinu. Viry s vysokou plasticitou, pokud jde o spektrum hostitelů, představují vážnější riziko přenosu na člověka. Také platí, že změna hostitele na větší fylogenetickou vzdálenost obvykle vede ke vzniku vážnějšího onemocnění a vyšší mortalitě.
SARS-CoV-2 během šíření v lidské populaci mutuje s vysokou frekvencí. Porovnáním celkem 7 666 z 11 000 známých kompletních genových sekvencí (GISAID Initiative EpiCoV platform) bylo nalezeno celkem 198 homoplasických (shodných) mutací, které během vývoje z původního typu viru patrně představují evoluční adaptaci na lidského hostitele a měly by být předmětem dalšího zkoumání. 80 % záměn nukleotidů představuje nesynonymní mutaci (232) a zbytek synonymní mutaci (58) aminokyselin virových proteinů, z toho nejčastěji v nestrukturních proteinech Nsp6, Nsp11, Nsp13 a v S proteinu obálky viru. Tyto mutace jsou většinou neutrální nebo recesivní. Autoři zároveň uvádějí, že 96 % příbuznost s netopýřím koronavirem BatCoV RaTG13 není dostatečně vysoká, aby bylo možno tento virus pokládat za přímého předchůdce SARS-CoV-2. Matematickým výpočtem z fylogenetického stromu bylo odvozeno, že výchozí typ viru (Most Recent Common Ancestor) se v Číně objevil v době mezi 6. říjnem až 11. prosincem 2019 a rychlost mutací činí přibližně 10−4/genom/rok.
Někteří vědci předpokládají, že při přenosu koronaviru z původního hostitele, kterým byli patrně netopýři, hrál roli některý mezihostitel. Doména virové obálky, která se váže na receptor angiotenzin konvertáza v lidských buňkách je velmi podobná doméně jedné ze dvou linií SARS-CoV-2-příbuzných koronavirů, které byly izolovány z malajských luskounů, zabavených při policejní operaci proti pašerákům na jihu Číny. Porovnání téměř 3000 známých úplných genomů koronavirů naznačuje, že virová doména S proteinu, která se váže na receptor, je u netopýřích virů vysoce variabilní a prochází řízenou evolucí. V sekvencích virů netopýrů a luskounů byly nalezeny tři nezávislé a statisticky významné rekombinace. Podle nerecenzovaného článku čínských výzkumníků byla porovnáním koronavirů netopýra (Bat-CoV-RaTG13) a luskouna (Pangolin-CoV-2019) nalezena pravděpodobná rekombinace v místě S proteinu, která mohla vést ke vzniku SARS-CoV-2.
Lidské patogenní RNA-viry jako virus chřipky, SARS, MERS, koronaviry luskounů, netopýří koronavirus BatCoV RaTG13, ale též psí koronaviry, mají společnou vlastnost, která jim dovoluje uniknout přirozenému obrannému mechanismu v buňkách. Je to nízký obsah dinukleotidů CpG v jejich RNA, které rozeznává buněčný restrikční faktor ZAP (Zinc finger Antiviral Protein) a aktivuje buněčnou RNA-exonukleázu (exozómový komplex), která pak cizou RNA rozštěpí. Existuje pravděpodobnost, že virus z trusu netopýrů zmutoval ve střevě psů, protože SARS-CoV-2 způsobuje zažívací potíže také u lidí.
Analýza viru SARS-CoV-2
Původně byl SARS-CoV-2 považovaný za druh odlišný od SARS-CoV. Mezinárodní výbor pro klasifikaci virů však na základě dostupných genových sekvencí a s přihlédnutím k taxonomickým pravidlům pro virový druh rozhodl, že odlišnosti SARS-CoV-2 nejsou pro jeho uznání jako nový druh dostatečné a je třeba ho řadit jako SARS-CoV do stejného druhu s mezinárodním označením Severe acute respiratory syndrome-related coronavirus.
Genetické analýzy ukázaly, že virus mutuje a v listopadu 2020 bylo identifikováno nejméně osm jeho typů. Přesné místo vzniku daného typu (odlišující mutace) nelze z dosavadního omezeného množství sekvenovaných vzorků určit, je ale možné, že všechny mají původ ve Wu-chanu, kde byly zaznamenány první dva (ne nutně nejpůvodnější), evolučně starší typ S i evolučně novější typ L. Novější typ L se šíří snáze, není však známo, že by nutně způsoboval závažnější formu onemocnění. 27. března 2020 byla publikována studie ukazující, že jeden z nově zjištěných, mutací vzniklých podtypů SARS-CoV-2 by mohl způsobovat chronické onemocnění (pacient se viru nedokázal zbavit ani za 49 dní), i když s mírným průběhem. Indikátory imunitní reakce byly přitom stabilní i přes vysokou virovou zátěž, což by mohlo naznačovat, že lidský organismus může vytvořit s daným podtypem viru symbiotický vztah.
Vysokou frekvenci mutací u RNA virů způsobuje jejich jednovláknová RNA a také virová RNA-polymeráza, která při replikaci vnáší časté chyby. Akumulace mutací v každém replikačním cyklu však neznamená, že se virus stává automaticky nebezpečnější, protože epidemiologicky významné vlastnosti jako virulence jsou kontrolovány více geny současně. Nové vlastnosti nevznikají v tak krátkém evolučním období a většina mutantních virů je přirozenou selekcí eliminována. Do dubna 2020 bylo sekvenováno celkem 3379 genomů SARS CoV-2 z různých oblastí světa, přičemž u dvou původem z USA bylo nalezeno 16 a 22 mutací. Některé evropské typy mají 11–14 mutací (Island, Belgie, Francie, Nizozemsko).
Porovnání celkem 160 kompletních sekvencí SARS-CoV-2, izolovaných v různých částech světa během počáteční fáze šíření pandemie na počátku března 2020, umožnilo na základě postupně kumulovaných mutací genomu a známé cestovní historie nakažených konstrukci fylogenetického stromu viru. Z celkem 100 různých genomů viru je možné sestavit tři hlavní typy, z nichž původní typ A, který má nejblíže k předpokládanému zdroji – koronaviru netopýra z okolí Jün-nanu, označovanému BatCoVRaTG13, mohl kolovat v lidské populaci na jihu Číny už v září 2019. Nejstarší podtyp SARS-CoV-2, označovaný A, byl nalezen v Guandongu, mladší podtyp A převážně ve Wu-chanu, odkud se rozšířil do USA a Austrálie. Podtyp B se vyskytuje ve Wu-chanu a některých přilehlých asijských zemích. Podtyp C se vyskytuje v asijských zemích mimo Čínu, v Evropě a USA. Na základě analýzy genomů viru bylo možné určit např. přímou trasu přenosu Guandong–Kanada. Na trase šíření Wu-chan–Německo–Itálie–Mexiko virus postupně kumuloval celkem 10 mutací.
Mapování mutací viru a vytvoření jeho fylogenetického stromu se věnuje iniciativa GISAID. Důsledné sekvenování izolovaných typů viru ale provádí pouze několik zemí, z nich nejdůsledněji Austrálie, kde bylo izolováno a sekvenováno téměř 59 % virů z celkem 28 000 nakažených. Následuje Nový Zéland (48,6 %), Tchaj-wan (17,7 %), z evropských zemí Dánsko a Island (11,7, 10,6 %), následují Gambie (9,5 %) a Vietnam (8 %). Velká Británie s celkovým množstvím přes 2 miliony nakažených sekvenovala celkem 7,4 % (= 157 000), kdežto USA s 18 miliony nakažených má pouze 0,3 % sekvenovaných virů (= 51 000) a je až na 43. místě ve světě.
Jak se ukázalo v případě jiných infekcí (Ebola), jsou virulence a přenosnost viru v nepřímé úměře, protože vysoce virulentní onemocnění zahubí infikovaného dříve, než stačí nakazit další. I bodová mutace viru je naopak významná při jeho mezidruhovém přenosu, jak se ukázalo u lidského HIV, který vznikl mutací AA30 v Gag proteinu SIV, mutace GP-A82V viru Eboly, nebo mutace E1-A226V u Chikunguya viru, která umožnila změnu mezihostitele. Jindy byla příčinou mezidruhového přenosu naopak delece části genomu. Při epidemii SARS (2002–2003) byly SARS-CoV viry nalezeny na tržnici v Guandongu u himálajských cibetek, psíků mývalovitých i lidí pracujících v tržnici. Také SARS-CoV má oproti koronaviru cibetky bodovou mutaci v místě domény vázající se na ACE2, která zvyšuje jeho afinitu k receptoru. Virulentní varianta viru, izolovaná z pacientů s nemocí SARS, vznikla delecí 29 nukleotidů v genu kódujícím spike protein obalu viru, který mu umožnil adaptaci na lidského hostitele.
Odlišnosti SARS-CoV a SARS-CoV-2
Za epidemie, která má počátek na přelomu let 2002-2003 byl původ viru SARS-CoV jednoznačně identifikován porovnáním jeho sekvence spike proteinu s homologní sekvencí viru izolovaného z cibetky. Mezi prvními čtyřmi nakaženými byla servírka z restaurace v Guangzhou která měla cibetky na jídelníčku a zákazník, který seděl v blízkosti klecí s živými cibetkami.
Genomy viru cibetky a SARS-CoV byly na počátku téměř shodné, ale po přenosu na člověka virus v krátké době kumuloval množství nehomologních mutací, které byly významné pro jeho adaptaci na nového hostitele.
Oproti tomu byl SARS-CoV-2 od počátku pandemie na konci roku 2019 dokonale adaptován na lidského hostitele a připomínal již mutovaný SARS-CoV z pozdní fáze první pandemie v letech 2003-2004. Nebyly nalezeny žádné vzorky viru SARS-CoV-2, které by potvrdily jeho původ nebo evoluci v jiném hostiteli. Také materiál z tržiště ve Wu-chanu je identický s viry izolovanými z infikovaných pacientů a pocházel nejpravděpodobněji z lidského zdroje. Homologie s viry netopýrů je nedostatečná a je vyloučeno, aby mezihostitelem viru byli luskouni.
Někdejší ředitel Centra pro kontrolu a prevenci nemocí v USA Dr. Robert Redfield uvedl, že teorie o přenosu viru SARS-CoV-2 z netopýrů přes mezihostitele na člověka nedává žádný biologický smysl. Mnohem pravděpodobnější je varianta, že čínská laboratoř, která se věnovala studiu netopýřích virů, viry adaptovala pro pasážování v kulturách lidských buněk a poté došlo k nezamýšlenému úniku.
Kontroverze
Vědecká komunita stále nedostala vzorky netopýřího viru RaTG13, který autoři článku v Nature z 3. února 2020 označili jako možného původce pandemie. Tato hypotéza, stejně jako metodologie, kvalita dat a experimentální postupy uvedeného článku byly zpochybněny.
Š' Čeng-li a její tým z Wuchanského institutu virologie už od června roku 2012 po dobu 18 měsíců zkoumali koronaviry netopýrů v měděném dole v Mo-ťiangu v provincii Jün-nan, kde v 1 322 vzorcích nalezli 293 druhů koronovirů, z toho několik nových druhů, který byly popsány ve vědecké publikaci, kde však chybí jakákoli zmínka o tom, že důvodem k jejich výzkumu byla těžká plicní pneumonie u dělníků kteří se v tomto dole dostali do kontaktu s netopýry a jejich exkrementy v dubnu 2012. Zpráva o pneumonii byla publikována odděleně jejich ošetřujícími lékaři a pouze v čínštině. Ze šesti nemocných tehdy tři zemřeli. Vzorky od čtyř z těchto nemocných byly v roce 2012 negativně testovány na virus Ebola, Nipah virus a netopýří SARS-CoV Rp3.
RaTG13 (RaBtCoV/4991) byl údajně izolován a sekvenován roku 2016, ale o jeho existenci a vztahu k uvedené pneumonii nebyla informována vědecká komunita. Není rovněž zřejmé, jaké experimenty byly s tímto virem provedeny před vypuknutím pandemie covidu-19 koncem roku 2019. V roce 2020 byly čtyři výše uvedené vzorky od nemocných v dole negativně testovány na SARS-CoV-2. Ve Wuchanském institutu virologie byly prováděny experimenty výzkumu zisku funkce, při kterých se manipulovalo s genetickým kódem koronavirů.
Jak vyplývá ze zjištění vědeckého týmu DRASTIC, který pátrá po původu pandemie, žádal Wuchanský institut virologie neúspěšně 18 měsíců před vypuknutím pandemie americkou agenturu Defense Advanced Research Projects (DARP) o grant ve výši 14 miliard dolarů na velmi nebezpečné experimenty. Jejich předmětem mělo být vytvoření nanočástic s chimérickými, v laboratoři vytvořenými spike proteiny i plány na vytvoření geneticky pozměněných chimérických virů schopných snadněji infikovat lidi. Návrh grantu také zahrnoval plány na smíchání vysoce rizikových přírodních kmenů koronavirů s infekčnějšími druhy. Agentura DARP projekt financovat odmítla, ale pravost dokumentů potvrdili členové Trumpovy administrativy. V čele projektu stojí britský zoolog Peter Daszak z americké organizace EcoHealth Alliance, který patří k nejhlasitějším zastáncům teorie o přírodním původu SARS-CoV-2. Podrobnou analýzu virového spike proteinu provedli Birger Sørensen, Angus Dalgleish & Andres Susrud ze St Georges University, London. Ti nalezli celkem šest inzercí aminokyselin ve spike proteinu, které nemohly vzniknout přirozenou mutací a vykazují charakteristické znaky záměrné manipulace.
Čína se z propagandistických důvodů pokouší jakkoli zpochybnit tamní původ viru a na vědecké publikace uvalila nejpřísnější cenzuru a podmínku předchozího schválení na centrální úrovni. Čínští vědci o původu viru téměř nic nepublikovali nebo se otázce původu viru a celé epidemie raději vyhýbají. Podle šetření The Associated Press mohou koronavirus studovat pouze prověření čínští vědci, kteří mají často blízko armádě. Tématu se nesmějí věnovat zahraniční vědci a jejich čínští kolegové mají zákaz předávat jim informace.
Přímo na místě měl otázky původu viru zkoumat vědecký tým vyslaný Světovou zdravotnickou organizací, ale Čína zablokovala na poslední chvíli vydání víz a to i pro členy týmu, kteří již byli na cestě. Mise WHO se nakonec uskutečnila v termínu 16-24. února 2021 a tvořil ji 26členný vědecký tým v němž polovinu měli vyhrazenu čínští vědci. Výsledky byly zveřejněny ve čtyřicetistránkovém dokumentu. Proti závěrům se otevřeným dopisem vyslovilo celkem 26 vědců a vědkyň z předních univerzit z celého světa, kteří upozorňují, že výsledky vyšetřování nelze považovat za nezávislé. Někteří zahraniční vyšetřovatelé si sami za sebe západním médiím stěžovali na čínský tlak a politizaci vědecké práce. Celý text otevřeného dopisu Call for a Full and Unrestricted International Forensic Investigation into the Origins of COVID-19 zveřejnily The New York Times
Jak vyšlo najevo z investigace amerického týmu "Right to Know" v únoru 2021, tzv. prohlášení 27 prominentních vědců zveřejněné počátkem roku 2020 v časopisu Lancet, které označilo domněnky o umělém původu viru za "konspirační teorii", organizoval prezident EcoHealth Alliance Peter Daszak. Členové EcoHealth Alliance (např. The University of North Carolina at Chapel Hill) přitom sami prováděli výzkumy zahrnující genetickou manipulaci koronavirů ve spolupráci s Wuchanským institutem virologie a někteří z nich jsou uvedeni jako spoluautoři i v prohlášení v časopisu Lancet. Financování tohoto výzkumu zastavil prezident Trump. Peter Daszak, který je jedním z nejhlasitějších obhájců teorie o přírodním původu viru, byl členem týmu WHO, který měl ve Wu-chanu pátrat po původu SARS-CoV-2.
Prezident WHO Tedros Adhanom Ghebreyesus prohlásil 30. března 2021, že k jednoznačnému vyloučení verze úniku viru SARS-CoV-2 z laboratoře Virologického institutu ve Wu-chanu je potřebné další vyšetřování. Virus pravděpodobně koloval ve Wu-chanu již v říjnu nebo listopadu 2019. Tým, který WHO vyslala do Číny počátkem roku 2021, se setkal s neochotou čínské strany poskytnout původní nezpracovaná data a vzorky potřebné ke zkoumání původu viru. Plán WHO na druhou fázi vyšetřování původu viru Čína v červenci 2021 odmítla a označila výsledky první fáze vyšetřování za zpolitizované.
V srpnu 2021 bylo zveřejněno shrnutí zprávy amerických tajných služeb k původu viru. Podle tohoto shrnutí se virus objevil v čínské populaci nejpozději v listopadu 2019 Wu-chanu. Není důvod předpokládat, že byl vyvinut jako biologická zbraň, jeho původ však zůstává nejasný. Jako pravděpodobné tajné služby považují hypotézy o přirozeném původu, tedy mezidruhovém přenosu z hostitele s obdobným dosud neznámým virem, a hypotézu o laboratorní nehodě ve Virologickém institutu ve Wu-chanu.
Mezidruhový přenos
SARS-CoV-2 je z člověka přenosný na řadu jiných savců, včetně psů, domácích i velkých koček (lvů, sněžných levhartů a tygrů), lidoopů, norků, kaloňů, tan a křečků. Jako nový problém se ukazuje přenos z lidí na norky chované na kožešinových farmách. V USA od srpna 2020 virus zabil více než 15 000 norků a farmy ve státech Utah, Wisconsin a Michigan byly nuceny zavést karanténu. Podobně jako u lidí probíhá infekce u některých norků bezpříznakově, ale zatím neexistují důkazy o zpětném přenosu na lidi. Na farmách v Dánsku byla u norků objevena nebezpečná mutace, která omezuje imunitní reakci a mohla by snížit účinnost připravovaných vakcín. Proto se tam rozhodli zlikvidovat veškeré farmy a usmrtit 17 milionů norků.
SARS-CoV-2 je přenosný zejména na lidoopy. Safari Park v San Diegu zaznamenal 11. ledna 2021 onemocnění u třech Goril nížinných, které se pravděpodobně nakazily od asymptomatického ošetřovatele. Onemocnění se projevilo kašlem a virus byl potvrzen ve vzorcích výkalů. Zoo v San Diegu získala experimentální vakcínu veterinární farmaceutické firmy Zoetis, kterou preventivně imunizovala čtyři orangutany a pět šimpanzů bonobo.
Také v pražské zoo se nakazil gorilí samec a dva lvi indičtí.
Jelenec běloocasý se v USA ukázal jako relativně promořená populace.
Významné varianty a mutace SARS-CoV-2

Virus během šíření v populaci přirozeně mutuje s frekvencí 1–2 mutace/měsíc a dominantní se stávají linie s vyšší transmisí. V únoru 2020 se objevila mutace D614G a rychle se stala dominantní, a epidemiologická data ji nejčastěji spojují se ztrátou čichu.
Prostředím pro častější vznik mutací jsou např. pacienti s oslabenou imunitou, u kterých onemocnění covid-19 může probíhat po dobu několik měsíců. Při léčbě konvalescentní plasmou pak dochází k selekci mutantních kmenů, které vykazují vyšší rezistenci vůči protilátkám díky kombinaci delecí a záměn aminokyselin ve spike-proteinu (D796H a ΔH69/ΔV70).
Podle generálního ředitele WHO Tedrose Adhanoma Ghebreyesuse se jedná o běžný a očekávaný jev a rychlost mutací koronaviru je stále nižší než u viru chřipky a jeho infekčnost je nižší než u příušnic. Jedinou cestou ke snížení frekvence mutací je omezení šíření viru v populaci. Řada expertů potvrzuje, že mutacemi získaná vyšší infekčnost virů je obvykle provázena nižší patogenitou a úmrtností.
Velká Británie, která dodala do světové databáze více než polovinu všech známých sekvencí viru SARS-CoV-2, zveřejnila 26. ledna 2021 vládní výzvu pro ostatní země, aby využily její laboratorní kapacity a vytvořily tak Novou platformu pro hodnocení variant viru (New Variant Assessment Platform).
Varianta B.1.1.7 (α dle WHO) = alfa
Potvrzuje se, že evoluční tlak vede k takovým mutacím, které zvyšují afinitu k receptoru nebo usnadňují vstup viru do cílové lidské buňky. Na jihovýchodě Velké Británie byla identifikována varianta viru označovaná B.1.1.7 (SARS-CoV-2 VUI 202012/01 dle klasifikace WHO, také označována 501Y.V1), která se velmi rychle šíří a byla prvně přenesena do Nizozemska, Dánska, Itálie a Austrálie. Varianta patrně vznikla v létě roku 2020. Varianta byla poprvé detekována v září 2020 a poté v prosinci 2020 v Londýně odpovídala za dvě třetiny nových infekcí. Počátkem roku 2021 byla tato vysoce infekční varianta viru rozšířena již do 33 zemí. Nakažlivost mutantního viru demonstruje případ Irska, které dříve patřilo k nejméně postiženým zemím a v první dekádě ledna 2021 se stalo zemí s nejvyšším počtem nově nakažených na 100 000 obyvatel na světě. „Britská“ varianta viru tam byla nalezena téměř u poloviny nových případů infekce. V Dánsku, kde je díky důslednému sekvenování velmi přesný přehled o nových případech nakažení, tato varianta odpovídá každý týden za 70 % zjištěných případů a bude dominantní už v polovině února 2021. Také CDC ve Spojených státech varuje, že tato nová nakažlivější varianta viru bude dominantní už koncem března 2021.
U varianty se očekává vyšší počet úmrtí v důsledku exponenciálního růstu počtu nemocných, varianta také zřejmě způsobuje těžší průběh a vyšší smrtnost. Podle matematické analýzy, provedené vědci z London School of Hygiene and Tropical Medicine, infekce touto nakažlivější variantou způsobuje těžší průběh nemoci a vyšší smrtnost průměrně o 61 %.
Pravděpodobný záchyt britské mutace koronaviru ohlásila 16. ledna 2021 také Národní referenční laboratoř Státního zdravotního ústavu. Podle analýzy společnosti Diana Biotechnologies, která zpracovává asi čtvrtinu českých PCR testů, byla tato varianta v půli února 2021 v České republice již dominantní.
Tato varianta kumuluje neobvyklé množství mutací, které odpovídají za 14 záměn aminokyselin ve virových proteinech. Z nich nejvýznamnější je mutace v jednom ze šesti klíčových kontaktních míst domény spike proteinu, která se váže na receptor ACE 2 a odpovídá za zvýšenou vazebnou afinitu (N501Y). Další mutace spike proteinu je delece (69–70del), která je spojována s únikem před imunitní odpovědí (oslabením imunogenicity). Další mutace (P681H) je v bezprostřední blízkosti domény spike proteinu, která se štěpí furinovou proteázou a hraje roli při vstupu viru do lidské buňky.
Varianta B.1.351 / 501.V2 (β dle WHO) = beta
Další varianta viru, označovaná 501Y.V2 (také označována B.1.351) pochází z Jihoafrické republiky a během dvou měsíců se zde stala dominantní. Lékaře znepokojuje, že způsobuje kritická onemocnění u mladších a jinak zdravých pacientů, a také napadá i některé pacienty, kteří již onemocnění prodělali. Tato varianta byla zanesena do Velké Británie, Německa, Francie, Švýcarska, Belgie nebo Rakouska. Přítomnost této varianty byla v únoru 2021 potvrzena také v České republice.
Vysoká infekčnost je spojována se substitucemi třech aminokyselin v klíčové části spike glykoproteinu (K417N, E484K, N501Y), kterou se váže na receptor lidských buněk (ACE2). Firmy Novavax a Janssen už ohlásily nižší účinnost svých vakcín proti této variantě viru, ale proces výroby vakcín umožňuje pružně reagovat na jakékoli modifikace viru v relativně krátké době. Podobně byla o něco méně účinná i vakcína firmy Pfizer, ale celkově se ukázala být proti této variantě funkční. Podobně vakcína AstraZeneca by mohla chránit proti těžkému průběhu nemoci.
Varianta P.1 / 501Y.V3 (γ dle WHO) = gama
Tato varianta, označovaná také 501Y.V3, byla poprvé detekována v Tokiu v lednu 2021 u čtyř turistů, kteří přiletěli z brazilského státu Amazonas. Představuje nový fenotyp, konvergentně vyvinutý z původního kmene označovaného B.1.1.28. V Brazílii se P.1 nevyskytovala do listopadu 2020, ale ve vzorcích z druhé poloviny prosince 2020 už představovala 42 %. Varianta má 17 mutací, včetně biologicky významných záměn aminokyselin ve spike-proteinu (K417T, E454K a N501Y), které má společné s jihoafrickou variantou B.1.351 a delecí del. 11288-11296 (ORF 1b), která je společná s britskou B 1.1.7. Všechny uvedené mutace zvyšují infekčnost viru a vedly k rapidnímu růstu hospitalizací ve městě Manaus.
Kmen P.1 je podle lékařů až 2,2krát nakažlivější než předchozí verze SARS-CoV-2 a je u něj až o 61 procent vyšší riziko, že se lidé nakazí opakovaně. V Brazílii byl v březnu 2021 odpovědný za většinu nakažených a mezitím se stačil rozšířit do dalších 20 zemí. Zhruba třicet procent lidí, kteří po nákaze P.1 umírají, je mladší 60 let. Brazílie neprovádí v potřebném rozsahu sekvenaci vzorků viru, ale existují doklady že začala mutovat i samotná varianta P.1 a vykazuje změny, které by ji mohly učinit ještě nakažlivější. Vědci uvádějí, že podle předběžných studií jsou existující vakcíny účinné i proti kmeni P.1, ale čínská vakcína, kterou Brazílie užívá nejvíce, je šestkrát méně účinná proti variantě P.1 než proti původnímu kmenu SARS-CoV-2. Do 9. dubna 2021 bylo vakcinováno méně než 10 % obyvatel a celková úmrtnost činila 15 500 lidí za jediný týden.
Během šíření varianty P.1 se stále snižoval průměrný věk úmrtí v Brazílii. Z původních 71 let se snížil na 59 let.
Další nebezpečná varianta popsaná z Brazílie je označovaná P.2 / GR/484K.V2 (ζ dle WHO). Brazílie s počtem úmrtí, který v červnu 2021 přesáhl 500 000, se stala po USA druhou nejpostiženější zemí a ocitla se v kritické situaci i kvůli nízkému procentu vakcinovaných (15 %).
Varianta B.1.525 (η dle WHO) = éta
Tato varianta, označovaná též VUI-21FEB-03 nebo G/484K.V3 a považovaná spolu s B.1.526 za variantu hodnou zájmu (variant of interest), je v tisku uváděna jako nigerijská. Původně byla zachycena v prosinci 2020 ve Velké Británii (UK1188) a v Nigérii, kde se později stala převažující formou SARS-CoV-2. Vyskytuje se ve 36 zemích, včetně Polska, Německa a Rakouska. Nese stejnou záměnu E484K a deleci ΔH69/ΔV70 jako ostatní infekční formy viru, ale obsahuje důležitou novou mutaci F888L v S2 doméně spike proteinu, která zvyšuje rezistenci vůči protilátkám a mutaci Q677H, která stabilizuje dimer S1 a S2 spike proteinu. Varianta B.1.525 má řadu dalších mutací ve strukturálních transmembránových proteinech E: (l21F), M:(I82 F), a N:(A12G) a (T208I) a v proteinovém komplexu virové RNA dependentní RNA polymerázy: NSP3: (T1189I), NSP6: (delece tří aminokyselin 106- 108), a NSP12: (P323F). Tyto mutace mohou přispívat k vyšší účinnosti replikace.
Varianta B.1.617 (δ dle WHO) = delta
Klad 21A varianty delta se objevil v Asii zhruba v květnu roku 2020. V Indii se objevila varianta koncem roku 2020 a v březnu 2021 byla u 15–20 % zkoumaných vzorků zachycena nová varianta viru, označovaná jako B.1.617.1 (VUI-21APR-01, kapa dle WHO), obsahující dvě významné mutace E484Q a L452R, které odpovídají za zvýšenou infekčnost viru a propůjčují viru vyšší odolnost vůči protilátkám. V dubnu již tvořila 61 % zachycených vzorků. Kromě ní se v Indii vyskytují mutace B.1.1.7, B.1.351 a P.1. V několika indických státech tvořila 33–50 % zachycených vzorků nová varianta viru s mutací N440K. Do března 2021 nebylo možné určit, zda odpovídá za rychlý růst počtu nakažených v několika regionech. V Indii se v polovině dubnu 2021 nakazilo za jediný den až více než 200 000 obyvatel, celkem zemřelo 174 000 osob. Ačkoli je tato varianta viru zřejmě nakažlivější než britská, nemoci podléhají pouze lidé, kteří nebyli vakcinováni. Všechny z nejčastěji používaných vakcín od firem AstraZeneca, Pfizer i Moderna podle předběžných údajů z Indie chránily před nakažením nejméně z 97 %. Všechny vakcíny chrání před těžkým průběhem onemocnění a úmrtím z 80-90%. Naproti tomu u neočkovaných je riziko hospitalizace a přijetí na JIP více než dvojnásobné oproti původní variantě Wu-han a riziko úmrtí vyšší o 133 %. Varianta delta je nakažlivější než varianty alfa, beta a gama, její inkubační doba se zkrátila na 3,7 dne a virová nálož je 1260 x vyšší než u kmenu Wu-han.
Ve indickém státě Maharasthra byla třetí vlna pandemie částečně spojena s variantou viru, která je označována jako B.1.617.2 (VOC-21APR-02, delta dle WHO), a obsahuje současně tři nebezpečné mutace spike proteinu v doméně, kterou se váže na ACE receptor (RBD) – A484Q, T474K a L452R. Vědci analyzovali 598 kompletních genomů viru a kromě toho zkoumali krystalovou strukturu deseti mutantních spike proteinů s rozštěpeným furinovým místem v komplexu s ACE2 receptorem. Od ledna 2021 narůstala frekvence mutací L452R and E484Q v RBD a také další nesynonymní mutace mimo RBD: G142D a P681R a dále T19R, E154K, D614G, Q1071H, H1101D. Mutace přispívají ke stabilitě spike proteinu ve vodném prostředí (výměna hydrofobního L za hydrofilní R v pozici 452), usnadňují štěpení furinovou proteázou a následnou fúzi s membránou (P681R) nebo snižují účinnost terapeuticky užívaných monoklonálních protilátek (L452R a E484Q).
Podle anglického úřadu veřejného zdraví (PHE) varianta delta je až o 60 % nakažlivější ve srovnání s britskou variantou alfa a zvyšuje riziko hospitalizace více než 2,5násobně. Ve Velké Británii se prvně objevila v únoru a už v květnu 2021 odpovídala za tři čtvrtiny nově nakažených a postupně vytlačila variantu alfa. V červnu 2021 ve Velké Británii varianta delta odpovídala za 90 % nově nakažených, ale většinou šlo o mladé neočkované lidi ve věku 12-20 let. Průběh infekce připomíná běžné nachlazení s bolestí hlavy, rýmou a zanícením v hrdle.
Jedná se o variantu, která je mnohem nebezpečnější pro děti. V Anglii končí 1/75 nakažených dětí v nemocnici.
Varianta B.1.1.529 (ο dle WHO) = omikron
V Jihoafrické republice byla ve školách a mezi mladými lidmi v listopadu 2021 zachycena ve větší míře nová varianta označená B.1.1.529 (ο dle WHO). Vznikla patrně v létě roku 2021. Vědce znepokojuje vysoký počet celkem 30 mutací aminokyselin, které virus akumuloval ve spike proteinu. Ty zásadně změnily jeho prostorovou konformaci a mohou být odpovědné za odolnost vůči protilátkám. Kromě toho má varianta omikron celkem deset mutací jen v doméně, kterou se váže na receptor ACE2 (Angiotensin-converting enzyme 2) lidských buněk (delta má pouze dvě takové mutace). Počítačové simulace spike proteinu naznačují, že virus by mohl unikat i imunitě zprostředkované T lymfocyty. Nástup nové varianty B.1.1.529 je výrazně strmější než u předchozích variant beta (dominovala na přelomu let 2020/2021) a delta (dominantní od června 2021, kdy nahradila variantu alfa). Ve spike proteinu kumulovala veškeré mutace charakteristické pro vysoce infekční a nejnebezpečnější varianty alfa, beta a delta, označované WHO jako tzv. VOC (Variants of concern). Kromě toho obsahuje nové mutace, jejichž význam dosud není zřejmý. Řada států už zrušila lety z afrických zemí, kde byla nová varianta viru potvrzena. V listopadu 2021 byla WHO zařazena mezi znepokojivé varianty (VOC). K mutacím viru patrně došlo v myších.
Novou variantu viru je možné odhalit PCR testem, kde jako charakteristický marker slouží tzv. S gene dropout nebo S gene target failure - to znamená, že PCR test není schopen detekovat gen pro spike protein. Ten je jedním ze tří genů, na který je PCR test nastaven. Varianta Omikron má oproti předchozím selekční výhodu a vykazuje mnohem rychlejší nástup šíření. V Dánsku, kde se sekvenuje až 50 % zachycených vzorků viru a ve Velké Británii (sekvenováno 16 % vzorků) je v prosinci 2021 potvrzen komunitní přenos varianty omikron. Vzestup záchytů je 2 až 3násobný, bez jakékoli spojitosti s cestovatelskou anamnézou.
Vysoký počet nahromaděných mutací umožňuje variantě omikron obejít imunitu navozenou vakcinací. V Dánsku, kde bylo touto variantou ke 14. 12. 2021 nakaženo už 3 437 lidí, bylo z toho počtu celkem 75 % plně očkovaných dvěma dávkami. Podle studie, kterou nechala udělat největší jihoafrická zdravotní pojišťovna Discovery Health, vakcinace mRNA od firmy Pfizer poskytuje jen asi 33 % ochranu před nakažením variantou omikron, ale stále chrání před těžkým průběhem a hospitalizací zhruba ze 70 %.
Podle jihoafrické lékařky Angelique Coetzee se symptomy onemocnění variantou omikron liší od původního viru. U mnoha nakažených, mezi kterými převažují neočkované děti, se projevilo vysokým krevním tlakem, silnou únavu a kašlem. Žádný z jejích pacientů podle ní neztratil čich ani chuť, příznaky jsou většinou mírné. Data pro JAR z 10. prosince 2021 ukazují téměř kolmý vzestup nákazy novou variantou omikron (šestinásobek během 2 týdnů) ale pouze mírný vzestup počtu hospitalizovaných. Průměrná doba pobytu v nemocnici se naopak výrazně zkrátila z osmi na 2,8 dne a nijak se nezvýšil počet úmrtí. Vlna onemocnění variantou omikron v JAR dosáhla vrcholu během tří týdnů a od 17.12. počet nově nakažených klesá. Úmrtnost zůstala velmi nízká a sedmidenní průměr se pohybuje kolem 0,50 na milion obyvatel. Oproti variantě delta, kde bylo hospitalizováno až 19 % nakažených je u varianty omikron procento hospitalizovaných jen kolem 1,7 %. V JAR mohou být výsledky oproti jiným zemím zkresleny tím, že je zde nižší průměrný věk a covid už dříve prodělalo až 80 % populace a má vytvořenou imunitu. Snížení hospitalizací a úmrtí oproti variantě delta lze přičíst pouze čtvrtinu, zbytek je efekt zvýšené imunity.
Z údajů zveřejněných 2. ledna 2022 vyplývá, že varianta omikron se množí především v horních cestách dýchacích a většinou nepronikne do plic. K podobným závěrům došly i experimenty na zvířatech. To vysvětluje vysokou infekčnost i celkově lehčí průběh onemocnění. Izraelský koordinátor boje proti covidu-19 Nachman Aš soudí, že rychlý nástup vlny onemocnění variantou omikron, která může v devítimilionové populaci Izraele do konce ledna postihnout 2-4 miliony lidí, přinese stádní imunitu.
Varianta omikron dokáže obejít imunitu očkovaných 2,7krát až 3,7krát snadněji než předchozí převažující varianta delta. Monoklonální protilátky, které u varianty delta asi ze 70 procent brání vážnému průběhu nemoci covid-19, podle nových studií v případě omikronu nefungují.
- přehled mutací varianty omikron
Subvarianty BA.2 a BA.3
Další dvě sublinie jsou označovány jako BA.2/B.1.1.529.2 a BA.3/B.1.1.529.3. Kromě mnoha společných mutací se od původní linie omikron B.1.1.529 výrazně liší. BA.1 a BA.2 navzájem sdílejí 32 mutací, ale dalšími 28 mutacemi se liší. Tím se BA.2 podobá spíše některým jiným hlavním variantám a bylo navrženo, aby BA.2 dostala vlastní název podle řecké abecedy.
Nástup BA.2 byl velmi rychlý. První potvrzená sekvence BA.2 v databázi GISAID pochází ze 17. listopadu 2021. Na přelomu prosince 2021 a ledna 2022 se stala dominantní přinejmenším v některých částech Indie (koncem prosince 2021 již tvořila téměř 80 % v Kalkatě) a na Filipínách, stala se častou ve Skandinávii, Jižní Africe a Singapuru a vykazovala známky nárůstu v Německu a Spojeném království. V Dánsku byla první BA.2 ve vzorku odebraném 5. prosince 2021. Ve druhém týdnu (10.-16. ledna) roku 2022 se frekvence obou subvariant téměř vyrovnala, obě byly mírně pod 50 procenty (kolem jednoho procenta byla rychle mizející Delta). Poté se BA.2 v Dánsku stala dominantní subvariantou, ale nedošlo k žádnému dramatickému zhoršení celkové situace. K 24. lednu 2022 dánské zdravotnické orgány nezaznamenaly rozdíly mezi BA.1 a BA.2 v hospitalizacích nebo závažnosti a první údaje z Indie ukazují stejným směrem. V Dánsku byla míra průlomu imunity u lidí, kteří byli očkováni nebo byli předtím infikováni COVID-19, podobná míře průlomu a reinfekce pozorované u BA.1. K 17. lednu 2022 byl BA.2 zjištěn nejméně ve 40 zemích a na všech kontinentech kromě Antarktidy. V Česku byla k 25. lednu 2022 subvarianta BA.2 zachycena u 173 osob a tvoří asi 4 % případů.
Hlavním rozdílem mezi BA.2 a "standardní" subvariantou omikron je, že BA.2 nemá charakteristickou deleci (Δ69-70) způsobující tzv. S-gene target failure (SGTF), podle které je mnoho qPCR testů schopno rychle odhalit případ jako variantu omikron. Třetí sublinie Omicron, BA.3, je zatím velmi vzácná a nepředstavuje stejný potenciální problém při detekci, protože má deleci SGTF (Δ69-70), podobně jako BA.1.
Subvarianty BA.4 a BA.5
Varianta BA.4 byla v dubnu 2022 detekována v Jižní Africe, Botswaně, Dánsku, Skotsku a Anglii a první údaje naznačovaly, že je nakažlivěší než převládající BA.2. V květnu 2022 ji jako VOC označilo Evropské centrum pro prevenci a kontrolu nemocí (ECDC) a britská UKHSA. Varianta BA.5 se v květnu 2022 stala dominantní v Portugalsku. V červnu 2022 se obě nové varianty staly dominantními v Německu, Velké Británii, USA a Francii. V Česku tvoří obě varianty v červenci 2022 téměř 87 % všech případů. Podle dostupných dat zřejmě lépe unikají virus neutralizačním protilátkám navozeným předchozími onemocněními, ale nijak nezhoršují průběh onemocnění.
Subvarianta BA.4.6, která patrně vznikla rekombinací v USA a tvoří tam 9% všech infekcí, se objevila ve Velké Británii a v září 2022 už představovala 9% nových infekcí. Oproti původní BA.4 se v časné fázi infekce rychleji replikuje, je odolnější vůči vakcinaci starší vakcínou proti SARS-CoV-2 wuchanského typu a nelze ji léčit protilátkovou terapií Evusheld. Průběh infekce je ale mírný a neliší se od jiných variant omicronu.
Subvarianta Centaurus (BA.2.75, BA.2.76)
Zatím nejinfekčnější subvarianta Omikronu označovaná Centaurus (Kentaur) se objevila poprvé v květnu 2022 v Indii a rychle vytlačuje předchozí variantu BA.5. Příznaky onemocnění jsou stejné nebo mírnější a předchozí prodělání covidu nebo vakcinace poskytují dostatečnou ochranu. V Česku potvrdila Národní referenční laboratoř první případ subvarianty koronaviru BA.2.76 v pondělí 18. července 2022.
Subvarianta Pirola (BA.2.86)
Nová varianta Omicronu, která se začala šířit koncem srpna 2023 v Dánsku, Izraeli a USA má oproti XBB.1.5 celkem 30 nových mutací ve spike proteinu a podobá se tak radikální změně, ke které došlo při mutaci varianty Delta na Omicron. V září byla Pirola zachycena už v 11 zemích. Nové mutace způsobily, že virus lépe obchází imunitu získanou očkováním nebo předchozí infekcí SARS-CoV-2 a patrně odpovídají za nárůst počtu infikovaných, ale zatím nejsou důkazy, že by vedly k těžšímu průběhu onemocnění.
Subvarianta XBB.1.5
Subvarianty Omikronu s označením XBB byly sledovány několik měsíců a dosavadní bádání ukazuje, že obsahují prvky, které zvyšují schopnost překonat imunitní reakci. Subvarianta XBB.1.5 se objevila koncem října 2022 ve státech New York a Connecticut. V posledním týdnu roku 2022 zdvojnásobila svůj podíl na celkových infekcích omikronem a odpovídala za 40,5 procenta infekcí napříč USA. Vznikla rekombinací dvou subvariant Omicronu BA.2 a získala tak 14 nových mutací ve spike-proteinu. Od příbuzných podtypů se odlišuje mutací spike proteinu F486P, která zvyšuje odolnost viru vůči protilátkám, ale nezvyšuje celkovou smrtnost.
Subvarianta XBB 1.16
Nová varianta Omicronu označovaná XBB 1.16 nebo acturus se objevila v lednu 2023 v Indii a odpovídá za rychlý nárůst případů. Ze všech známých variant viru se šíří nejrychlejším tempem. Podle WHO obsahuje novou mutaci oproti XBB.1.5, která odpovídá za vyšší infekčnost, ale příznaky onemocnění se od předchozí varianty nijak neliší. Varianta XBB 1.16 (spolu s XBB.1.9.1 a XBB.1.9.2) je na vzestupu také v USA a byla zařazena mezi sledované.
EG.5 a EG.5.1
Jedná se o subvarianty odvozené z XBB 1.9.2 s novými mutacemi ve spike proteinu, které zvyšují infekčnost a umožňují vyhnout se imunitní reakci. Konkrétně se jedná o mutace F456L (záměna fenylalaninu za leucin v pozici 456) u EG.5 a další mutaci Q52H (záměna glutaminu za histidin v pozici 52) u varianty EG.5.1. První případy infekce touto variantou přezdívanou Eris byly zaznamenány v únoru 2023 a od června do července stoupl podíl těchto nových variant na infekcích virem SARS-CoV-2 globálně ze 7,6 na 17,4 %. Žádná z nových variant EG.5 nezpůsobuje těžší průběh onemocnění ani úmrtnost.
JN.1
Nová subvarianta JN.1 vznikla velkým počtem nových mutací z BA.2.86 (Pirola) během léta v USA a od té doby se lavinovitě šíří. V prosinci 2023 už představovala téměř polovinu nových infekcí v USA. JN.1 má oproti BA.2.86 kolem 30 nových mutací, z toho pouze jednu ve spike proteinu, ale ta jí dovoluje překonat imunitu vytvořenou proti předchozím variantám a zhruba dvojnásobně snižuje účinky neutralizačních protilátek. WHO ji označila za variantu hodnou pozornosti a výzkumníci odhadují, že během několika týdnů bude dominantní globálně. Exponenciální nárůst infekcí i hospitalizací byl zaznamenán v Dánsku, Španělsku, Belgii, Francii a Holandsku a podobný nárůst zaznamenává Kanada, Asie a Austrálie. Dobrou zprávou je vysoká účinnost očkování nejnovější m-RNA vakcínou proti variantě XBB.1.5, která chrání i proti JN.1 (13,3 - 27,4 krát).
Další varianty
Varianta 20A.EU1 se objevila počátkem léta 2020 ve Španělsku a turisté ji následně rozšířili po celé Evropě.
V New Yorku se od listopadu 2020 rychle šířila nová varianta označovaná B.1.526 (ι dle WHO). Kumuluje nebezpečné mutace spike proteinu, které odpovídají za nižší účinnost neutralizačních protilátek (E484K) a za vyšší afinitu k ACE2 receptoru na lidských buňkách (S477N). V polovině února 2021 tvořila varianta B.1.526 už 27 % nových virových sekvencí dodaných do databáze GISAID.
Dvě příbuzné kalifornské varianty viru, označované B.1.427 a B.1.429 / S:452R (ε dle WHO), způsobují vážnější průběh onemocnění, při kterém je třeba pacienty připojit na kyslíkovou podporu. Vyznačují se rovněž asi o 20 % vyšší infekčností a zvýšenou rezistencí vůči protilátkám získaných po prodělání onemocnění nebo po vakcinaci.
V Bretani byla nalezena varianta covidu-19, kterou neodhalily běžné PCR testy a byla potvrzena až po odběru krve. Sekvenováním byla zjištěna u osmi z celkem 79 hospitalizovaných pacientů v nemocnici města Lannion, a ukázalo se že jde o novou, dosud neznámou mutaci viru. K březnu 2021 chyběly údaje o infekčnosti nebo závažnosti onemocnění a nebylo známo, do jaké míry je proti této nové mutaci účinné očkování.
V Japonsku byla u turisty, který přicestoval z Filipín, zachycena nová varianta SARS-CoV-2, prozatímně označovaná jako P.3 nebo VUI-21MAR-02(9.3) /GR/1092K.V1 (θ dle WHO), známá od 9. března a odlišná od britské, brazilské nebo jihoafrické varianty. Je považována za stejně nebezpečnou neboť může být odolnější vůči neutralizačním protilátkám získaným vakcinací. Nově byla filipínská varianta viru zanesena také do Anglie. Podle analýz obsahuje nová varianta epidemiologicky významné záměny E484K a N501Y. Na Filipínách byly předtím zachyceny všechny nové nakažlivější mutace, včetně B 1.1.7, B.1.351 a P 1.
Varianta označovaná B.1.617.1 nebo G/452R.V3 (κ dle WHO) byla poprvé zaznamenána v Indii v říjnu 2020 a popsána v dubnu 2021.
Mezi nejhůře zasažené země patří Peru, odkud byla popsána varianta C.37 / GR/452Q.V1 (λ dle WHO).
V Angole byly u cestujících z Tanzánie identifikovány tři vzorky nové varianty označené provizorně jako A.VOI.V2. Ta obsahuje tři delece a 11 substitucí aminokyselin ve spike proteinu (z celkových 31 substitucí). Tři substituce (R346K, T478R, E484K) zahrnují receptor-binding domain. Z dalších celkem 5 substitucí a tří delecí v N-terminální doméně spike proteinu se některé kumulují v tzv. antigenní superdoméně (Y144Δ, R246M, SYL247-249Δ a W258L) a poblíž místa S1/S2 štěpeného furinovou proteázou (H655Y a P681H).
Mezi monitorované varianty patří B.1.640, zachycená v září 2021 v Kongu. Obsahuje mutace D614G, F490R, N394S, N501Y, P681H, R346S, Y449N, 137−145del, ale není známo jaká je její infekčnost. Později byla přejmenována na B.1.640.1. Klon této varianty označovaný B.1.640.2 byl zavlečen do Francie z Kamerunu. Obsahuje více mutací než varianta omikron - celkem 46 záměn a 37 delecí nukleotidů, jejichž výsledkem je 30 záměn a 12 delecí aminokyselin, z toho 14 záměn a 9 delecí ve spike proteinu. Tato varianta přes vysoký počet mutací nezpůsobila žádné větší ohnisko infekcí a nikde nevytlačila variantu delta.
Konkrétní záměny aminokyselin u nejvýznamnějších mutací
- D614G záměna kyseliny asparagové za glycin v pozici 614 spike-proteinu. Dominantní a nakažlivější varianta viru SARS-CoV-2 od července 2020, zejména v Evropě
- E484K záměna kyseliny glutamové za lysin v pozici 484 spike-proteinu. Vyskytuje se u vysoce infekčních variant viru P.1 a P.2 (B.1.1.248) z Japonska a Brazílie a u jihoafrické mutace 501.V2. Odpovídá za sníženou antigenicitu viru (tzv. escape mutation) a snižuje vazbu neutralizačních protilátek 10-60násobně.Mutace E484K se jeví jako potenciálně velmi nebezpečná, protože v pokusech in vitro umožnila mutantnímu viru SARS-CoV-2 infikovat kontrolní linii lidského plicního adenokarcinomu, které chybí receptor ACE2. Původní (divoký) kmen viru tyto buňky nebyl schopný infikovat. Nový receptor zatím nebyl identifikován, ale infekci zablokovalo hydrolytické odstranění heparansulfátu z povrchu buněk. Infekci brání také monoklonální protilátky proti spike proteinu i séra vakcinovaných osob, zatímco convalescentní séra byla méně účinná.
- N501Y záměna asparaginu za tyrosin v pozici 501 spike-proteinu, v místě kterým se váže na receptor ACE2 lidských buněk. Zvyšuje vazebnou afinitu spike-proteinu a tím i infekčnost této varianty SARS-CoV-2. Byla zjištěna u mutací označovaných jako P.1. (Japonsko, Brazílie), B.1.1.7, též známá jako Variant of Concern 202012/01 (Velká Británie a Evropa), 501.V2 (jižní Afrika) a COH.20G/501Y (dominantní v Columbus, Ohio, USA).
- L452R záměna leucinu za arginin v pozici 452 spike-proteinu. Charakteristická pro variantu viru B.1.429 dominantní v Kalifornii. Odstraňuje hydrofobní interakci v sousedství pozice 452 a je zřejmě odpovědná za vyšší stabilitu spike-proteinu ve vodném prostředí.
- S477N záměna serinu za asparagin v pozici 477 spike-proteinu. Odpovídá za vyšší vazebnou afinitu k receptoru ACE2.
- F888L záměna fenylalaninu za leucin v S2 subjednotce spike proteinu sousedící s membránou. Podobná záměna v pozici 870 se objevila u pacienta s přetrvávajícím onemocněním covid-19 a je patrně odpovědná za rezistenci vůči protilátkám.
- Q677H záměna glutaminu za histidin. Zvyšuje stabilitu komplexu S1 a S2 podjednotek a patrně tak podporuje otevřenou konformaci vazebné domény spike proteinu a tím zvyšuje infekčnost viru.
- P681R záměna prolinu za arginin v pozici 681, která usnadňuje štěpení S proteinu proteázou a změnu konfigurace na S1/S2, která umožňuje průnik viru buněčnou membránou.
- F486P záměna fenylalaninu za prolin v pozici 486 spike-proteinu, která nemění pevnost vazby na receptor, ale propůjčuje viru odolnost vůči protilátkám získaným imunizací nebo proděláním infekce.
Rekombinantní mutace
Při současné replikaci dvou variant viru v jedné buňce může dojít k vzájemné rekombinaci a skokové evoluci vlastností viru. Tuto událost, kterou je možno zjistit pouze důslednou sekvenací genomů, se podařilo potvrdit počátkem února 2021 Bette Korber z Národní laboratoře Los Alamos ve Spojených státech amerických. Rekombinantní virus, který vznikl mechanismem přepnutí šablon (template switching) během replikace, nese deleci Δ69/70 „britské“ varianty, která zřejmě zvyšuje infekčnost a mutaci L452R „kalifornské“ varianty, která zřejmě souvisí s odolností vůči protilátkám po nemoci.
XD (Deltacron)
V březnu 2022 vědci detekovali rekombinantní mutaci varianty omicron a delta při koinfekci u jednoho pacienta a nezávisle na tom dvě infekce způsobené novým rekombinantním virem. V obou případech pocházel 5'-konec virového genomu z genomu delta a 3'-konec z genomu omicron, ačkoli body zlomu byly odlišné. Nový rekombinantní virus byl prozatímně označen jako XD nebo jako Deltacron. Jeho spike protein pochází z varianty omicron a zbytek viru má charakteristiky varianty delta. Varianta označovaná jako XD je zatím vzácná. Vědci ji zatím zjistili pouze ve Francii, Dánsku, Belgii, Nizozemsku a Německu a v USA, nejméně jeden se objevil ve Velké Británii a v Brazílii.
XE
Tato rekombinantní varianta SARS-CoV-2 obsahuje část genomu varianty Omicron BA.1 (ORF-1a po basi 11 537, kódující nestrukturální proteiny 1-6) a zbytek genomu tvoří varianta Omicron BA.2. Do 22. března 2022 bylo ve Velké Británii zachyceno 763 vzorků a přírůstek frekvence zhruba 9,8 % oproti variantě BA.1. Varianta BA.2 přitom během prvních měsíců roku 2022 postupně nahrazuje variantu BA.1.
XF
Tato rekombinantní varianta SARS-CoV-2 obsahuje část genomu varianty delta (ORF-1a po basi 5 386, kódující nestrukturální proteiny 1-3) a zbytek genomu patří variantě Omicron BA.1. Ve Velké Británii bylo mezi lednem a polovinou února 2022 zachyceno celkem 39 vzorků.
Strukturní biologie
Virová částice viru SARS-CoV-2 má průměr 50–200 nanometru. Virion má většinou velikost 80 až 120 nm.
Genom viru

SARS-CoV-2 patří mezi velké obalené viry, jejichž genom tvoří tzv. ssRNA (Positive-sense single-stranded RNA), která po vstupu do buňky funguje jako mRNA a po navázání na ribosom se začne přepisovat. První 2/3 genomu obsahují geny potřebné k replikaci, které kódují 16 proteinů. Tato část se přepíše do dvou velkých polyproteinů (pp1ab -∼790 kDa, pp1a -∼490 kDa) které jsou následně rozštěpeny na jednotlivé peptidy virovými proteázami (3CLpro nebo Mpro – hlavní 3C-like proteáza, PL2pro – vedlejší papain-like cysteinová proteáza). Bezprostředně před sekvencí pro PL2pro je tzv. SUP (SARS-CoV-unique nebo "orphan domain"), sekvence 375 aminokyselin, která se u jiných koronavirů nevyskytuje.
Zde je zajímavé zmínit, že přepis pp1ab zahrnuje ribosomální frameshift o jeden nukleotid proti směru hned před terminačním kodonem. Může za něj tzv. klouzavá sekvence (UUUAAAC) a „pseudouzel“ (pseudoknot) RNA na konci ORF 1a.
Mezi prvními přepsanými proteiny je RNA-dependentní RNA polymeráza (RdRp) (ns12) a NTPáza/helikáza (ns13). Prvních 16 nestrukturních proteinů spontánně vytvoří RTC komplex (replikáza, transkriptáza). Protein nsp14 je 3'-5' exoribonukleáza, která kontroluje správnost transkripce. Její funkce je důležitá vzhledem ke značné velikosti genomu SARS-CoV-2 (∼29.7 kb, se 14 open reading frames (ORFs), které se částečně překrývají a nepřekládanými 5′ and 3′- konci obsahujícími 265 a 342 nukleotidů).
Nsp14 je bifunkční enzym, který má aktivitu 3′–5′ exoribonukleázy a mRNA cap guanine-N7 metyltransferázy (N7-MTase). Působí v komplexu s dalším nestrukturním proteinem nsp10, který stabilizuje její katalytickou doménu. Je schopna rozeznat a eliminovat i ribonukleosidové analogy užívané jako antivirotika a odpovídá za rezistenci vůči Remdesiviru, který je užíván při léčbě covid-19.
RNA-dependentní RNA polymeráza (RdRp) přímo řídí syntézu komplementárních molekul nsRNA (negative-sense subgenomic RNA) z genomové psRNA (positive-sense genomic RNA). Následuje transkripce nsRNA na odpovídající ps RNA nového genomu viru. Helikáza zajišťuje separaci řetězců dvouřetězcové RNA po replikaci genomu viru.
Zbývající část genomu kóduje čtyři strukturální proteiny tvořící obal virové RNA (spike (S), membrane (M), envelope (E), nucleocapsid (N)) spolu s 8 doprovodnými proteiny (orf3 - orf9), které nemají významnou homologii se sekvencemi virových proteinů nebo jinými koronaviry a jejich funkce je nejasná. Translace RNA probíhá v endoplasmatickém retikulu infikované buňky a proteiny S, M, E a N se posunují do Golgiho komplexu, kde probíhá posttranslační modifikace a M proteiny zprostředkují organizaci virové nukleokapsidy. Kompletní virové částice se uvolňují sekrečními váčky procesem exocytózy. Publikace genomu vedly k vytvoření několika modelů peplomerového S (spike) proteinu, které potvrzují, že struktura S proteinu je komplementární k receptoru ACE2. Ten funguje jako receptor Angiotenzin konvertujícího enzymu 2 a virus ho využívá ke vstupu do buňky. Dne 22. ledna na sobě nezávisle čínská a americká skupina reverzní genetikou experimentálně demonstrovaly ACE2 jako receptor pro SARS-CoV-2.
- Apoptóza buňky pacienta s koronaviry SARS-CoV-2, skenovací elektronový mikroskop, dodatečně barevně odlišeno
- Koronavirus SARS-CoV-2 v transmisním elektronovém mikroskopu, dodatečně barevně odlišeno
- 6VSB spike protein SARS-CoV-2 – trimer ze strany a shora, monomery odlišeny barevně
- 3D tisk – koronavirus spike. Vyčnívající část červeně označeného gylykoproteinu S zprostředkuje vazbu viru na receptor ACE2 lidské buňky
- Schéma replikačního cyklu koronaviru
- Replikační-transkripční komplex koronavirů složený ze 16 nestrukturních proteinů
Spike protein
Při vstupu viru do buňky hraje roli trimer glykoproteinu S, který tvoří „spike“ a obsahuje doménu vážící se na receptor a další doménu, která po rozštěpení buněčnou proteázou umožní fúzi viru s buněčnou membránou. Tato doména virového obalu chybí u jiných SARS-CoV-2-příbuzných kmenů rozhoduje o tom, zda je schopen překročit mezidruhovou bariéru. Obsahuje sekvenci aminokyselin štěpenou peptidázou furinem (PACE, Paired basic Amino acid Cleaving Enzyme) a vykazuje nápadnou shodu s vysoce virulentním kmenem ptačí chřipky H5N1, který vznikl mutací virů ptačí chřipky které nezpůsobovaly onemocnění lidí. Tato sekvence je oproti RNA nepatogenních kmenů koronavirů o 12 nukleotidů delší a chybí u kmenů koronaviru izolovaných z netopýrů (CoV RaTG-13) i luskounů. Vysoce virulentní forma SARS-CoV-2 tak mohla vzniknout rekombinací koronaviru a viru ptačí chřipky v lidských buňkách.
Spike protein je homotrimerický protein, každý z jeho monomerů je složen ze 2 podjednotek – S1 zodpovědná za vazbu k ACE2 receptoru a S2 zodpovědná za fúzi virální a buněčné membrány. Spike protein viru SARS-CoV-2 se na ACE2 receptor váže 10 krát pevněji než Spike protein viru SARS-CoV. To může být zprostředkováno rozdílnou strukturou receptor-vázající domény (RBD) v daných proteinech. U spike proteinu různých koronavirů je pro správnou vazbu na ACE2 receptor důležitých 6 aminokyselin. SARS-CoV a nový SARS-CoV-2 se liší v pěti z těchto aminokyselin. SARS-CoV-2 má navíc ACE2-interagující Lys417, který interaguje s Asp30 receptoru ACE2. Tento lysinový zbytek je u viru SARS-CoV nahrazen aminokyselinou valin, která se vazby na ACE2 neúčastní. Gen pro Spike protein viru SARS-CoV-2 má také inserci 12 bazí: ccucggcgggca. Tato mutace vytváří funkční polybazické štěpné místo pro furinovou proteázu (též označovanou PACE – Paired basic Amino acid Cleaving Enzyme) na pomezí S1 a S2 podjednotek.
Spike protein degraduje během jednoho dne.
Nukleokapsidový protein N
Tento protein slouží ke stabilizaci konformace (zabalení) virové mRNA uvnitř virové částice. Ukázalo se, že některé mutace v tomto proteinu výrazně zvyšují infekčnost viru, ale jejich přímé zkoumání vyžadovalo laboratoř s nejvyšším zabezpečením BSL-3.
V laboratoři, kterou vede nositelka Nobelovy ceny Jennifer Doudna, nalezli způsob jak tento problém obejít pomocí tzv. "virům podobných částic" (SARS-CoV-2 virus-like particles, SC2-VLPs), které jsou tvořeny pouze prázdnou obálkou viru a místo virové RNA obsahují exogenní mRNA. V experimentech byla použita mRNA pro luciferázu, která po přepisu v cytoplasmě infikované buňky vyvolává měřitelnou luminiscenci. Část virového genomu ORF 1ab, která kóduje komplex enzymů virové polymerázy a také nukleokapsidový protein, byla rozdělena na segmenty o velikosti 2 kB a ty byly uchovány ve formě plasmidů. Z experimentů, které kombinovaly jednotlivé segmenty RNA SARS-CoV-2 s mRA pro luciferázu byl určen segment nukleokapsidového proteinu označený PS9 ze 3´ konce ORF 1ab, který zajišťuje maximální expresi luciferázy v infikovaných buňkách. Byl tak vytvořen model, který se obejde bez použití celého viru a umožňuje detailní zkoumání mutací nukleokapsidového proteinu i v normálních laboratořích.
Z experimentů vyplývá, že z celkem čtyř akumulovaných mutací N-proteinu v variantách SARS-CoV-2, které jsou infekčnější než původní virus Wu-han, každá zvyšuje desetinásobně expresi virové RNA. Mutace N-proteinu S202R a R203M zvyšují množství produkovaných virových částic padesátinásobně.
Konkrétní záměny aminokyselin u nejvýznamnějších mutací
Odkazy
Poznámky
Reference
V tomto článku byly použity překlady textů z článků Novel coronavirus (2019-nCoV) na anglické Wikipedii a 2019-nCoV na německé Wikipedii.
Externí odkazy
 Obrázky, zvuky či videa k tématu SARS-CoV-2 na Wiki Commons
Obrázky, zvuky či videa k tématu SARS-CoV-2 na Wiki Commons

Přečtěte si prosím pokyny pro využití článků o zdravotnictví.
This article uses material from the Wikipedia Čeština article SARS-CoV-2, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Text je dostupný pod CC BY-SA 4.0, pokud není uvedeno jinak. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Čeština (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.