Вода: хемиско соединение
Вода (хемиска формула: H2O) — супстанца чии молекули се составени од два атома на водород и еден атом на кислород, а истата е важна за сите познати форми на живот.


Во најчеста употреба, водата се јавува во течна агрегатна состојба, но таа има и цврста состојба (мраз) и гасна агрегатна состојба (водни испарувања или пареа). Водата покрива 71% од површината на планетата Земја. На Земјата, најчесто се наоѓа во океаните и другите големи водни тела, со 1,6% вода под површината во водоносни слоеви и 0,001% во воздухот како пареа, облаци (оформени од цврсти и течни водни честички кои лебдат во воздухот) и кондензација. Океаните содржат 97% од површинската вода, ледниците и поларните ледени покривки 2,4% и другите површински води како реки, езера и езерца 0,6%. Многу мала количина од Земјината вода се содржи во биолошките тела и во вештачки изработените производи.
Водата на Земјата постојано се движи во циклус на испарување или транспирација (евапотранспирација), кондензација и истечни води кои најчесто стигнуваат до морињата. Над површината, испарувањето и транспирацијата придонесуваат за кондензацијата врз земјата.
Чистата, свежа вода за пиење е неопходна за човекот и другите форми на живот. Пристапот до безбедна вода за пиење во последнава декада сигурно и значително се подобрува скоро во секој дел на светот. Постои јасна врска меѓу пристапот до безбедна вода за пиење и БДП по глава на жител. Но, некои набљудувачи предвидуваат дека до 2025 повеќе од половина од светското население ќе се соочи со ранливост поврзана со вода. Во извештај од ноември 2009 се предвидува дека до 2030, во некои региони на светот кои се во развој, побарувачката за вода ќе ги надмине резервите за 50%. Водата има важен дел во светската економија, бидејќи функционира како растворувач за голем број различни хемиски материи и го олеснува индустриското ладење и транспорт. Приближно 70% од свежата вода се користи во земјоделството.
Имиња
Водата може да биде именувана и со некои други имиња во склад со хемиската номенклатура:
- водородоксид;
- диводородомонооксид;
- водородхидрооксид;
- диводородоксид.
Хемиски и физички својства
Основни својства

Водата е хемиска супстанца со хемиска формула H2O: една молекула на вода содржи два атома на водород, ковалентно поврзани со еден атом на кислород.
Во природата, водата се јавува во трите агрегатни состојби и на Земјата може да заземе многу различни форми, како што се водните испарувања и облаците на небото, морската вода и сантите мраз во поларните океани, ледниците и реките во планините и течноста во Земјините водоносни слоеви.
Главните хемиски и физички својства на водата се следните:

- Водата е течност која на нормална температура и притисок нема ни вкус ни мирис. Природната боја на водата и мразот има светлосина нијанса, иако во мали количини изгледа безбојна. Мразот, исто така изгледа безбоен, а водните испарувања се невидливи како гас.
- Водата е проѕирна и поради тоа водните растенија можат да живеат во неа бидејќи сончевата светлина може да стигне до нив. Само силна УВ светлина се впива во помал интензитет.
- Бидејќи молекулата на водата не е линеарна и атомот на кислородот има поголема електронегативност од водородниот атом, носи мал негативен напон, додека водородните атоми имаат мал позитивен напон. Како резултат на ова, водата е поларна молекула со електричен диполен момент. Мрежната интеракција меѓу диполите на секојa молекулa предизвикуваат ефикасен кожа-ефект на поврзувањето на водата со други субстанци, или воздух на површината, последното ако има покачување на високиот површински притисок на водата. Оваа диполарна природа придонесува до склоноста на молекулата на водата да оформува водородни врски кои ги предизвикуваат специјалните својства на водата. Поларната природа придонесува и за прилепувањето кон други материјали.
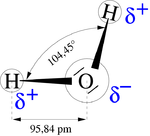
- Секое водородно јадро е поврзано со централниот кислороден атом со пар електрони кои се заеднички. Хемичарите овој зеднички пар електрони го нарекуваат ковалентна хемиска врска. Во формулата H2O, само два од шесте кислородни електрони од надворешната обвивка се употребуваат за оваа намена, оставајќи четири електрони кои се поделени во два пара слободни електрони. Четирите пара електрони кои го опкружуваат кислородот имаат склоност да се наредат што подалеку меѓусебе за да се намали одбивноста помеѓу овие облаци од негативен напон. Ова најчесто резултира со тетраедална геометрија во која аголот меѓу паровите електрони (од таму Н–О–Н е агол на поврзување) е 109,5°. Но, бидејќи двата пара слободни електрони остануваат поблиску до кислородниот атом, овие употребуваат поголемо одбивање против двата ковалентни споени пара, со што ги туркаат двата водородни атоми поблиску еден до друг. Како резултат на тоа се добива искривен тертаедарен поредок во кој Н-О-Н аголот е 104,5°

- Како резултат на заемното дејство на овие својства, капиларното дејствување се однесува на својството на водата да се движи нагоре во тесна цевка спроти гравитациската сила. На ова својство се потпираат сите васкуларни растенија, како на пример дрвјата.
- Водата е добар растворувач и често се нарекува универзален растворувач. Супстанците кои се раствораат во вода, како на пр. соли, шеќери, киселини, бази и дури и некои гасови, особено кислород, јаглерод диоксид (газирање) се познати како хидрофилични (водо-љубни) материи, додека тие што не се мешаат со вода, на пр. масти и масла се познати како хидрофобни (кои се плашат од вода) материи.
- Сите главни составни делови во клетките (белковини, ДНК и полисахариди), исто така се раствораат во вода.
- Чистата вода има ниска електрична спроводливост, но таа значајно се зголемува со растворање на мало количество јонски материјал како на пример натриум хлорид.
- Точката на вриење на водата (и сите други течности) зависи од барометарскиот притисок. На пример, на врвот од Монт Еверест, водата врие на околу 68 °C , во споредба со 100 °C на морското ниво. Обратно, водата во океанот близу геотермалните отвори може да достигне температура од стотици степени и да остане течна.

- Водата го има највисокиот специфичен топлински капацитет од која било позната супстанца после амониумот, како и висока топлина на испарување (40.65 kJ•mol−1), што се резултат на многубројните водородни врски меѓу молекулите. Овие две невообичаени својства ѝ дозволуваат на водата да ја регулира Земјината клима со придушување на големи промени во температурите.
- Водата, најголемта густина ја достигнува на 3,98 °C. Таа станува дури поретка кога ќе замрзне, проширувајќи се за 9%. Ова е резултат на еден необичен феномен: цврстата форма на водата (мраз), лебди во течна вода со што дозволува организмите да преживеат во делумно замрзнато водно тело бидејќи водата на дното има температура од околу 4 °C.
- Водата може да се меша со многу други течности, како на пример етанолот, притоа формирајќи хомогена течност. Од друга страна, водата и повеќето масла се немешливи, најчесто формирајќи слоеви со густина која се зголемува од врвот. Како гас, водената пареа е целосно мешлива со воздух.
- Водата оформува азеотроп со многу други раствори.
- Водата, со електролиза, може да се подели на водород и кислород.
- Како оксид на водородот, водата се формира кога водородот или водородните соединенија горат или реагираат со кислород или кислородни соединенија. Водата не е гориво, таа е краен производ на согорување на водородот. Енергијата потребна да се подели водата во водород и кислород со електролиза или на друг начин, е поголема од енергијата која се испушта кога водородот и кислородот повторно се спојуваат.
- Хемиските елементи кои се повеќе електропозитивни од водородот, како на пр. литиумот, натриумот, калциумот, патасиумот и цезиумот го истиснуваат водородот од водата, создавајќи хидроксиди. Како запаллив гас, водородот кој се испушта е опасен и реакцијата на водата со елементите, кои се повеќе електропозитивни од водродот, може да доведе до голема експлозија.
Синтеза, електролиза и хемиска употреба

Како хемиско соединение, водата за првпат била синтетизирана од страна на Хенри Кевендиш во 18. век, кој експериментирал со мешавина од водород и воздух, која резултирала со експлозија.
Во иднина водородот треба да стане создавач на енергија. Тој не создава примарна енергија, туку служи како пренесувач на енергијата. Добиениот водород со електролиза на водата содржи значително повеќе примарна енергија од примарната енергија што се добива со водородот. Сончевата енергија ја разделува водата на соодветен катализатор на кислород и водород, што лабораториски е докажано.
За демонстрација, електризита на вода со помош на Хофмановиот волтметар е претставена со следната хемиска равенка:
Вкус и мирис
Водата може да раствори различни материи, што ѝ дава различни вкусови и мириси. Луѓето и другите животни имаат развиено сетила, кои повеќе или помалку им овозможуваат да проценат дали водата е погодна за пиење, па според тоа избегнуваат вода која е пресолена или гнила. Луѓето, исто така, предпочитаат ладна вода наместо млака, бидејќи ладната вода содржи помалку микроби. Вкусот на изворската вода или минералната вода зависи од минералите кои се растворени во неа. Чистата вода (H2O) е без вкус и мирис. Чистотата на изворската и минералната вода зависи од неприсутноста на токсини, загадувачи и микроби.
Дистрибуција на водата во природата
Вода во универзумот
Поголемиот дел од водата во универзумот може да се добие како нус-производ на формирањето на ѕвездите. Кога се раѓа ѕвездата, нејзиниот зачеток е придружен со силен ветар од гас и прашина насочен нанадвор. Кога овој излив на материјали ќе се судри со околниот гас, создадените ударни бранови ги притискаат топлината и гасот. Водата се формира во овој топол густ гас.
Вода се забележува и во меѓуѕвездените облаци (небули) во Млечниот Пат. Најверојато, водата постои во изобилие и во другите галаксии, бидејќи нејзините состојки, водородот и кислородот се меѓу најчестите елементи во универзумот. Небулите се згуснуваат во сончеви маглини и сончеви системи како нашиот.
Водната пареа е присутна во:
- атмосферата на Меркур: 3.4% и големо количество вода во егзосферата на Меркур;
- атмосферата на Венера: 0,002%;
- атмосферата на Земјата: ~0,40% низ целата атмосфера, најчесто 1%-4% на површината;
- атмосферата на Марс: 0,03%;
- атмосферата на Јупитер: 0,0004%;
- атмосферата на Сатурн – само мраз;
- Енкелад (месечина на планетата Сатурн): 91%;
- вонсончевите планети HD 189733 b и HD 209458 b.
Течната вода е присутна на:
- Земјата: 71% од површината;
- Месечината – најдени се мали количества вода (во 2008) во внатрешноста на вулканските бисери донесени од Месечината на Земјата од страна на екипажот на Аполо 15 во 1971 година; Во септември 2009 НАСА извести за наоѓањето молекули на вода од страна на минеаролошкиот пресликувач на месечината на НАСА кој се наоѓа на вселенско летало на индиската организација за испитување на вселената Шандрајан-1 (Chandrayaan-1).
Цврсти докази посочуваат дека течната вода е присутна под површината на сателитот на Сатурн, Енкелад, и на сателитот на Јупитер, Европа, каде можеби постои како океан длабок 100 километри, кој ја покрива целата површина на сателитот, што е повеќе вода од сите океани на Земјата.
Воден мраз е присутен на:
- Земјата – најчесто како прекривки од мраз;
- поларните ледени покривки на Марс;
- Месечината;
- Титан;
- прстенита на Сатурн;
- Европа;
- Енкелад;
- Плутон и Харон;
- Комети и тела од изворите на комети (предмети од Кајперовиот Појас и Ортовиот Облак);
Водениот мраз можно е да постои и на Церера и Тетида. Водата и други лесно испарливи материи најверојатно се составен дел од внатрешната структута на Уран и Нептун.
Вода на местата погодни за живот
Постоењето на течна вода, и во помал обем во гасна и цврста агрегатна состојба на Земјата, е неопходна за опстанокот на животот. Земјата е сместена во зона од сончевиот Систем која е погодна за живеење. Ако беше малку поблиску или подалеку од Сонцето (околу 5% или околу 8 милиони километри), условите кои дозволуваат трите форми да бидат присутни во исто време не би постоеле.
Гравитацијата на Земјата ѝ дозволува да ја задржи атмосферата. Водното испарување и јаглерод диоксидот во атмосферата прават амортизер за темература (ефект на стаклена градина) кој помага да се одржи прилично стабилна површинска тепмература. Ако Земјата беше помала, со поретка атмосфера би дошло до температурни екстреми, со што би се спречило насобирањето на вода, освен на поларните ледени покривки (како на Марс).
Површинската температура на Земјата е релативно постојана низ геолошкото време и покрај различните нивоа на сончево зрачење (изложување на сонце), што покажува дека со Земјината температура управува динамичен процес преку комбинација на гасови и површинско или атмосферско алабедо. Ова е познато како хипотеза Геа.
Состојбата на водата на планета зависи од амбиентскиот притисок, кој е одреден од гравитацијата на таа планета. Ако планетата е доволно голема, водата на неа може да биде во цврста состојба, дури и на високи температури, поради високиот притисок предизвикан од гравитацијата.
Денес, постојат различни теории за настанокот на водата на Земјата.
Вода на Земјата

Хидрологијата е наука на движењето, дистрибуцијата и кавалитетот на водата на Земја. Науката за дистибуција на водата се нарекува хидрографија. Науката за дистрибуција и движењето на подземните води е хидрогеологија, за ледниците е глациологија, за внатрешните води се нарекува лимнологија и поделбата на океаните е наречена океанографија. Еколошките процеси со хидрологија се фокусот на екохидрологијата.
Збирната маса од вода најдена на, под и над поршината на планетата се нарекува хидросфера. Приближниот волумен на Земјината вода (целосната резерва на вода за светот) е 1.360.000.000 км3. Подземните води и свежата вода се корисни или потенцијално корисни за луѓето како водни ресурси.
Течната вода се наоѓа во водни тела како океани, мориња, езера, реки, потоци, канали, езерца или бари. Најголемиот дел од Земјината вода е морска вода. Водата е присутна и во атмосферата, во цврста, течна и гасовита состојба. Постои и како подземна вода во водоносните слоеви.
Водата е важна за многу геолошки процеси. Таа е сеприсутна во камењата, и притисокот на овие подземни води влијае врз начинот на раседување. Водата во Земјината кора го причинува топењето кое создава вулкани во зоните на субдукција. На Земјината површина водата е важна и за хемиските и за физичките елувијални процеси. Водата, но и мразот во помал но значаен дел, се одговорни и за преносот на седименти кој се одвива на површината на земјата. Таложењето на пренесените седименти формира голем број видови на седиментни карпи, кои ја сочинуваат геолошката евиденција на Земјината историја.

Воден циклус
Водениот циклус (научно познат како хидролошки циклус) се однесува на постојаната размена на вода во хидросферата, меѓу атмосферата, водата во почвата, површинската вода, подземните води и растенијата.
Водата, постојано се движи низ секој од овие региони во водениот циклус кој се состои од следиве процеси на пренос:
- Испарувањето од океаните и други водни тела во воздухот и транспирацијата од копнени растенија и животни во воздухот.
- Врнежи, од водни испарувања кои се кондензираат во воздухот и паѓаат на земјата или во океаните.
- Истечни води од копното кои најчесто се влеваат во морињата.

Повеќето водни испарувања над океаните се враќаат во океаните, но ветровите можат да ги однесат врз копното со иста брзина како истечните води во морето, со околу 36 Тт (тератони) годишно. Над копното, испарувањето и транспирацијата придонесуваат за уште 71 Тт годишно. Врнежите, со степен од 107 Тт годишно на копно, имаат неколку форми: дожд, снег и град, со појава на магла и роса. Кондензираната вода во воздухот може да ја прекрши сончевата светлина со што настануваат виножита.
Истечните води, најчесто се собираат врз водопади кои се влеваат во реки. Математичкиот модел кој се употребува да се симулира река или проток на вода и да се пресметаат параметрите за квалитет на водата се нарекува хидролошки модел за пренос. Дел од водата е пренасочена за наводнување во земјоделството. Реките и морињата нудат можности за патување и трговија. Преку ерозија, истечните води ја оформуваат околината создавајќи долини и делти кои даваат богата почва и рамно земјиште за основање центри за населување. До поплави доаѓа кога дел од земјиштето, најчесто под водното ниво, е покриено со вода. Се случува кога реките се излеваат од своето корито или при поплави од морињата. Сушата е подолг период, кој трае со месеци или години, при која во некој регион се забележува недостаток од резервите со вода. До ова доаѓа кога некој регион постојано има потпросечни врнежи.
Складирање на свежата вода

Некои истечни води се заробени за одреден период на време, како што е на пример водата во езерата. На голема надморска височина, снегот се собира на ледените капи, снежните бали и ледниците. Водата се впива во земјата и се движи до водоносните слоеви. Овие подземни води подоцна повторно избиваат на површината во изворита или поспектакуларно како топли извори и гејзери. Подземните води можат да се извлечат и вештачки со бунари. Складирањето на водата е важно, бидејќи чистата, свежа вода е неопходна за човекот и другите копнени форми на живот. Во многу делови на светот таа е во недостаток.
Морска вода
Морката вода содржи околу 3,5% сол плус помали количини на други материи. Физичките својства на морската вода се разликуваат од тие на свежата вода по неколку работи. Морската вода смрзнува на пониски температури (околу -1,9 °C) и нејзината густина се зголемува со намалувањето на температурата до точката на замрзнување, наместо да достигне најголема густина на температури на замрзнување. Соленоста на водата во поголемите мориња се разликува од околу 0,7% во Балтичкото Море до 4,0% во Црвеното Море.
Плими
Плимите се кружно паѓање и кревање на Земјините води, предизвикани од приливните сили на Месечината и Сонцето, кои влијаат на океаните. Плимата предизвикува промени во длабочината на морските и речните водни тела и произведува осцилирачки струи познати како плимни струи. Плимата која се менува на некоја локација е резултат на замената на местата на Месечината и Сонцето во однос на Земјата, заедно со влијанието на ротацијата на Земјата и локалната батиметрија. Делот од морскиот брег кој се наоѓа под вода за време на висока плима и е изложен за време на ниска плима, е важен еколошки производ на океанските плими.
Влијание врз животот

Од биолошка гледна точка, водата има многу различни особености кои се важни за размножувањето на видовите, што ја разликува од другите материи. Тоа е затоа што им овозможува на органските соединенија да реагираат на начин кој би им дозволил размножување. Сите познати форми на живот зависат од водата. Водата е важна и како растворувач во кој големиот број раствори на телото се раствораат и како неопходен дел од многуте метаболички процеси во телото. Метаболизмот е збир од анаболизмот и катаболизмот. Во анаболизмот, водата се отстранува од молекулите (преку енергија за која се потребни хемиски реакции на ензимите) со цел да се добијат поголеми молекули (на пр. скробови, триглицериди и белковини за складирање на гориво и иформации). Во катаболизмот, водата се употребува да ги разруши врските со цел да се создадат помали молекули (на пр. гликоза, масни киселини и аминокиселини за гориво за енергија и други намени). Поради тоа, водата е незаменлива и главна за овие метаболички процеси. Оттаму, без вода, овие метаболички процеси би престанале да постојат, што би нѐ оставило да размислуваме кои процеси би ги замениле, како на пример апсорпција на гас, собирање на прашина и сл.
Водата е главна за процесот на фотосинтеза и за дишењето. Фотосинтетичките клетки ја користат енергијата од сонцето за да ги разделат водородот и кислородот од водата. Водородот е комбиниран со CO2 (апсорбиран од воздух или вода) да создаде гликоза и да испушти кислород. Сите живи клетки користат такви горива и го оксидираат водородот и јаглеродот за да ја искористат сончевата енергија и да ја преобразат водата и CO2 (клеточно дишење).
Исто така, водата е важна и за киселинско базната неутралност и работата на ензимите. Киселината се состои од водороден јон (H+, дел) дарител, кој може да биде неутрализиран од страна на базата, која претставува делумен акцептор како јон на хидроксид (OH−), со цел да се создаде вода. Водата се смета за неутрална, со pH вредност (негативниот дел од концентрацијата на водородниот јон) од 7. Киселините имаат pH вредност помала од 7, додека базите имаат вредност поголема од 7.
Стомачната киселина (HCl) е корисна за варењето на храната. Но нејзиното корозивно дејство врз хранопроводот за време на одливот на храна може привремено да се неутрализира со внесување на основа како алуминиум хидроксид за да се создадат неутрални молекули на вода и солта алуминиум хлорид. Човековата биохемија која вклучува ензими, најчесто најоптимално работи на билошки неутрална pH вредност од околу 7,4. На пример, клетка од бактеријата Escherichia coli содржи 70% вода, човековото тело 60-79% вода, растително тело содржи и до 90% вода и телото на возрасна медуза содржи 94-98% вода.
Водни форми на живот

Водите на Земјата се полни со живот. Најраните форми на живот се појавиле во вода. Речиси сите риби живеат исклучиво во вода, а постојат и многу морски видови на цицачи, како делфините и китовите кои исто така живеат во вода. Некои видови на животни, како водоземците, поминуваат дел од нивниот живот во вода и дел на копно. Растенијата како морската трева и алгите растат во вода и се основа на некои подводни екосистеми. Планктоните се главната основа на океанскиот синџир на исхрана.
Водните цицачи мора да добијат кислород за да преживеат, а тоа го прават на неколку различни начини. Рибите имаат жабри наместо бели дробови, иако некои видови риби, како дводишалката, ги имаат и двете. Морските цицачи, како делфините, китовите, видрите и фоките, мораат повремено да испловат на површината за да вдишат воздух. Помалите форми на живот се способни да впиваат кислород преку кожата.
Влијание врз човековата цивилизација
Историски гледано, цивилизацијата најмногу напреднала околу реките и големите водни патишта. Месопотамија, која се смета за лулка на цивилизацијата била сместена меѓу теченијата на плодните реки Тигар и Еуфрат. Животот на населението во Древен Египет било целосно зависно од течението на реката Нил. Големите пристанишни градови како Ротердам, Лондон, Монтреал, Париз, Њујорк, Буенос Ариес, Шангај, Токио, Чикаго и Хонгконг, делумно го должат својот развој и проширување поради лесната пристапливост преку вода и зголемувањето на трговијата, што е директен резултат на тоа. Островите со безбедни пристаништа, како Сингапур напреднале поради истата причина. Во делови од Северна Африка и Блискиот Исток, каде водата е поретка, пристап до чиста вода за пиење бил и е главен фактор за човековиот развој.
Здравје и загадување

Водата погодна за човекова употреба се нарекува вода за пиење или вода погодна за пиење. Водата, која не е за пиење може да се направи погодна за пиење со филтрација или дестилација (да се загрее додека нѐ испари и после пареата да се собере без нечистотиите кои ги остава) или на други начини (хемиска или топлинска преработка која ги убива бактериите). Понекогаш, изразот „безбедна вода“ важи за водата погодна за пиење од понизок квалитет (на пр. успешно се користи за исхрана кај луѓе кои имаат слаб пристап до процеси за прочистување на вода и прави повеќе добро отколку штета). Водата, која не е погодна за пиење, но не е штетна за луѓето кога се употребува за пливање или капење се нарекува со повеќе имиња, покрај вода погодна за пиење и понекогаш се нарекува „безбедна вода“ или „вода безбедна за капење“. Хлорот, кој ги иритира кожата и мукозната мембрана, се користи да ја направи водата безбедна за капење или пиење. Неговата употреба е строго техничка и најчесто се контролира со владини прописи (најчесто еден дел од милион од водата за пиење и 1-2 дела од милион хлор кој сè уште не реагирал со нечистотиите за вода за капење).

Овој природен ресурс станува сè поредок на одредени места и неговата достапност е голем социјален и економски проблем. Моментално, околу 1 милијарда луѓе ширум светот редовно пијат загадена вода. На 29. средба на Г8 средбата во 2003 година, повеќето земји ја прифатија целта до 2015 да се преполови бројот на луѓе ширум светот кои немаат пристап до безбедна вода за пиење и санитација. Иако ова е цел која тешко може да се достигне, веројатно е дека повеќе од половина милијарда луѓе ќе останат без пристап до безбедна вода за пиење и повеќе од милијарда луѓе без пристап до соодведна санитација. Слабиот квалитет на водата и лошата санитација се смртоносни. Околу 5 милиони смртни случаи се последица поради загадена вода за пиење. Светската здравстена организација проценува дека безбедната вода би можела да спречи 1,4 смртни случаи на деца од дијареа секоја година. Но, водата не е исцрплив ресурс, туку се рециклилира како вода погодна за пиење преку дождови во многу поголеми количества од човековата потрошувачка. Поради тоа, прилично малото количество на водни резерви на Земјата (околу 1% од нашата вода за пиење, која се надополнува преку водоносни слоеви секои 1 до 10 години) е необновлив ресурс. Поретка е дистрибуцијата на вода погодна за пиење и наводнување отколку количеството кое постои на Земјата. Земјите кои немаат вода го користат увозот на добра како првичен начин за увоз на вода, бидејќи производствениот процес користи околу 10 до 100 пати вода од масата на производите.
Во земјите во развој, 90% од отпадите води сè уште непреработени се влеваат во локалните реки и потоци. Околу 50 држави, со одприлика третина од светското население, исто така страдаат од среден или висок воден притисок и 17 од нив годишно извлекуваат повеќе вода од колку што се надополнува со природниот воден циклус. Притисокот дејствува не само врз телата со свежа вода како реки и езера, туку и го намалува квалитетот на подземните водни ресурси.
Човекова употреба
Земјоделство
Најважната употреба на водата во земјоделството е за наводнување, што е клучен фактор за производството на храна. Наводнувањето зазема до 90% од повлечената вода во некои земји во развој и значајни размери во земји со поголем економски развој.
Водата како научен стандард
На 7 април 1795, во Франција било одлучено грамот да биде еднаков на „апсолутната маса на волумен чиста вода, еднаков на куб од стотинка од метар и на температурата на мраз кој се топи“. За практични цели, потребен бил метален стандард за пример, илијада пати поголем. Поради тоа било потребно точно да се одреди масата на еден литар вода. И покрај фактот дека дефиницијата за грамот ја специфицирала водата на 0 °C, температура која лесно може да се добие одново, научниците одлучиле да го редефинираат стандардот и да ги изведат нивните мерки на температурата кога водата е најгуста, што тогаш била 4 °C.
Температурната скала на Келвин од меѓународниот систем се основа на трите точки на водата, дефинирани на точно 273,16 К или 0,01 °C. Скалата е попрецизна од Целзиусовата температурна скала, што првично била дефинирана според точката на вриење (100 °C) и точката на топење (0 °C) на водата.
Природната вода главно се состои од изотопите на водород-1 и кислород-16, но постои и мало количество на потешки изотопи како водород-2 (девтериум). Количеството на девтериум оксиди или тешка вода е многу мало, но сепак влијае врз својствата на водата. Водата од реките и езерата содржи помалку девтериум од морската вода. Поради тоа, стандардната вода е дефинирана во спецификацијата на Виенскиот стандард за океански води.
Вода за пиење


Во зависност од големината на човечкото тело, истото се состои од 55% до 78% од вода. За да функционира правилно, на телото му се потребни меѓу еден и седум литри вода дневно за да се избегне дехидратација. Точното количество зависи од степенот на активност, температурата, влажноста, но и други фактори. Поголемиот дел од ова се внесува преку храна или пијалаци, наместо пиење чиста вода. Не е јасно колку вода е потребно да се внесе од страна на здрави луѓе, иако повеќето се согласуваат дека 6 до 7 чаши вода (отприлика 2 литри) дневно, најмалку е потребо за да се одржи соодветна хидратација. Медицинската литература претпочита помало внесување, обично 1 литар вода за просечен маж, исклучувајќи ги дополнитлните потреби кои се резултат на губитокот на течности заради вежбање или топло време. За тие што имаат здрави бубрези, тешко е да се исие премногу вода, но опасно е да не се испие доволно. Луѓето можат да испијат повеќе вода од потребното за време на вежбање што ги доведува до ризик од труење од вода (хиперхидратација), што може да биде смртоносна. Фактот дека еден човек треба да испие 8 чаши вода дневно не може да се препише на ниту еден научен извор. Постојат и други митови, како на пример влијанието на водата за спречување на дебелеењето.
Водата од телото се лачи на повеќе начини: преку урина и фецес, преку потење и преку издишување на водни испарувања во здивот. Со физичко исцрпување и изложување на топлина, губитокот на вода ќе се зголеми и дневните потреби за вода исто така ќе се зголемат. На луѓето им е потребна вода која не содржи премногу нечистотии. Чести нечистотии се металните соли и оксидите (вклучувајќи бакар, железо, калциум и олово) и/или штетни бактерии како на пример бактеријата Vibrio. Некои раствори се прифатливи и дури пожелни за подобрување на вкусот и за добивање на неопходните електролити. Најголемиот извор на вода погодна за пиење е Бајкалското Езеро, кое содржи многу малку сол и калциум и затоа ѝ се смета за многу чисто.
Хигиена
Способноста на водата да прави раствори и емулзии се користи за миење. Голем број индустриски процеси зависат од реакциите добиени со хемикалии растворени во вода, како на пример лебдењето на цврсти честички во водена кашеста маса или употребата на вода за да се растворат и извлечат материите.
Хемиска употреба
Водата има широка употреба во хемиските реакции како растворувач или реактант и поретко како раствор или катализатор. Во неорганските реакции, водата најчесто е растворувач, кој разградува многу јонски соединенија. Во органските реакции, не се користи како растворувач во реакцијата бидејќи не ги разградува добро реактантите и е амфотерна (киселинска и базна) и нуклеофилна. Но и покрај тоа, овие својства се пожелни. Исто така, забележано е и забрзување на Диелс-Алдеровите реакции. Суперкритичната вода, неодамна стана тема на истражување. Суперкритичната вода заситена со кислород успешно ги согорува загадувачите.
Течност која пренесува топлина
Водата и пареата се користат како течности во различни системи за пренос на топлина, поради нивната достапност и високиот топлински капацитет, и за ладење и за затоплување. Ладната вода може да биде и природно достапна од езерата или од морињата. Згуснатата пареа е прилично ефикасна течност за загревање поради големата топлина на испарувањето. Недостаток е тоа што водата и пареата се малку корозивни. Скоро во сите централи за елекртична енергија, водата која се користи за ладење испарува и ги придвижува парните турбини кои ги напојуваат генераторите.
Во индустријата за производство на јадрена енергија, водата може да се користи и како модератор на неутрони. Во реактори на вода под притисок, водата се користи и за ладење и како модератор. Ова е пасивна сигурносна мерка, бидејќи отстранувањето на вода од реакторот ја намалува јадрената реакција.
Гаснење на пожари

Водата се користи за гаснење на диви пожари. Таа има висока температура на испарување и е прилично инертна, што ја прави добра како течност за гаснење на пожари. Испарувањето на водата ја носи топлината подалеку од пожарот. Но, водата не може да се употеби за гаснење на пожари од електрична опрема, бидејќи нечистата вода е спроводлива, или за пожари од масла или органски раствори, бидејќи тие лебдат над водата и експлозивното вриење на водата ја шири запалената течност. Употребата на водата за гаснење на пожари треба да ја земе предвид и опасноста од парна експлозија, до која може да дојде кога водата се користи за гаснење на многу жешки пожари во затворени простории и водородна експлозија, кога материите реагираат со вода, како на пример одредени метали или топол графит, ја разградуваат водата создавајќи водороден гас.
Силата на таква експлозија е видена во Чернобилската катастрофа, иако водата за која станува збор не беше од гаснење на пожари туку од системот за ладење на реакторот. До парна експлозија дојде кога претераното затоплување на јадрото предизвика водата да се претвори во пареа. До водородна експлозија може да се дојде и како резултат на реакцијата помеѓу пареата и жешкиот циркониум.
Рекреација
Луѓето ја користат водата за многу рекреациони цели, како и за вежбање и за спорт. Денес, многу познати водени спортови се пливање, скијање на вода, веслање, сурфање и нуркање. Некои спортови како хокеј и лизгање се одвиваат на мраз. Езерските брегови, плажите и водните паркови се популарни места за одмор и рекреација. Многу луѓе звукот и изгледот на водата што тече го сметаат за смирувачки. Некои чуваат риби и други видови на водни суштества во аквариуми или езерца за украс, забава или за друштво. Луѓето ја користат водата и за спортови на снег, како на пр. скијање, санкање, моторно санкање или за скијање на даска за кои водта треба да е замрзната. Водата може да се искористи и за борбени игри, како што се гаѓање со снежни топки, пушки на вода и балони полни со вода.
Водна индустрија

Водната индустрија обезбедува услуги за вода за пиење и отпадни води (вклучувајќи ја и преработката на канализациските води) за домаќинствата и индустријата. Средствата кои се користат за снабдување со вода вклучуваат бунарни цистерни за собирање на дождовна вода, мрежи за снабдувње со вода, постојки за прочистување на вода, резевоари за вода, кули за вода, цевки за вода (аквадукти). Генераторите за атмосферска вода се во фаза на развивање.
Водата за пиење често се собира од извори, се црпи од вештачки јами (бунари) или се пумпа од езера и реки. Изградбата на повеќе бунари на соодветни места е можен начин да се добие повеќе вода, ако се претпостави дека водоносните слоеви можат да обезбедат доволен доток. Друг извор на вода е собирањето на дождовна вода. За да биде погодна за човечка употреба, можно е водата да треба да биде прочистена.

Дистрибуцијата на водата за пиење се прави преку општински водни системи, достава со танкери или како флаширана вода. Владите во многу земји имаат програми за дистрибуција на вода до сиромашните, без наплата. Други сметаат дека пазарниот механизам и слободната трговија се најдобриот начин да се управува со овој ресурс и да се финансира дупчењето на бунари и изградбата на брани и рзервоари. Друг начин за намалување на потрошувачката е со употреба на водата за пиење само за човечка употреба. Во некои градови како Хонгконг, морската вода има широка употреба, за пуштање вода во тоалетите низ градот со цел да се зачуваат ресурсите на свежа вода.
Загадувањето на водата е најголемата злоупотреба на водата, до тој степен што загадувачите ја ограничуваат употребата на вода за други потреби, при што доаѓа до непотребно трошење на ресурсите, без разлика на придобивките на тој што загадува. Како и другите видови на загадување, ова не влегува во стандардното пресметување на пазарните трошоци, бидејќи се сметаат за надворешни одлики за кои пазарот не може да води сметка. Поради ова други ја плаќаат цената на загадувањето на водата, додека добивките од приватните фирми не се распределуваат до месното население кое е жртва на ова загадување.
Фармацевтските производи кои се користат од страна на луѓето често завршуваат во водните патишта и можат да имаат штетно влијание врз водниот живот ако се биоакумулираат и ако не се биолошки разградливи.
Постојките за отпадна вода се одводни канали и фабрики за преработка на отпадна вода. Друг начин да се отстрани загадувањето од површинските истечни води се биоканалите.
Индустриска употреба
Водата се користи за добивање енергија. Хидроелектричната енергија е енергија добиена со силата на водата. Таа се добива од вода која придвижува турбина на вода поврзана со генератор. Хидроелектричната енергија е евтин извор на енергија, кој не загадува и е обновлив. Всушност, енергијата се добива од сонцето, под чие дејство водата испарува и кондезира како дожд на големи височини од каде се враќа назад.
Водата под притисок се користи за водни детонации и сечачи со воден млаз. Исто така, за прецизно сечење се употребуваат и пушки кои работат на висок воден притисок. Тие работат добро, прилично се безбедни и не ѝ штетат на околината. Исто така, се употребува и за ладенње на машинеријата за да се спречи прегрејување на сечилата од пили.
Водата, се користи и во многу идустриски процеси и машини, како на пример парната турбина и разладувачот како додаток на нејзината употреба како растворувач. Испуштањето на непреработена вода од индустриска употреба се смета за загадување. За загадување се сметаат и испуштени раствори (хемиско загадување) и испуштена вода за ладење (термално загадување). На индустријата и е потребна чиста вода за многу употреби и се користи во различни техники за прочистување и во набавката на вода и во испуштањето на истата.
Преработка на храна

Водата има важна улога на полето на преработката на храна. За прехранбен научник важно е да ја разбере улогата која ја има водата во преработката на храна за да обезбеди производство на здрави производи. Растворите како солите и шеќерите кои се наоѓаат во водата и влијаат врз нејзините физички својства. Точките на вриење и замрзнување, исто така се под влијание на растворите во водата. Еден мол сахароза (шеќер) на килограм вода ја крева точката на вриење за 0,051 °C, и еден мол сол на килограм ја крева точката на вриење за 1,02 °C. Слично, зголемениот број на растворени честички ја намалува точката на замрзнување на водата.
Тврдоста на водата е исто така важен фактор во преработката на храна. Тврдоста на водата може да има големо влијание врз квалитетот на производот и врз санитацијата. Таа се класифицира врз основа на количината на калциум карбонат кој може да се отстрани од водата. Тврдоста се мери во гранули. Во 0,064 грама калциум карбонат е содржана гранула. Водата се класифицира како мека ако содржи 1 до 4 гранули, средна ако содржи 5 до 10 гранули и тврда ако содржи 11 до 20 гранули. Тврдоста на водата може да се промени или да се преработи со помош на систем за измена на јони. Тврдоста на водата влијае и врз pH рамнотежата која има важен удел во преработката на храна. Така на пример, тврдата вода го спречува успешното производство на безбојни пијалаци. Тврдоста на водата влијае и врз јавната хигиена. Колку е поголема тврдоста на водата толку е помала нејзината делотворност како средство за дезинфекција.
Вриењето, испарувањето и тлеењето се популарни методи за кои е потребно храната да се покрие со вода или со пареа.
Политика за вода

Политиката за вода е политика која се занимава со искористувањето на водата и водните ресурси. Поради оваа причина, водата е стратешки ресурс во светот и важен елемент во многу политички спорови. Таа влијае врз здравјето и ја оштетува биоразновидноста. Бројот на лица со пристап до здрава вода во земјите во развој се зголемил од 30% во 1970 година на 71% во 1990 година и 84% во 2004. Овој тренд се очекува да продолжи и во иднина. Со цел да се преполови бројот на лица без пристап до здрава вода до 2015 година, беше одлучено проблемот да биде дел од Милениумските цели за развој. Се проценува дека оваа цел ќе биде остварена.
Од 1990 година, 1,6 милијарда луѓе добија пристап до безбеден извор на вода за пиење. Во извештај на Обдинетите нации од 2006 година стои дека „има доволно вода за сите„, но дека пристапот до неа е попречен заради погрешно управување и корупција.
Светскиот извештај за развој на вода на Обединетите нации од 2003 година за проценка на водата посочува дека во наредните 20 години, количеството вода достапна за сите ќе се намали за 30%. Моментално 40% од населението на Земјата немаат доволно свежа вода за минимална хигиена. Повеќе од 2,2 милиони луѓе во 2000 умреле од болести преносливи преку вода (поврзано со потрошувачката на загадена вода) или од суша. Во 2004 година, британската добротворна организација WaterAid соопшти дека на секои 15 секунди по едно дете умира од болести поврзани со вода кои лесно може да се спречат. Најчесто до ова доаѓа поради недостаток на систем за отстранување на канализациски отпад.
Во светот постојат голем број на организации, кои се ангажираат во заштитата на водата, како што се: Меѓународното зружение за вода, WaterAid, Water 1st и др. Од страна на Обединетите нации се донесени и неколку конвенции кои директно се однесуваат на водата.
Светскиот ден на водата е 22 март.
Водата како тема во уметноста и културата
Водата како тема во религијата
Водата во повеќето религии се смета за прочистувач. Во големите религии како христијанството, хиндуизмот, исламот, шинтоизмот, таоизмот и јудаизмот постојат ритуали со миење со вода. Потопувањето (прскање со света вода или крштевање) е главен религиозен обред во христијанството, а исто така е дел и од обредите во други религии, вклучувајќи го јудаизмот (миква) и сикизмот (Амрит Санскар). Исто така, во многу религии вклучувајќи ги и јудаизмот и исламот се применува и ритуално капење на мртвите во чиста вода. Во исламот, петте дневни молитви најчесто се исповедатат по миење на одредени делови од телото со чиста вода. Во шинтоизмот, водата се употребува во скоро сите ритуали за прочистување на луѓе или места. Водата се споменува во Библијата 442 пати. Впечатливо е тоа што во неа пишува:
| „ | „...земјата е создадена од вода и со вода.“ | “ |
Во Куранот рајот често се опишува со зборовите:
| „ | „...живите суштества се направени од вода.“ | “ |
Водата како тема во филозофијата
Античкиот филозоф Емпедокле сметал дека водата е еден од четирите класични елементи заедно со огнот, земјата и воздухот и се сметала за „илем“ или материја на универзумот. Водата се сметала за ладна и влажна. Во теоријата за четирите телесни течности кои го одредуваат расположението, водата се поврзувала со секретот. Класичниот елемент вода исто така е и еден од петте елементи во традиционалната кинеска филозофија, заедно со земјата, огнот, дрвото и металот. Во некои делови од азиската традиционална и популарна филозофија водата е земена како пример. Во преводотот на Тао Те Чинг од страна на Џејмс Лег од 1891 година се вели:
„Највиското совршенство е како тоа на водата. Совршенството на водата се појавува како доброто за сите нешта и во нејзината окупација без стремеж (туку напротив), на ниското место кое сите луѓе го презираат. Оттаму нејзиниот пат е сличен како на тој на Тао„ и “На светот не постои ништо помеко и послабо од водата, но за напаѓање на нешта кои се силни и цврсти не постои ништо што би ја заменило-бидејќи не постои ништо толку делотворно со што би можела да се замени.“
Водата како тема во книжевноста
Во литературата, водата се користи како симбол за прочистување. Пример за ова е важноста на реката во романот Додека лежев умирајќи од Вилијам Фокнер и давењето на Офелија во Хамлет.
Шерлок Холмс, лик измислен од Артур Конан Дојл, вели:
| „ | „Од капка вода, логичарот може да ја одреди веројатноста дали е од Атлантскиот Океан или од Нијагара, без да ја види или чуе едната или другата.“ | “ |
Водата се јавува како тема во дела од бројни книжевни дела, како:
- „Воздухот на водата“ - поетска збирка на францускиот писател Андре Бретон од 1934 година.
- „Смрт од вода“ - песна од поемата на Томас Стернс Елиот, „Пуста земја“ од 1922 година.
- „Песна за лебот и за водата“ — песна на македонскиот писател Славко Јаневски од 1967 година.
- „Земја, оган и вода“ - кус расказ на ирскиот писател Вилијам Батлер Јејтс од 1902 година.
- „Повикување на водата“ (италијански: Il richiamo dell'acqua) - расказ на италијанскиот писател Итало Калвино.
- „Дрвостојот на водата“ - песна на полскиот поет Тимотеуш Карпович.
- „Жива вода“ - роман на бразилската писателка Кларис Лиспектор од 1973 година.
- „Балада за морската вода“ (шпански: La balada del aaqua dela mar) - песна на шпанскиот поет Федерико Гарсија Лорка од 1919 година.
- „Кругови на водата“ - песна на рускиот поет Леонид Мартинов од 1962 година.
- „Низводно“ - песна на српскиот поет Бранко Миљковиќ.
- „Песни за водата“ (српски: Pesme o vodi) - песна на српскиот поет Миодраг Павловиќ.
- „Преминување преку водата“ (англиски: Crossing the Water) - поетска збирка на американската писателка Силвија Плат од 1971 година.
- „Вода“ — песна на македонскиот писател Бошко Смаќоски.
- „Вода“ - кус расказ на македонската писателка Анета Попова.
- „Кап! И пак.“ — краток расказ на македонскиот писател Бранко Прља.
- „Големата вода“ - роман на македонскиот писател Живко Чинго од 1971 година.
- „Вода“ - песна на полската поетеса Вислава Шимборска.
Водата како тема во музиката
- „Водата во морето“ (српски: Voda u moru) - песна на српската рок-група Електрични оргазам од 1981 година.
- „Тажна вода“ (англиски: Sad Waters) - песна на рок-групата Nick Cave And The Bad Seeds од 1986 година.
- „Не ти недостига твојата вода“ (англиски: You Don't Miss Your Water) - песна на американскиот соул-пејач Отис Рединг (Otis Redding) од 1965 година.
- „Нечиста вода“ (англиски: Dirty Water) - песна на американската рок-група The Standells.
- „Одење по водата“ (англиски: Walk On The Water) - песна на американската рок-група Creedence Clearwater Revival од 1968 година.
- „Чад на водата“ (англиски: Smoke on the Water ) - песна на британската хард рок-група Дип Парпл (Deep Purple)“ од 1972 година.
- „Да ја направиме водата црна“ (англиски: Let's Make The Water Turn Black) — песна на американскиот рок-музичар Френк Запа (Frank Zappa)
- „Под вода“ (српски: Pod vodom) - песна на македонската рок-група Леб и сол од 1978 година.
- „Вода“ (англиски: Water) - песна на британската рок-музичарка П Ј Харви (P J Harvey) од 1992 година.
- „Виски и вода“ (англиски: Whiskey and Water) - песна на рок-групата Tindersticks од 1993 година.
- „Немирни води“ (англиски: Restless Waters) - песна на американската рок-група Tortoise од 1996 година.
- „Шеќерна вода“ (англиски: Sugar Water) - песна на американското дуо Cibo Matto од 1996 година.
- „Бистра вода“ - песна на македонската рок-група Леб и сол.
- „Преку водата“ (унгарски: Túl a vízen) – хорска песна на унгарскиот композитор Тамаш Калман.
- „Нема вода за пиење“ (германски: Kein Trink Wasser) — песна на британското техно-дуо Орбитал (Orbital) од 1994 година.
- „На водите вавилонски“ (англиски: By the Waters of Babylon) – песна на композиторот Едвин Фисингер.
- „Голтка ладна вода“ (англиски: Cool Drink Of Water) — песна на американскиот блуз-музичар Томи Џонсон (Tommy Johnson).
- „Да сум бистра вода“ - македонска народна песна.
- „Дотекла вода студена“ - македонска народна песна.
Водата како тема во филмот
- „Големата вода“ - филм на македонскиот режисер Иво Трајков од 2004 година.
Наводи
Користена литература
| Повеќе за Вода на збратимените проекти на Википедија | |
 | Дефиниции и преводи на Викиречник ? |
 | Податотеки на Ризницата ? |
 | Образовни ресурси на Викиуниверзитет ? |
 | Новинарски известувања на Викивести ? |
 | Мисли на Викицитат ? |
 | Изворни текстови на Викиизвор ? |
 | Прирачници на Викикниги ? |
| Информации за патување во Википатување ? ? | |
- OA Jones, JN Lester and N Voulvoulis, Pharmaceuticals: a threat to drinking water? TRENDS in Biotechnology 23(4): 163, 2005
- Franks, F (Ed), Water, A comprehensive treatise, Plenum Press, New York, 1972–1982
- PH Gleick and associates, The World's Water: The Biennial Report on Freshwater Resources. Island Press, Washington, D.C. (published every two years, beginning in 1998.)
- Marks, William E., The Holy Order of Water: Healing Earth's Waters and Ourselves. Bell Pond Books ( a div. of Steiner Books), Great Barrington, MA, ноември 2001, ISBN 0-88010-483-X
- Debenedetti, P. G., and Stanley, H. E.; "Supercooled and Glassy Water", Physics Today 56 (6), p. 40–46 (2003). Downloadable PDF (1.9 MB)
- Anderson (1991). Water Rights: Scarce Resource Allocation, Bureaucracy, and the Environment. ISBN 0884103900.
- Maude Barlow, Tony Clarke (2003). Blue Gold: The Fight to Stop the Corporate Theft of the World's Water. ISBN 1565848136.
- Gleick, Peter H. The World's Water: The Biennial Report on Freshwater Resources. Washington: Island Press. ISBN 1559637927. (10 ноември 2006)| ISBN 978-1-59726-105-0]
- Miriam R. Lowi (1995). Water and Power: The Politics of a Scarce Resource in the Jordan River Basin. ISBN 0521431646. (Cambridge Middle East Library)
- William E. Marks (2001). The Holy Order of Water: Healing Earths Waters and Ourselves.
- Postel, Sandra (1997, second edition). Last Oasis: Facing Water Scarcity. New York: Norton Press. ISBN 0393034283.
- Reisner, Marc (1993). Cadillac Desert: The American West and Its Disappearing Water. ISBN 0670199273.
- Vandana Shiva (2002). Water Wars: Privatization, Pollution, and Profit. London: Pluto Press [u.a.] ISBN 0-7453-1837-1.
- Anita Roddick; и др. (2004). Troubled Water: Saints, Sinners, Truth And Lies About The Global Water Crisis. ISBN 095439593X.
- Marq de Villiers (2003, revised edition). Water: The Fate of Our Most Precious Resource. ISBN 0618030093.
- Diane Raines Ward (2002). Water Wars: Drought, Flood, Folly and the Politics of Thirst. ISBN 1573222291.
- Worster, Donald (1992). Rivers of Empire: Water, Aridity, and the Growth of the American West. ISBN 039451680X.
Надворешни врски
 | Статијата „Вода“ е избрана статија. Ве повикуваме и Вас да напишете и предложите избрана статија (останати избрани статии). |
This article uses material from the Wikipedia Македонски article Вода, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Содржината е достапна под CC BY-SA 4.0 освен ако не е поинаку наведено. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Македонски (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.

