ರಸಾಯನಶಾಸ್ತ್ರ ದ್ರವ್ಯರಾಶಿಯ ಸ್ವಭಾವ, ಗುಣಗಳು ಮತ್ತು ಅದರ ರಚನೆ ಹಾಗೂ ಅದು ಹೇಗೆ ಬದಲಾಗುತ್ತದೆ ಎಂದು ಅಧ್ಯಯನ ಮಾಡುತ್ತದೆ.
ಇದು ನೈಸರ್ಗಿಕ ವಿಜ್ಞಾನ ಮತ್ತು ಭೌತಿಕ ವಿಜ್ಞಾನಗಳಲ್ಲಿ ಒಂದು. ಮಾನವನು ನಾಗರೀಕತೆಯ ಆರಂಭದಲ್ಲಿಯೇ ಪ್ರಕೃತಿಯಲ್ಲಿನ ಹಲವು ಬದಲಾವಣೆಗಳನ್ನು ಗಮನಿಸಿ ಬಳಸತೊಡಗಿದ. ಅವು ಕುಂಬಾರಿಕೆ, ಲೋಹಶಾಸ್ತ್ರಗಳಂತಹ ಪ್ರಮುಖ ಸಂಪ್ರದಾಯಗಳನ್ನು ಒಳಗೊಂಡಿದ್ದವು. ಆರಂಭದಲ್ಲಿ ರಸವಿದ್ಯೆಗಳಂತಹ ಸಂಪ್ರದಾಯಗಳಿಂದಲೇ ಅದು ಭಿನ್ನ ಕವಲಾಗಿ ರೂಪಗೊಂಡಿತು. ನಂತರದಲ್ಲಿ ಆಧುನಿಕ ವಿಜ್ಞಾನದ ಇತರ ಶಾಖೆಗಳಂತೆ ರಸಾಯನಶಾಸ್ತ್ರವೂ ಪ್ರಾಚೀನರಿಂದ ವಿಶೇಷವಾಗಿ ಗ್ರೀಕ್ರಿಂದ ಬಂದ ಗ್ರಹಿಕೆಗಳನ್ನು ಪ್ರಶ್ನಿಸಿ, ಅಳತೆ, ಪ್ರಯೋಗಗಳನ್ನು ಆಧರಿಸಿ ಅಭಿವೃದ್ಧಿ ಹೊಂದಿತು.

ವಸ್ತುಗಳ ತಮ್ಮೊಡನೆ ಅಥವಾ ಊರ್ಜದೊಂದಿಗೆ ಸಂವಹನೆಗಳ ಸಂಶೋಧನೆಯ ವಿಜ್ಞಾನಕ್ಕೆ ರಸಾಯನಶಾಸ್ತ್ರವೆಂದು ಹೆಸರು. ರಸಾಯನ ಶಾಸ್ತ್ರ ಅಥವಾ ರಸಾಯನ ವಿಜ್ಞಾನವು ಮತ್ತೆ ಕೆಲವು ಶಾಖೆಗಳನ್ನು ಹೊಂದಿದೆ, ಸಾವಯವ ರಸಾಯನಶಾಸ್ತ್ರ (ಕಾರ್ಬನಿಕ್ ರಸಾಯನ ವಿಜ್ಞಾನ) (Organic Chemistry), ನಿರಯವ ರಸಾಯನಶಾಸ್ತ್ರ (ಅಕಾರ್ಬನಿಕ್ ರಸಾಯನ ವಿಜ್ಞಾನ) (Inorganic Chemistry), ಭೌತ ರಸಾಯನ ವಿಜ್ಞಾನ (Physical Chemistry), ವಿಶ್ಲೇಷಕ ರಸಾಯನ ವಿಜ್ಞಾನ (Analytical Chemistry) ಇತ್ಯಾದಿ. ರಸಾಯನಶಾಸ್ತ್ರವು ಮುಖ್ಯವಾಗಿ ಪರಮಾಣುಗಳು ಮತ್ತು ಅಣುಗಳು ಮತ್ತು ಅವುಗಳ ಪರಸ್ಪರ ಕ್ರಿಯೆಗಳು ಹಾಗೂ ಪರಿವರ್ತನೆಗಳಿಗೆ ಸಂಬಂಧಿಸಿದೆ, ಉದಾಹರಣೆಗೆ, ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳನ್ನು ಸೃಷ್ಟಿಸಲು ಪರಮಾಣುಗಳ ನಡುವೆ ರೂಪಿಸಲ್ಪಟ್ಟ ರಾಸಾಯನಿಕ ಬಂಧಗಳ ಗುಣಲಕ್ಷಣಗಳು. ರಸಾಯನಶಾಸ್ತ್ರ ವಿಭಾಗದಲ್ಲಿ ಸ್ನಾತ್ತಕೋತ್ತರ ಪಧವಿಗಳು ಲಭ್ಯವಿದೆ.ಈ ವಿಷಯದಲ್ಲಿ ಅನೇಕ ಸಂಶೋಧನೆಗಳು ಸಹ ನಡೆಯುತಿರುತ್ತವೆ.
ರಾಬರ್ಟ್ ಬಾಯ್ಲ್ನ 1661ರ ವ್ಯಾಖ್ಯಾನದ ಪ್ರಕಾರ ರನಾಯನಶಾಸ್ತ್ರವು ಮಿಶ್ರ ಪದಾರ್ಥದ ಮೂಲತತ್ತ್ವಗಳನ್ನು ಅಧ್ಯಯನ ಮಾಡುತ್ತದೆ. ಜಾರ್ಜ ಅರ್ನಸ್ಟ್ ಸ್ಟಹ್ಲ ಪ್ರಕಾರ (1730) ಇದು ಪದಾರ್ಥಗಳ ಮಿಶ್ರಣ, ಸಂಯಕ್ತ ಅಥವಾ ಗುಂಪುಗಳನ್ನು ಅವುಗಳ ಮೂಲತತ್ತ್ವಗಳಾಗಿ ವಿಭಜಿಸುವ ಮತ್ತು ಆ ಮೂಲತತ್ತ್ವಗಳನ್ನು ಪದಾರ್ಥಗಳಾಗಿ ಸಂಯೋಜಿಸುವ ಕಲೆ. 1947ರಲ್ಲಿ ಲಿನಸ್ ಪಾಲಿಂಗ್ ರಸಾಯನಶಾಸ್ತ್ರವನ್ನು ಪದಾರ್ಥಗಳ ರಚನೆ, ಅವುಗಳ ಗುಣಗಳು ಮತ್ತು ಅವುಗಳನ್ನು ಇತರ ಪದಾರ್ಥಗಳಾಗಿ ಬದಲಾಯಿಸುವ ಕ್ರಿಯೆಗಳ ಬಗೆಗಿನ ವಿಜ್ಞಾನ ಎಂದು ಗ್ರಹಿಸಿದ್ದಾರೆ. ದ್ರವ್ಯರಾಶಿಯನ್ನು ಅಧ್ಯಯನ ಮಾಡುವುದು ರಸಾಯನಶಾಸ್ತ್ರದ ಗುರಿಗಳಲ್ಲೊಂದು. ಆದರೆ ವಿಜ್ಞಾನಿಯೊಬ್ಬನು ಪದಾರ್ಥವೊಂದರ ಬಣ್ಣದ ಬಗೆಗೆ ಆಸಕ್ತಿ ತಳೆಯ ಬಹುದು ಆದರೆ ಬಣ್ಣವು ಆ ಪದಾರ್ಥ ಹಿಂಗಿಸಿಕೊಳ್ಳುವ ಬೆಳಕಿನ ಅಲೆಯುದ್ದಗಳ ಮೇಲೆ ಆಧಾರ ಪಟ್ಟಿರುತ್ತದೆ. ಹಾಗೆಯೇ ವಿಜ್ಞಾನಿಯೊಬ್ಬ ಪದಾರ್ಥ ಹೊರಸೂಸುವ ಎಕ್ಸ್-ರೇಗಳ ವಿವರ್ತನದ (ಡಿಫ್ರಾಕ್ಶನ್) ಆಧಾರದ ಮೇಲೆ ಅದರ ಪರಮಾಣು ರಚನೆಯ ಬಗೆಗೆ ಆಸಕ್ತನಾಗಿರ ಬಹುದು. ಈ ಅರ್ಥದಲ್ಲಿ ಮೇಲಿನ ವ್ಯಾಖ್ಯಾನ ತೀರ ಕಿರಿದಾಗುತ್ತದೆ. ಈ ವ್ಯಾಖ್ಯಾನ ತೀರ ವಿಶಾಲವಾದುದು ಏಕೆಂದರೆ ಎಲ್ಲಾ ವಿಜ್ಞಾನಗಳನ್ನೂ ಇದರ ಅಡಿ ತರಬಹುದು ಎಂದು ಲಿನಸ್ ಪಾಲಿಂಗ್ ಟಿಪ್ಪಣಿ ಮಾಡಿದ್ದಾರೆ. ಇನ್ನೂ ಇತ್ತೀಚೆಗೆ 1998ರಲ್ಲಿ ಪ್ರೊಪೆಸರ್ ರೇಮಂಡ್ ಚಾಂಗ್ ಇದನ್ನು "ದ್ರವ್ಯರಾಶಿ ಮತ್ತು ಅದು ಹೊಂದುವ ಬದಲಾವಣೆಗಳ" ಅಧ್ಯಯನ ಎಂದು ಸರಳವಾಗಿಸಿದ್ದಾರೆ.
ಆಹಾರ ಬೇಯಿಸುವಿಕೆ, ಮಣ್ಣಿನಿಂದ ಮಡಕೆ ತಯಾರಿಕೆ, ಲೋಹ ತಯಾರಿಕೆ ಮುಂತಾದವುಗಳ ಮೂಲಕ ರಸಾಯನಿಕ ಬದಲಾವಣೆಗಳನ್ನು ಮಾಡಿ ಹಲವು ಸಾವಿರ ವರುಷಗಳಿಂದ ಮಾನವ ಬಳಸುತ್ತಿದ್ದಾನೆ.:p 2 ಕ್ರಿ ಪೂ 5000 ವರುಷಗಳಷ್ಟು ಹಿಂದೆಯೆ ಮಾನವ ಸಾಕ್ಷೇಪಿಕವಾಗಿ ಶುದ್ಧ ರೂಪದಲ್ಲಿ ನಿಸರ್ಗದಲ್ಲಿ ದೊರೆಯುವ ಬಂಗಾರ, ಬೆಳ್ಳಿ ಮತ್ತು ತಾಮ್ರಗಳನ್ನು ಬಳಸತೊಡಗಿದ ಮತ್ತು ಇಂತಹ ಬಳಕೆಯೇ ಎರಡು ಸಾವಿರ ವರುಷಗಳ ನಂತರದಲ್ಲಿ ಕಂಚಿನ ಯುಗಕ್ಕೆ ನಾಂದಿಯಾಯಿತು. ತಟ್ಟಿ ಆಕಾರ ಕೊಟ್ಟ ಮೊದಲ ತಾಮ್ರದ ದಾಖಲೆ ಮದ್ಯಪ್ರಾಚ್ಯದಲ್ಲಿ ಕ್ರಿ ಪೂ 9000ದಲ್ಲಿ ದೊರೆತಿದೆ. ಇನ್ನೊಂದು ಮೂಲವು ಬಂಗಾರ ಅಥವಾ ಚಿನ್ನವು ಕ್ರಿ ಪೂ 40,000 ಕಾಲಮಾನದ ಸುಮಾರಿಗೆ ಸ್ಪೇನ್ನ ಶಿಲಾಯುಗದ ಗವಿಯಲ್ಲಿ ಪತ್ತೆಯಾಗಿದೆ ಎನ್ನುತ್ತದೆ.
ಕ್ರಿ ಪೂ 420ರ ಸುಮಾರು ಗ್ರೀಕ್ನ ಎಂಪೆಡೊಕಲ್ಸ್ ಎಲ್ಲಾ ದ್ರವ್ಯರಾಶಿಯೂ ಭೂಮಿ, ಬೆಂಕಿ, ಗಾಳಿ ಮತ್ತು ನೀರು ಈ ನಾಲ್ಕು ಮೂಲ ಧಾತುಗಳಿಂದ ರೂಪಗೊಂಡಿದೆ ಎಂದು ಹೇಳುವ ಮೂಲಕ ರಸಾಯನಿಕ ಚಿಂತನೆಗೆ ತಾತ್ತ್ವಿಕ ಸ್ವರೂಪ ಕೊಟ್ಟ. ಕ್ರಿ ಪೂ 380ರ ಸುಮಾರಿಗೆ ಡೆಮೊಕ್ರಿಟಸ್ ಪರಮಾಣುಗಳ ಬಗೆಗಿನ ಚಿಂತನೆಯನ್ನು ಮುಂದಿಟ್ಟಿದ್ದ. ಭಾರತದಲ್ಲಿ ಕಣಾದನೂ ಸಹ ಇಂತಹುದೇ ವಾದವನ್ನು ಮಂಡಿಸಿದ್ದ. ಇವು ಪ್ರಯೋಗಗಳ ಮೇಲೆ ಆಧಾರ ಪಡದ ಊಹನಗಳಾಗಿದ್ದವು.
"ಕೀಮಿಯ" ಪದದ ಮೂಲಕ್ಕೆ ಎರಡು ಸಿದ್ಧಾಂತಗಳಿವೆ. ಮೊದಲನೆಯದರ ಪ್ರಕಾರ ಇದು ಈಜಿಪ್ಟ್ ಮೂಲದ ಹೆಸರು ಮತ್ತು ಖಾಮ್ ಎನ್ನುವ ಈಜಿಪ್ಟ್ನ ಹೆಸರಿನಿಂದ ಬಂದಿದೆ. ಹೀಗಾಗಿ ಇದು "ಈಜಿಪ್ಟ್ನ ಕಲೆ" ಎಂಬ ಅರ್ಥ ಪಡೆದಿರಬಹುದು. ಇನ್ನೊಂದರ ಪ್ರಕಾರ ಈ ಪದವು "ಖುಮೊಸ್" ಎನ್ನುವ ಗ್ರೀಕ್ ಪದದಿಂದ ಬಂದಿದ್ದು ಇದರ ಅರ್ಥ ಸಸ್ಯಗಳ ರಸ ಎಂದು. ಹೀಗಾಗಿ ಈ ಪದವು "ರಸಗಳನ್ನು ತೆಗೆಯು ಕಲೆ" ಯಾಗಿ ಬಳಕೆಯಲ್ಲಿದರ ಬಹುದು ಅಥವಾ ಈ ರಸಗಳು ದ್ರವರೂಪದ ಲೋಹಗಳೂ ಆಗಿರಲು ಸಾಧ್ಯ.: p 8 ಇದೇ ನುಡಿಗಟ್ಟು ಮುಂದೆ ಅರಬ್ ದೇಶಗಳಿಗೆ ವಲಸೆ ಹೋಗಿ ಅಲ್-ಕೆಮಿಯ ಆಯಿತು ಮತ್ತು ಯುರೋಪಿನ ಮರುವಲಸೆಯಲ್ಲಿ ಆಧುನಿಕ ಕೆಮಿಸ್ಟ್ರಿ ಅಥವಾ ರಸಾಯನಶಾಸ್ತ್ರವಾಯಿತು.

ಆಧುನಿಕ ರಸಾಯನಶಾಸ್ತ್ರದ ಬೇರುಗಳು ರಸವಿದ್ಯೆಯಲ್ಲಿವೆ. ಜಾಬಿರ್ ಇಬ್ನ್ ಹಯ್ಯಾನ್ (ಕ್ರಿ ಶ 721-815) ಅರಬ್ ಇಸ್ಲಾಂ ಸಂಸ್ಕೃತಿಯ ಪ್ರಮುಖ ರಸವಿದ್ಯೆ (ಅಲ್ಕೆಮಿ) ಪಂಡಿತರಲ್ಲಿ ಒಬ್ಬ. ಇವನು ಅಮೋನಿಯಂ ಕ್ಲೋರೈಡ್ ಮತ್ತು ಬಿಳಿಯ ಸೀಸ ತಯಾರಿಸುವುದನ್ನು ವಿವರಿಸಿದ, ವಿನಿಗರ್ನಿಂದ ಸಾಂದ್ರ ಅಸಿಟಿಕ್ ಆಮ್ಲ ತಯಾರಿಸಿದ. ಬಲಹೀನ ನೈಟ್ರಿಕ್ ಆಮ್ಲ ಸಹ ತಯಾರಿಸಿದ. ಇವನು ಯೂರೋಪಿಗೆ "ಗೆಬರ್" ಎಂದು ಪರಿಚಿತ.: p 21 ಇವನು ಹಲವು ತನ್ನ ಪೂರ್ವಜರಂತೆ ರಸವಿದ್ಯೆ ಸಂಪ್ರದಾಯವಾದ "ಕೀಳು" ಲೋಹಗಳಿಂದ ಚಿನ್ನ ತಯಾರಿಸುವ ಉದ್ಧೇಶ ಹೊಂದಿದ್ದ. ರಸವಿದ್ಯೆಯ ಸಂಪ್ರದಾಯವು ಆಯುಶ್ಯವನ್ನು ಹೆಚ್ಚು ಮಾಡುವ (ಅಮರತ್ವ ಸಾಧಿಸುವ) ಅಥವಾ ಸರ್ವರೋಗ ನಿವಾರಕ "ಸ್ಪರ್ಶಮಣಿ" (ಫಿಲಾಸಪರ್ಸ್ ಸ್ಟೋನ್) ಹುಡುಕಾಟದಲ್ಲಿ ಸಹ ತೊಡಗಿತ್ತು. ಯುರೋಪಿನಲ್ಲಿ "ರೇಜಸ್" ಎಂದು ಹೆಸರಾದ ಅಲ್ ರಜಿ (ಕ್ರಿ ಶ 850-925) ಬಹುತೇಕ ಇಬ್ನ್ ಹಯ್ಯಾನ್ನ ಜಾಡಿನಲ್ಲಿ ನಡೆದರೂ ಅವನ ಒಲವು ಔಷದಗಳ ಕಡೆ ಇತ್ತು.: p 22
ನಂತರದಲ್ಲಿ ಯುರೋಪಿನಲ್ಲಿ ಹಲವರು ಇದೇ ಸಂಪ್ರದಾಯವನ್ನು ಮುಂದುವರೆಸಿದರು. ಸ್ಪೇನ್ನ ವಿದ್ವಾಂಸರಾದ ವಿಲ್ಲಿನೊವದ ಅರ್ನಾಲ್ಡ್ (ಕ್ರಿ ಶ 1235-1311) ಮತ್ತು ರೇಮಂಡ್ ಲುಲ್ಲಿ (ಕ್ರಿ ಶ 1235-1315) ಬರೆದರೆಂದು ಹೇಳಲಾದ ಕೃತಿಗಳಲ್ಲಿನ ಒತ್ತು, ಲೋಹ ಪರಿವರ್ತನೆಯ ಕಡೆಗೆ ಇತ್ತು.: p 25 ಮಧ್ಯಕಾಲೀನ ರಸವಿದ್ಯೆ ವಿದ್ವಾಂಸರಲ್ಲಿ ಗೆಬರ್ ಹೆಸರಿನಲ್ಲಿ ಕ್ರಿ ಶ 1300ರ ಸುಮಾರಿಗೆ ಬರೆದ, ಬಹುಶಹ ಸ್ಪೇನ್ನವನು ಆಗಿರ ಬಹುದಾದ, "ಸುಳ್ಳು ಗೆಬರ್" ಪ್ರಮುಖ ಹೆಸರು. ಅವನು ಇಂದು ಹಲವು ಕೈಗಾರಿಕೆಗಳಲ್ಲಿ ಪ್ರಮುಖ ಪಾತ್ರ ವಹಿಸಿರುವ ರಸಾಯನಿಕ ಗಂಧಕಾಮ್ಲ (ಸಲ್ಪೂರಿಕ್ ಆಮ್ಲ) ತಯಾರಿ ವಿವರಿಸಿದ. ಹಾಗೆಯೆ ಪ್ರಬಲ ನೈಟ್ರಿಕ್ ಆಮ್ಲ ತಯಾರಿಯನ್ನು ಸಹ ವಿವರಿಸಿದ.: p 27
ಖನಿಜಶಾಸ್ತ್ರದಲ್ಲಿ ಆಸಕ್ತನಾದ ಜರ್ಮನ್ನ ಜಾರ್ಜ್ ಬಾವರ್ (ಕ್ರಿ ಶ 1494-1555) ಡಿ ರೆ ಮೆಟಾಲಿಕ ಬರೆದ, 1556ರಲ್ಲಿ ಪ್ರಕಟವಾದ ಇದರಲ್ಲಿ ಗಣಿ ತಂತ್ರಜ್ಞಾನವನ್ನು ವಿವರಿಸಲಾಗಿದೆ. ಅಗ್ರಿಕೊಲ ಎಂದು ಕರೆಸಿಕೊಂಡ ಈ ಲೇಖಕ ಅದುವರೆಗಿನ ಖನಿಜ ಗಣಿಗಾರಿಕೆಯ ಪ್ರಯೋಗಿಕ ಜ್ಞಾನವನ್ನು ಇದರಲ್ಲಿ ನೀಡಿದ್ದಾನೆ.: p 29 ಇನ್ನೊಂದು ಮಹತ್ವದ ಕೃತಿ ಜರ್ಮನ್ನ ಆಂಡ್ರಿಯಾಸ್ ಲಿಬಾವ್ (ಕ್ರಿ ಶ 1540-1616)ನದು. ಲಿಬಾವಿಯಸ್ ಹೆಸರಿನಿಂದ ಗುರುತಿಸಲಾದ ಇವನು ಅಲ್ಕೆಮಿಯ ಬರೆದು 1597ರಲ್ಲಿ ಪ್ರಕಟಿಸಿದ. ಇವನು ಮೊದಲ ಬಾರಿಗೆ ಹೈಡ್ರೊಕ್ಲೋರಿಕ್ ಆಮ್ಲ, ಟಿನ್ ಟೆಟ್ರಾಕ್ಲೋರೈಡ್ ಮತ್ತು ಅಮೋನಿಯಂ ಸಲ್ಫೇಟ್ ತಯಾರಿಯನ್ನು ವಿವರಿಸಿದ. ರಸವಿದ್ಯೆಯ ಗುರಿಯು ಮಾನವನ ಔಷದಗಳನ್ನು ತಯಾರಿಸುವುದು ಎಂದು ಭಾವಿಸುತ್ತಿದ್ದಾಗ್ಯೂ ಇವನು ಇತರ ಲೋಹಗಳನ್ನು ಚಿನ್ನವಾಗಿ ಪರಿವರ್ತಿಸಲು ಸಾಧ್ಯ ಎಂದು ನಂಬಿದ್ದ.: pp 29-31
ಇನ್ನೂ ರಸವಿದ್ಯೆಯ ಸಂಪ್ರದಾಯದಲ್ಲಿಯೇ ಇದ್ದಾಗ್ಯೂ ರಾಬರ್ಟ್ ಬಾಯ್ಲ್ (1627-1691) ಪ್ರಯೋಗಗಳಿಗೆ ಮಹತ್ವ ಕೊಟ್ಟ. ಅವನು 1661ರಲ್ಲಿ ಪ್ರಕಟಿಸಿದ ದಿ ಸ್ಕೆಪ್ಟಿಕಲ್ ಕೆಮಿಸ್ಟ್ನಲ್ಲಿ ಮೂಲಧಾತುವನ್ನು ಪರೀಕ್ಷಿಸದೆ ಒಪ್ಪಿಕೊಳ್ಳುವದನ್ನು ವಿರೋಧಿಸಿದ. "ಕರಾರುವಕ್ಕಾಗಿ ಏಕರೂಪವಾಗಿರದ, ವಿಭಜಿತವಾಗಿ ಇತರ ವಸ್ತುಗಳಾಗಿ, ಅದು ಎಷ್ಟೇ ಸೂಕ್ಷ್ಮವಾಗಿಯಾಗಲಿ, ಮಾರ್ಪಡುವ ಯಾವ ಒಂದು ವಸ್ತುವೂ" ಮೂಲವಸ್ತುವಲ್ಲ ಎಂದು ಅವನು ಹೇಳುತ್ತಾನೆ.: p 447 ಬಾಯ್ಲ್ ನಿಯಮ ಎಂದೇ ಖ್ಯಾತವಾಗಿರುವ ನಿಯಮವು ಅನಿಲದ ಘನಗಾತ್ರ ಮತ್ತು ಒತ್ತಡದ ನಡುವಿನ ವಿಲೋಮ ಅನುಪಾತದ ಸಂಬಂಧವನ್ನು ಹೇಳುತ್ತದೆ. ಇದನ್ನು ಸ್ವತಂತ್ರವಾಗಿ ಎಡ್ಮೆ ಮೇರಿಯೊಟ್ 1680ರಲ್ಲಿ ಕಂಡುಹಿಡಿದ ಮತ್ತು ತಾಪಮಾನವು ಒಂದೇ ರೀತಿಯಾಗಿರ ಬೇಕು ಎಂಬ ನಿಂಬಧನೆಯನ್ನು ಸಹ ಹೇಳಿದ. ಈ ಕಾರಣಕ್ಕೆ ಕೆಲವರು ಇದನ್ನು ಮೇರಿಯಟ್ ನಿಯಮ ಎಂದೇ ಕರೆಯುತ್ತಾರೆ.: pp 38-39 ಬಾಯ್ಲ್ನ ಪ್ರಯತ್ನಗಳ ನಡುವೆಯೂ, ನ್ಯೂಟನ್ ಭೌತವಿಜ್ಞಾನದ ಅಧ್ಯಯನಕ್ಕೆ ಮೀಸಲಿಟ್ಟ ಸಮಯಕ್ಕಿಂತ ಹೆಚ್ಚು ಸಮಯವನ್ನು ರಸಾಯನಶಾಸ್ತ್ರದ ಬಗೆಗೆ ಮೀಸಲಿಟ್ಟಗ್ಯೂ ಹೆಚ್ಚಿನ ಪ್ರಗತಿ ಕಂಡುಬರಲಿಲ್ಲ. ಆದರೆ ವಾಣಿಜ್ಯ ಕೈಗಾರಿಕಾ ಕ್ಷೇತ್ರಗಳಲ್ಲಿನ ಸುಧಾರಣೆಗಳಿಂದಾಗಿ ಪೊಟ್ಯಾಸಿಯಂ ನೈಟ್ರೇಟ್, ಆಲಮ್, ಕಬ್ಬಿಣದ ಸಲ್ಫೇಟ್, ಗಂಧಕಾಮ್ಲ (ಸಲ್ಫೂರಿಕ್ ಆಮ್ಲ), ಸೋಡಾ ಮುಂತಾದ ವಸ್ತುಗಳಿಗೆ ಬೇಡಿಕೆ ಆರಂಭವಾಯಿತು. ಇವುಗಳನ್ನು ತಯಾರಿಸುವ ಅನುಭವ ನಂತರದ ತರ್ಕಬದ್ಧ ಬೆಳವಣಿಗೆಗೆ ಕಾರಣವಾಯಿತು ಎನ್ನುತ್ತಾರೆ ಜೆ. ಡಿ. ಬರ್ನಾಲ್. : p 448
1667ರಲ್ಲಿ ಜೊಹಾನನ್ ಬೆಚರ್ ತನ್ನ ಕೃತಿಯಲ್ಲಿ ಪ್ರಾಚೀನರ ನಾಲ್ಕು ಮೂಲಧಾತುಗಳಲ್ಲಿ ಬೆಂಕಿ, ನೀರು ಮತ್ತು ಗಾಳಿಯನ್ನು ಕೈಬಿಟ್ಟು ಅವುಗಳ ಬದಲು ಭೂಮಿಯ ಮೂರು ರೂಪಗಳನ್ನು ಬಳಸಿದ. ಅವು ಟೆರ್ರ ಲಪಿಡಿಯೇ. ಟೆರ್ರ ಫ್ಲುಯಿಡ ಮತ್ತು ಟೆರ್ರ ಪಿನ್ಗುಯಿಸ್ಟೆರ್ರ ಪಿನ್ಗುಯಿಸ್ ದಹನಕ್ಕೆ ಪ್ರಮುಖವೆಂತಲೂ ಮತ್ತು ದಹಿಸುವ ಪದಾರ್ಥಗಳು ಇದನ್ನು ಬಿಡುಗಡೆ ಮಾಡುತ್ತವೆ ಎಂದು ಅವನು ನಂಬಿದ್ದ. ಈ ಸಿದ್ಧಾಂತವನ್ನು ತುಸು ಬದಲಾಯಿಸಿ ಜಾರ್ಜ್ ಅರ್ನಸ್ಟ್ ಸ್ಟಾಹ್ಲ 1702ರಲ್ಲಿ ಮುಂದಿಟ್ಟ ಮತ್ತು ಟೆರ್ರ ಪಿನ್ಗುಯಿಸ್ ಬದಲು ಪ್ಲಜಿಸ್ಟನ್ ಪದ ಬಳಸಿದ. ಇದು ಸಾಕಷ್ಟು ಜನಪ್ರಿಯವಾಯಿತು. ಇದರ ಪ್ರಕಾರ ದಹಿಸಬಲ್ಲ ವಸ್ತುಗಳಲ್ಲಿ ಪ್ಲಜಿಸ್ಟನ್ ಇರುತ್ತದೆ. ಫ್ಲಜಿಸ್ಟನ್ನನ್ನು ಹೀಗೆ ವಿವರಿಸಲಾಗಿದೆ:
ಈ ಹಿನ್ನೆಲೆಯಲ್ಲಿಯೇ ಕೊನೆಯವರೆಗೂ ಪ್ಲಜಿಸ್ಟನ್ ಸಿದ್ಧಾಂತಕ್ಕೆ ಅಂಟಿಕೊಂಡಿದ್ದ ಜೊಸೆಫ್ ಪ್ರೀಸ್ಟ್ಲಿ ತಾನು ಕಂಡು ಹಿಡಿದ ಅನಿಲವನ್ನು "ಫ್ಲಜಿಸ್ಟನ್ರಹಿತ ಗಾಳಿ" ಎಂದು ಕರೆದ. ವಾಸ್ತವದಲ್ಲಿ ದಹನ ಕ್ರಿಯೆ ಕೆಲವೊಮ್ಮೆ ಪದಾರ್ಥದ ದ್ರವ್ಯರಾಶಿಯನ್ನು ಹೆಚ್ಚು ಮಾಡುತ್ತದೆ ಎಂಬುದನ್ನು ಗಮನಿಸಲಾಗಿತ್ತು. ಆದರೆ ಇದನ್ನು ಪ್ಲಜಿಸ್ಟನ್ ನೆಗಟಿವ್ ಅಥವಾ ರುಣಾತ್ಮಕ ತೂಕ ಹೊಂದಿದೆ ಎಂಬುದರ ಮೂಲಕ ವಿವರಿಸಲಾಗುತ್ತಿತ್ತು.
1754ರಲ್ಲಿ ಜೋಸೆಫ್ ಬ್ಲ್ಯಾಕ್ ಕಾರ್ಬನ್ ಡೈಆಕ್ಸೈಡ್ನ್ನು ಕಂಡುಹಿಡಿದು ಅದನ್ನು "ಸ್ಥಿರ ಗಾಳಿ" ಎಂದು ಕರೆದ. 1766ರಲ್ಲಿ ಹೆನ್ರಿ ಕ್ಯಾವೆಂಡಿಶ್ ಜಲಜನಕ (ಹೈಡ್ರೊಜನ್) ಅನಿಲವನ್ನು ಪ್ರತ್ಯೇಕಿಸಿ "ದಹಿಸುವ ಗಾಳಿ" ಎಂದು ಹೆಸರಿಸಿದ. 1773ರಲ್ಲಿ ಕಾರ್ಲ್ ವಿಲ್ಲ್ಹಿಲ್ಮ್ ಶೀಲೆ (ಆದರೆ ಪ್ರಕಟಣೆ ನಂತರದಲ್ಲಿ) ಮತ್ತು 1774ರಲ್ಲಿ ಜೋಸೆಪ್ ಪ್ರೀಸ್ಟ್ಲಿ ಆಮ್ಲಜನಕ (ಆಕ್ಸಿಜನ್) ಕಂಡುಹಿಡಿದು ಅದನ್ನು ಕ್ರಮವಾಗಿ "ಬೆಂಕಿ ಗಾಳಿ" ಮತ್ತು "ಫ್ಲಜಿಸ್ಟನ್ ರಹಿತ ಗಾಳಿ" ಎಂದು ಹೆಸರಿಸಿದುದು ಸಹ ಈ ಪಟ್ಟಿಗೆ ಸೇರುತ್ತವೆ. ಈ ಬೆಳವಣಿಗೆಗಳ ನಡುವೆ ಪ್ರಾನ್ಸ್ನ ಅಂಟನಿ ಲಾವೋಸಿಯರ್ ದಹನವನ್ನು ಅಧ್ಯಯನ ಮಾಡತೊಡಗಿದ್ದ. ಪ್ರೀಸ್ಟ್ಲಿ ಲಾವೋಸೀಯರ್ಗೆ ತನ್ನ ಪ್ರಯೋಗವನ್ನು ವಿವರಿಸಿದಾಗ ಅವನಿಗೆ ಬಹುಶಹ ಗಾಳಿಯಲ್ಲಿ ದಹನವನ್ನು ಬೆಂಬಲಿಸುವ ಮತ್ತು ಬೆಂಬಲಿಸದ, ಎರಡು ಅನಿಲಗಳು ಇರಬೇಕೆಂಬ ಅನುಮಾನ ಉಂಟಾಯಿತು.

ಪ್ರಯೋಗವೊಂದರಲ್ಲಿ ಲಾವೋಸಿಯರ್ ಮುಚ್ಚಿದ ಪಾತ್ರೆಯಲ್ಲಿ ತವರ ಮತ್ತು ಗಾಳಿಯನ್ನು ಬಿಸಿ ಮಾಡಿದ ಮತ್ತು ಪಾತ್ರೆಯ ತೂಕದಲ್ಲಿ ಯಾವ ವ್ಯತ್ಯಾಸವಾಗದ್ದನ್ನು ದಾಖಲಿಸಿದ. ನಂತರ ಮುಚ್ಚಿದ ಪಾತ್ರೆಯೊಳಗೆ ಗಾಳಿ ಒಳಗೆ ತೂರಿಬಂದದನ್ನು ಮತ್ತು ಹೀಗೆ ಹೆಚ್ಚಾದ ಗಾಳಿಯು ಹೆಚ್ಚಾದ ತವರದ ತೂಕಕ್ಕೆ ಸಮನಾಗಿದ್ದುದ್ದನ್ನು ಗಮನಿಸಿದ. ಈ ಮತ್ತು ಇತರ ಪ್ರಯೋಗಗಳನ್ನು ಅವನು ತನ್ನ 1777ರಲ್ಲಿ ಪ್ರಕಟಿಸಿದ ಕೃತಿಯಲ್ಲಿ ವಿವರಿಸಿದ್ದಾನೆ. ಈ ಕೃತಿಯಲ್ಲಿ ಅವನು ಗಾಳಿಯು ದಹನ ಮತ್ತು ಉಸಿರಾಟವನ್ನು ಬೆಂಬಲಿಸುವ "ಜೈವಿಕ ಗಾಳಿ" ಮತ್ತು ಎರಡನ್ನೂ ಬೆಂಬಲಿಸದ ಅಜೋಟ್ (ಅಥವಾ ಸಾರಜನಕ)ಗಳ ಮಿಶ್ರಣ ಎಂದು ಸಿದ್ಧ ಮಾಡಿ ತೋರಿಸಿದ. 1779ರಲ್ಲಿ ಪ್ಯಾರಿಸ್ನ ರಾಯಲ್ ವಿಜ್ಞಾನ ಅಕೆಡಾಮಿ ಮುಂದೆ ಬಹಳಷ್ಟು ಆಮ್ಲಗಳು ಈ ಉಸಿರಾಡ ಬಹುದಾದ ಗಾಳಿಯನ್ನು ಹೊಂದಿವೆ ಎಂದು ಘೋಶಿಸಿ, ಅದನ್ನು ಆಮ್ಲಜನಕ ಎಂದು ಕರೆದ. 1783ರ ವೇಳೆಗೆ ಫ್ಲಾಜಿಸ್ಟನ್ ಸಿದ್ಧಾಂತವನ್ನು ಪೂರ್ಣವಾಗಿ ತಿರಸ್ಕರಿಸಿ, ಆಕ್ಸಿಜನ್ ಸಿದ್ಧಾಂತ ಮಂಡಿಸಿದ. ಪ್ಲಜಿಸ್ಟನ್ ಸಿದ್ಧಾಂತವನ್ನು ರಷ್ಯಾದ ರಸಾಯನಶಾಸ್ತ್ರಜ್ಞ ಮಿಕೈಲ್ ಲಾಮೊನೊಸವ್ 1756ರಷ್ಟು ಹಿಂದೆಯೇ ತಿರಸ್ಕರಿಸಿ, ದಹನದಲ್ಲಿ ವಸ್ತುಗಳು ಗಾಳಿಯ ಒಂದು ಭಾಗದೊಂದಿಗೆ ಸೇರುತ್ತವೆ ಎಂದು ಸೂಚಿಸಿದ್ದ. ಆದರೆ ಈ ಬರಹಗಳು ರಷ್ಯ ಭಾಷೆಯಲ್ಲಿದ್ದ ಕಾರಣಕ್ಕೆ ಲಾವೋಸಿಯರ್ನ್ನೂ ಒಳಗೊಂಡು ಪಶ್ಚಿಮದ ವಿಜ್ಞಾನಿಗಳಿಗೆ ತಿಳಿದಿರಲಿಲ್ಲ.: p 64 ನೋಡಿ ಆಮ್ಲಗಳು ಮತ್ತು ಪ್ರತ್ಯಾಮ್ಲಗಳು
ಇದಲ್ಲದೆ ಲಾವೋಸಿಯರ್ ಹೊಸ ಮತ್ತು ಹಳೆಯ ಧಾತುಗಳನ್ನೆಲ್ಲಾ ಪರಿಗಣಿಸಿ ಹೆಸರುಗಳನ್ನು ಕ್ರಮಬದ್ಧ ಗೊಳಿಸಿದ. ಇತರರೊಂದಿಗೆ ಸೇರಿ ಹೊಸ ಹೆಸರಿಸುವಿಕೆಯ ಪ್ರಸ್ತಾಪವನ್ನು ಅಕಾಡೆಮಿಗೆ 1787ರಲ್ಲಿ ಸಲ್ಲಿಸಿದ. ಈ ಹೊಸ ಪದ್ಧತಿಯ ಪ್ರಕಾರ ಐತಿಹಾಸಿಕ ಹೆಸರುಗಳಾದ "ಆಯಿಲ್ ಆಫ್ ಟಾರ್ಟರ್", "ಷುಗರ್ ಆಫ್ ಲೆಡ್" ಬದಲಿಗೆ ಹೊಸ ಹೆಸರುಗಳು ಪೊಟಾಸಿಯಂ ಕಾರ್ಬೋನೇಟ್, ಲೆಡ್ ಅಸಿಟೇಟ್ ಎಂದು ಕರೆಯುವಂತಾಯಿತು. ಇದು ವಿವೇಚನಾಯುಕ್ತ ರಸಾಯನಶಾಸ್ತ್ರಕ್ಕೆ ಒಂದು ಪ್ರಮುಖ ಹೆಜ್ಜೆಯಾಯಿತು.: p 614 ಅಲ್ಲದೆ ಅವನು ರಸಾಯನಿಕ ಕ್ರಿಯೆಗೆ ಒಳಗಾಗುವ ಪದಾರ್ಥಗಳನ್ನು ಮತ್ತು ಅವುಗಳ ಉತ್ಪನ್ನಗಳನ್ನು ಎಚ್ಚರಿಕೆಯಿಂದ ತೂಕ ಮಾಡುತ್ತಿದ್ದ ಮತ್ತು ಅನಿಲಗಳು ಹೊರಹೋಗದಂತೆ ಬಿರಡೆ ಹಾಕಿ ಮುಚ್ಚಿದ ಪಾತ್ರೆಗಳನ್ನು ಬಳಸುತ್ತಿದ್ದ. ಅವನ ಪ್ರಯೋಗಗಳು ದ್ರವ್ಯ ಸಂರಕ್ಷಣೆಯ ನಿಯಮವನ್ನು ಬೆಂಬಲಿಸುತ್ತಿದ್ದವು. ಹೀಗೆ ರಸಾಯನಶಾಸ್ತ್ರದಲ್ಲಿ ಹಲವು ಬದಲಾವಣೆಗಳಿಗೆ ಕಾರಣವಾದ ಅಂಟನಿ ಲವೋಸಿಯರ್ನನ್ನು ಸಾರ್ವತ್ರಿಕವಾಗಿ "ಆಧುನಿಕ ರಸಾಯನಶಾಸ್ತ್ರದ ಪಿತಾಮಹ" ಎಂದು ಪರಿಗಣಿಸಲಾಗಿದೆ.: p 69
ಈ ಶತಮಾನದ ಆರಂಭದಲ್ಲಿನ ಪ್ರಮುಖ ಬೆಳವಣಿಗೆ ಡಾಲ್ಟನ್ನ ಪರಮಾಣು ಸಿದ್ಧಾಂತ. ಲೂಯಿಸ್ ಪ್ರೌಸ್ಟ್ 1799ರಲ್ಲಿ ಪ್ರಕಟಿಸಿದ ಪ್ರಬಂಧದಲ್ಲಿ ತಾಮ್ರವು ಆಮ್ಲಜನಕದೊಂದಿಗೆ ಯಾವಾಗಲೂ ನಿರ್ದಿಷ್ಟ ಅನುಪಾತಲ್ಲಿಯೇ ಸೇರುತ್ತದೆ ಎಂಬ ನಿರ್ಣಯಕ್ಕೆ ಬಂದ. ಅಂದು ಇದ್ದ ಸಮಸ್ಯೆ ಎಂದರೆ ಹಲವು ಪದಾರ್ಥಗಳು ಸೇರಿ ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಸಂಯುಕ್ತಗಳಾಗುವುದು. ಡಾಲ್ಟನ್ನ ಪರಮಾಣು ಸಿದ್ಧಾಂತವು ಎಲ್ಲಾ ಪದಾರ್ಥಗಳು ಅವಿಭಾಜ್ಯ, ಕಣ್ಣಿಗೆ ಕಾಣದ, ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ ಎಂದು ಹೇಳುತ್ತಿತ್ತು. ಇದು ಎರಡು ಮೂಲ ಧಾತುಗಳು ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಅನುಪಾತಗಳಲ್ಲಿ ಸಂಯೋಜನೆಗೊಳ್ಳುವ ಸಾಧ್ಯತೆಯನ್ನು ವಿವರಿಸುತ್ತಿತ್ತು.: p 73 ಇದನ್ನು ಬಹು ಅನುಪಾತ ಸಂಯೋಜನೆ ನಿಯಮ (ಲಾ ಆಫ್ ಮಲ್ಟಿಪಲ್ ಪ್ರಪೋರ್ಶನ್) ಎಂದು ಕರೆಯಲಾಗಿದೆ.
ಹಂಫ್ರಿ ಡೇವಿ ಎಲೆಕ್ಟ್ರೊಲೈಸಿಸ್ ಬಳಸಿ 1807ರಲ್ಲಿ ಪೊಟ್ಯಾಶಿಯಮ್ ಮತ್ತು ಸೋಡಿಯಮ್ ಹಾಗೂ ನಂತರದಲ್ಲಿ ಕ್ಯಾಲ್ಸಿಯಮ್, ಮೆಗ್ನೀಶಿಯಮ್, ಬೊರಾನ್ ಮತ್ತು ಬೇರಿಯಮ್ ಮೂಲಧಾತುಗಳನ್ನು ಪ್ರತ್ಯೇಕಿಸಿದ. ಡಾಲ್ಟನ್ ಮೊದಲ ಬಾರಿಗೆ ಆಮ್ಲಜನಕಕ್ಕೆ ವೃತ್ತ, ಜಲಜನಕಕ್ಕೆ ವೃತದ ನಡುವೆ ಬಿಂದು ಹೀಗೆ ಸಂಕೇತಗಳನ್ನು ಬಳಸಿದ. ಅವನ ಬಳಸಿದ ಚಿಹ್ನೆಗಳು ಗಂಧಕಕ್ಕೆ S ಇಂಗ್ಲೀಶ್ ಅಕ್ಷರವನ್ನು ವೃತ್ತದಲ್ಲಿ ಮತ್ತು ರಂಜಕಕ್ಕೆ P ಇಂಗ್ಲೀಶ್ ಅಕ್ಷರವನ್ನು ವೃತ್ತದಲ್ಲಿ ಒಳಗೊಂಡಿದ್ದವು. ಜಾಕೋಬ್ ಬರ್ಜೆಲಿಯಸ್ ವೃತ್ತದ ಅಗತ್ಯವಿಲ್ಲವೆಂದು ಪರಿಗಣಿಸಿ ಪ್ರತಿ ಮೂಲಧಾತುವಿನ ಲ್ಯಾಟಿನ್ ಹೆಸರಿನ ಮೊದಲಕ್ಕರ (ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಮೊದಲಕ್ಕರಗಳು ಒಂದೇ ಆಗಿದ್ದಲ್ಲಿ ಎರಡು ಅಕ್ಷರಗಳನ್ನು) ಚಿಹ್ನೆಗಳಾಗಿಸಲು ಸೂಚಿಸಿದ. ಇದು ಹಲವು ಬರವಣಿಗೆ, ವಿಶೇಷವಾಗಿ ರಸಾಯನಿಕ ಕ್ರಿಯೆಯನ್ನು ಬರೆಯುವುದನ್ನು ಸುಲಭವಾಗಿಸಿತು.: p 86

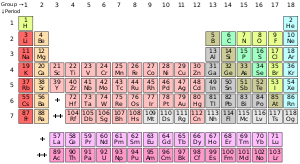
ದಿಮಿತ್ರಿ ಮೆಂಡಲೀವ್ 1869ರಲ್ಲಿ ಪ್ರಕಟಿಸಿದ ಆವರ್ತ ಕೋಷ್ಟಕ, ಈ ಶತಮಾನದ ಇನ್ನೊಂದು ಮಹತ್ವದ ಹೆಜ್ಜೆಯಾಗಿತ್ತು. ಮೆಂಡಲೀವ್ಗೂ ನಾಲ್ಕು ವರುಷ ಮುಂಚೆ ಜಾನ್ ನ್ಯೂಲ್ಯಾಂಡ್ಸ್ ಇಂತಹುದೇ ಪ್ರಯತ್ನದ ಪ್ರಬಂಧವನ್ನು ರಸಾಯನಿಕ ಸೊಸಾಯಿಟಿ ಒಂದೇ ಕಾಲಂನಲ್ಲಿ ಎರಡು ಧಾತುಗಳನ್ನು ತೋರಿಸಿದ ಕಾರಣಕ್ಕೆ ಪ್ರಕಟಿಸಿರಲಿಲ್ಲ. ಜೂಲಿಯರ್ಸ್ ಮೇಯರ್ನ ಕೋಷ್ಟಕವೂ ಸಹ 1868ರಲ್ಲಿ ಪ್ರಕಟನೆಗೆ ಹೋದರೂ 1870ರವರೆಗೂ ಪ್ರಕಟವಾಗಲಿಲ್ಲ. ಮೆಂಡಲೀವ್ ಸಹ ಮೇಯರ್ನಂತೆ ಪರಮಾಣು ತೂಕದ ಆಧಾರದ ಮೇಲೆ ಮೂಲಧಾತುಗಳನ್ನು ಜೋಡಿಸಿದ ಮತ್ತು ಅವುಗಳ ಗುಣಗಳ ಆಧಾರದ ಮೇಲೆ ಏಳು ಸಾಲುಗಳನ್ನಾಗಿ (ನಂತರ ಇಂದಿನಂತೆ ಕಂಬಗಳಲ್ಲಿ) ಪೇರಿಸಿದ. ಅವನು ಕೆಲವು ಮೂಲಧಾತುಗಳು ಇನ್ನೂ ಕಂಡುಹಿಡಿಯ ಬೇಕಿದೆ ಎಂದು ಖಾಲಿ ಸ್ಥಳಬಿಟ್ಟ ಮತ್ತು ಅವುಗಳ ಗುಣಗಳನ್ನು ಊಹಿಸಿದ. ನ್ಯೂಲ್ಯಾಂಡ್ಸ್ ಆಗಲಿ ಮೇಯರ್ ಆಗಲಿ ಮೆಂಡಲೀವ್ನಂತೆ ಸಾಧ್ಯ ಧಾತುಗಳಿಗೆ ಖಾಲಿ ಸ್ಥಳ ಬಿಟ್ಟಿರಲ್ಲಿಲ್ಲ. ಅಲ್ಲದೆ ಮೆಂಡಲೀವ್ ಕೆಲವೊಮ್ಮೆ ಅಣುತೂಕವನ್ನೂ ಕಡೆಗೆಣಿಸಿ ಧಾತುಗಳ ಗುಣಗಳು ಎಲ್ಲಿ ಸರಿಹೊಂದುತ್ತವೆಯೊ ಅಲ್ಲಿ ಕೂರಿಸಿದ.ಜಡಾನಿಲಗಳನ್ನು (ಅಥವಾ ಶ್ರೇಷ್ಠ ಅನಿಲ) ಆ ನಂತರವೇ ಶತಮಾನದ ಕೊನೆಗೆ ವಿಲಿಯಂ ರಾಮ್ಸೆ ಕಂಡುಹಿಡಿದ ನಂತರ ಆವರ್ತ ಕೋಷ್ಟಕಕ್ಕೆ ಇನ್ನೊಂದು ಕಂಬಸಾಲು ಸೇರಿಸಲಾಯಿತು.
ಜೀವ ಮೂಲದ ಪದಾರ್ಥಗಳಾದ ಯೂರಿಯದಂತಹ ಸಾವಯವ ಪದಾರ್ಥಗಳ ತಯಾರಿ, ವೇಲನ್ಸಿ ಪರಿಕಲ್ಪನೆಯ ಹುಟ್ಟು, ಉಷ್ಣಬಲ ವಿಜ್ಞಾನವನ್ನು ರಸಾಯನಶಾಸ್ತ್ರಕ್ಕೆ ಅನ್ವಯಿಸುವುದು ಈ ಶತಮಾನದ ಇತರ ಕೆಲವು ಬೆಳವಣಿಗೆಗಳು. ಅಲ್ಲದೆ ಈ ಶತಮಾನದ ಬಹುತೇಕ ಕೊನೆಯಲ್ಲಿ ಕಂಡುಹಿಡಿದ ಎಲೆಕ್ಟ್ರಾನ್ ಮತ್ತು ಇದು ಇತರ ಬೆಳವಣಿಗೆಗಳೊಂದಿಗೆ ಪರಮಾಣು ರಚನೆಯ ಬಗೆಗೆ ಹಲವು ಸಂಶೋಧನೆಗಳು ಸಹ ನಂತರದಲ್ಲಿ ರಸಾಯನಶಾಸ್ತ್ರದ ಮೇಲೆ ದೊಡ್ಡಮಟ್ಟದ ಪ್ರಭಾವ ಬೀರಿದವು.
ಈ ಕೆಳಗಿನವುಗಳು ರಸಾಯನಶಾಸ್ತ್ರದ ಗ್ರಹಿಕೆಯ ಕೆಲವು ಮೂಲಭೂತ ಅಂಶಗಳು
ಜಗತ್ತಿನಲ್ಲಿ ದ್ರವ್ಯ ಮತ್ತು ಶಕ್ತಿಗಳು ಇವೆ. ಶಕ್ತಿಯು ಕೆಲಸ ಮಾಡುವ ಸಾಮರ್ಥ್ಯವಾದರೆ ದ್ರವ್ಯಕ್ಕೆ ದ್ರವ್ಯರಾಶಿ (ಮಾಸ್) ಇರುತ್ತದೆ ಮತ್ತು ಅದು ಸ್ಥಳವನ್ನು ಆಕ್ರಮಿಸುತ್ತದೆ. ಎಲ್ಲಾ ದ್ರವ್ಯದಲ್ಲಿಯೂ ಪರಮಾಣುಗಳಿಂದ ಕೂಡಿದ ಧಾತುಗಳು ಇರುತ್ತವೆ. ಧಾತುಗಳು ಒಂದೇ ರೀತಿಯ ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.
ಪರಮಾಣುಗಳ ರಚನೆಯನ್ನು ಆಧುನಿಕ ಕ್ವಾಂಟಂ ಭೌತಶಾಸ್ತ್ರ ವಿವರಿಸುತ್ತದೆ. ಪರಮಾಣುವಿನ ಕೇಂದ್ರದಲ್ಲಿ ಬೀಜಕೇಂದ್ರ ಅಥವಾ ನ್ಯೂಕ್ಲಿಯಸ್ ಇರುತ್ತದೆ ಮತ್ತು ಇದು ಪಾಸಿಟಿವ್ ಅಥವಾ ಧನಾವೇಶ (ವಿದ್ಯುತ್ ಆವೇಶ)ವಿರುವ ಪ್ರೋಟಾನ್ ಮತ್ತು ತಟಸ್ಥ ಆವೇಶ ಇರುವ ನ್ಯೂಟ್ರಾನ್ ಎರಡನ್ನೂ ಒಳಗೊಂಡಿರ ಬಹುದು. ಪ್ರೋಟಾನ್ ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳನ್ನು ಜೊತೆಯಾಗಿ ನ್ಯೂಕ್ಲಿಯಾನ್ಗಳೆಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ತೀರ ಸರಳವಾದ ಹೈಡ್ರೋಜನ್ ಪರಮಾಣುವಿನಲ್ಲಿ ಪ್ರೋಟಾನ್ ಮಾತ್ರವಿರುತ್ತದೆ. ಉಳಿದೆಲ್ಲ ಧಾತುಗಳ ಪರಮಾಣುಗಳ ಬೀಜಕೇಂದ್ರದಲ್ಲಿ ಪ್ರೋಟಾನ್ ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳೆರಡೂ ಇರುತ್ತವೆ. ಪ್ರೋಟಾನಿನ ದ್ರವ್ಯರಾಶಿಯು ಒಂದು ಪರಮಾಣು ದ್ರವ್ಯರಾಶಿ ಮಾನಕ (ಅಥವಾ ಅಟಾಮಿಕ್ ಮಾಸ್ ಯುನಿಟ್-ಎಎಮ್ಯು) ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ನಿನ ದ್ರವ್ಯರಾಶಿಯು 1 ಎಎಮ್ಯುಗಿಂತ ತುಸು ಹೆಚ್ಚು. ಪರಮಾಣುವಿನ ಪ್ರೋಟಾನ್ ಸಂಖ್ಯೆಯು ಆ ಧಾತುವಿನ ಪರಮಾಣು ಸಂಖ್ಯೆಯೂ (ಅಟಾಮಿಕ್ ನಂಬರ್) ಹೌದು.
ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ನೆಗಿಟಿವ್ ಅಥವಾ ರುಣಾವೇಶವನ್ನು (ಋಣಾವೇಶ) ಹೊಂದಿರುತ್ತವೆ. ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ನ್ಯೂಕ್ಲಿಯೆಸ್ ಸುತ್ತಲೂ ಕಕ್ಷಕಗಳಲ್ಲಿ ಸುತ್ತುತ್ತವೆ. ಅವುಗಳ ವೇಗ ಬೆಳಕಿನ ವೇಗ ಅಥವಾ ಅದರ ಹತ್ತಿರ ಇರುವ ಕಾರಣಕ್ಕೆ ಕಕ್ಷಕದಲ್ಲಿ ಇಲ್ಲಿಯೇ ಇರುತ್ತವೆ ಎಂದು ಗುರುತಿಸುವುದು ಕಷ್ಟ. ಆದರೆ ಅದು ಇರಬಹುದಾದ ಸಾಧ್ಯ ಪ್ರದೇಶದ ಸಂಖ್ಯಾಶಾಸ್ತ್ರೀಯ ಸಾಧ್ಯತೆಯನ್ನು ಪಡೆಯಬಹುದು. ಎಲೆಕ್ಟ್ರಾನ್ ದ್ರವ್ಯರಾಶಿಯು ಪ್ರೋಟಾನಿನ 1/1836ರಷ್ಟು ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ನಿನ 1/1839ರಷ್ಟು ಇರುತ್ತದೆ. ಪರಮಾಣುವಿನ ಅತ್ಯಂತ ಕೊನೆಯ ಕವಚದಲ್ಲಿರುವ ಎಲೆಕ್ಟ್ರಾನ್ಗಳಿಗೆ ವ್ಯಾಲೆನ್ಸ್ ಎಲೆಕ್ಟ್ರಾನ್ಗಳೆಂದು ಕರೆಯುತ್ತಾರೆ. ಇವು ರಸಾಯನಿಕ ಬಂಧನಗಳಲ್ಲಿ ಭಾಗವಹಿಸುತ್ತವೆ. ಹೀಗಾಗಿ ಒಂದೇ ವ್ಯಾಲೆನ್ಸಿ ಇರುವ ಧಾತುಗಳು ಒಂದೇ ರೀತಿಯ ರಸಾಯನಿಕ ಗುಣಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ.
ಮೂಲಧಾತುವಿನ ಪರಮಾಣುಗಳಲ್ಲಿ ಪ್ರೋಟಾನ್ ಮತ್ತು ನ್ಯೂಟ್ರಾನ್ಗಳೂ ಎರಡೂ ಇರುತ್ತವೆ (ಜಲಜನಕದಲ್ಲಿ ಒಂದು ಪ್ರೋಟಾನ್ ಮಾತ್ರ ಇರುತ್ತದೆ). ಮೂಲಧಾತುವಿನ ಪರಮಾಣು ಒಂದರಲ್ಲಿ ಪ್ರೋಟಾನ್ ಸಂಖ್ಯೆ ಏರುಪೇರಾಗುವುದಿಲ್ಲ ಆದರೆ ನ್ಯೂಟ್ರಾನ್ ಸಂಖ್ಯೆ ಹೆಚ್ಚು ಕಡಿಮೆಯಾಗ ಬಹುದು. ಉದಾಹರಣೆಗೆ ಇಂಗಾಲದಲ್ಲಿ 6 ಪ್ರೋಟಾನುಗಳಿರುತ್ತವೆ. ಸಾಮಾನ್ಯವಾಗಿ ಇಂಗಾಲದ ನ್ಯೂಕ್ಲಿಯಸ್ನಲ್ಲಿ 6 ನ್ಯೂಟ್ರಾನ್ಗಳಿರುತ್ತವೆ. ಹೀಗಾಗಿ ಅದನ್ನು 12C ಎಂದು ಸಂಕೇತಿಸಲಾಗುತ್ತದೆ. ಆದರೆ ಪ್ರಕೃತಿಯಲ್ಲಿ ಇನ್ನೊಂದು ಸ್ಥಿರ ಇಂಗಾಲದ ಪರಮಾಣುವೂ ಇದ್ದು ಅದು ಇಂಗಾಲ-13 ಅಥವಾ (13C) ಎಂದು ಕರೆಯಿಸಿಕೊಳ್ಳುತ್ತದೆ. ಇಂತಹ ನ್ಯೂಟ್ರಾನ್ ಸಂಖ್ಯೆಯಲ್ಲಿ ಭಿನ್ನವಾದ ಮೂಲಧಾತುವನ್ನು ಸಮಸ್ಥಾನಿ (ಐಸೊಟೋಪ್) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ಪರಮಾಣು ತೂಕ ಅಥವಾ ಸಾಕ್ಷೇಪಿಕ ಪರಮಾಣು ದ್ರವ್ಯರಾಶಿ (ರಿಲೇಟಿವ್ ಆಟಮಿಕ್ ಮಾಸ್) ಒಂದು ರಸಾಯನಿಕ ಮೂಲಧಾತುವಿನ ಸರಾಸರಿ ರಾಶಿ ಹಾಗೂ ಒಂದು ನಿರ್ದಿಷ್ಟ ಪ್ರಮಾಣಬದ್ಧ ಮಾನಕಕ್ಕೆ ಇರುವ ಅನುಪಾತ. 1961ರಿಂದ ಈ ಪ್ರಮಾಣಬದ್ಧ ಮಾನಕವನ್ನಾಗಿ ಕಾರ್ಬನ್-12ರ ಪರಮಾಣುವಿನ ದ್ರವ್ಯರಾಶಿಯ ಹನ್ನೆರಡನೆ ಒಂದು ಭಾಗವನ್ನು ಬಳಸಲಾಗುತ್ತಿದೆ. ಉದಾಹರಣೆಗೆ ಹೀಲಿಯಂನ ಪರಮಾಣು ತೂಕ 4.002602 ಮತ್ತು ಈ ಸರಾಸರಿಯು ವಿಪುಲವಾಗಿರುವ ಆ ಮೂಲಧಾತುವಿನ ಸಮಸ್ಥಾನಿಗಳ ಅನುಪಾತವನ್ನು ಪ್ರತಿಬಿಂಬಿಸುತ್ತದೆ.

ಧಾತುಗಳು ಒಂದೇ ರೀತಿಯ ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ ಮತ್ತು ಈ ಪರಮಾಣುಗಳಲ್ಲಿ ಒಂದೇ ಸಂಖ್ಯೆಯ ಪ್ರೋಟಾನುಗಳಿರುತ್ತವೆ. ಇವು ರಾಸಾಯನಿಕವಾಗಿ ತೀರ ಸರಳ ಘಟಕಗಳು ಮತ್ತು ಅವನ್ನು ರಾಸಾಯನಿಕ ವಿಧಾನ ಅಥವಾ ಪದ್ಧತಿಯ ಮೂಲಕ ವಿಭಜಿಸಲು ಬರುವುದಿಲ್ಲ. ಅಣು ಧಾತುವೊಂದರ ಅಥವಾ ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತವೊಂದರ ಅತಿಸಣ್ಣ ಕಣ. ಅವು ಆಮ್ಲಜನಕಗಳ ಅಣುವಿನಂತೆ ಒಂದೇ ಮೂಲಧಾತುಗಳನ್ನು ಹೊಂದಿರಬಹುದು ಅಥವಾ ನೀರಿನ ಅಣುವಿನಂತೆ ಒಂದಕ್ಕೂ ಹೆಚ್ಚು ಮೂಲಧಾತುಗಳನ್ನು ಒಳಗೊಂಡಿರ ಬಹುದು. ಅಣುವಿನಲ್ಲಿ ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಪರಮಾಣುಗಳಿರುತ್ತವೆ ಮತ್ತು ಇವು ಸಾಮಾನ್ಯವಾಗಿ ಅಯಾನಿಕ್ ಬಂಧ, ಸಹವೇಲೆನ್ಸಿ ಬಂಧ ಮುಂತಾದ ರಸಾಯನಿಕ ಬಂಧಗಳಿಂದ ಬಂದಿತವಾಗಿರುತ್ತವೆ.
ರಾಸಾಯನಿಕ ಸಂಯುಕ್ತಗಳು (ಅಥವಾ ಸರಳವಾಗಿ ಸಂಯುಕ್ತ) ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಧಾತುಗಳು ರಾಸಾಯನಿಕವಾಗಿ ಬಂಧಿಸಲ್ಪಟ್ಟ ಪದಾರ್ಥಗಳು ಮತ್ತು ಇವನ್ನು ಇವು ಒಳಗೊಂಡ ಮೂಲ ಧಾತುಗಳಾಗಿ ಬೇರ್ಪಡಿಸಬಹುದು. ಇವುಗಳ ಗುಣಗಳು ಇವು ಒಳಗೊಂಡ ಮೂಲಧಾತುಗಳ ಗುಣಗಳಿಗಿಂತ ಬೇರೆಯಾಗಿರ ಬಹುದು. ಇವು ಯಾವಾಗಲೂ ಒಂದೇ ಅನುಪಾತದಲ್ಲಿ ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿರುತ್ತವೆ. ಹೈಡ್ರೊಜನ್ ಅಥವಾ ಜಲಜನಕದ ಎರಡು ಪರಮಾಣುಗಳು ಮತ್ತು ಆಕ್ಸಿಜನ್ ಅಥವಾ ಆಮ್ಲಜನಕದ ಒಂದು ಪರಮಾಣು ಇರುವ ನೀರು ಇದಕ್ಕೊಂದು ಉದಾಹರಣೆ. ಮಿಶ್ರಣವು ಎರಡೂ ಅಥವಾ ಹೆಚ್ಚು ಧಾತುಗಳ ಅಥವಾ/ಮತ್ತು ಸಂಯುಕ್ತಗಳ ಭೌತಿಕ ಮಿಶ್ರಣ. ಇವನ್ನು ಭೌತಿಕ ಪದ್ಧತಿಗಳ ಮೂಲಕ ಬೇರ್ಪಡಿಸ ಬಹುದು ಮತ್ತು ಇವುಗಳ ಘಟಕಗಳು ಬಹಳಷ್ಟು ಸಲ ತಮ್ಮ ಮೂಲ ಗುಣಗಳನ್ನು ಉಳಿಸಿಕೊಂಡಿರುತ್ತವೆ. ಗಾಳಿ, ಮಿಶ್ರ ಲೋಹ (ಅಲಾಯ್) ಇದಕ್ಕೆ ಉದಾಹರಣೆಗಳು.
ಅವೊಗಾಡ್ರೋ ಸಂಖ್ಯೆ (ಅಥವಾ ಅವೊಗಾಡ್ರೊ ನಿಯತಾಂಕ) ಒಂದು ಮೋಲ್ ಪದಾರ್ಥದಲ್ಲಿನ ಕಣಗಳ ಸಂಖ್ಯೆ (ಪರಮಾಣು, ಅಣು ಮುಂತಾದ). ಮೆಟ್ರಿಕ್ ವ್ಯವಸ್ಥೆ ಇದನ್ನು ಇನ್ನೂ ಖಚಿತವಾಗಿ ವ್ಯಾಖ್ಯಾನಿಸುತ್ತದೆ. ಅದರ ಪ್ರಕಾರ ಅವೊಗಾಡ್ರೊ ಸಂಖ್ಯೆ 12 ಗ್ರಾಂ (ಅಥವಾ 0.024 ಪೌಂಡ್) ಇಂಗಾಲ-12ರಲ್ಲಿ ಇರುವ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆ. ಇದನ್ನು L ಅಥವಾ NA ಸಂಕೇತದಿಂದ ಸೂಚಿಸಲಾಗುವ ಈ ಸಂಖ್ಯೆಯ ಬೆಲೆ 6.02214× 1023. ಇದೊಂದು ನಿಯತಾಂಕ ಏಕೆಂದರೆ ಒಂದು ಮೋಲ್ ಆಮ್ಲಜನಕ ಅಣುವಿನಲ್ಲಿ (ಆಮ್ಲಜನಕದ ಅಣುವಿನಲ್ಲಿ ಎರಡು ಆಮ್ಲಜನಕ ಪರಮಾಣುಗಳಿರುತ್ತವೆ) ಅಷ್ಟೇ ಸಂಖ್ಯೆಯ ಪರಮಾಣುಗಳಿರುತ್ತವೆ. ಆಮ್ಲಜನಕದ ಎರಡು ಪರಮಾಣುಗಳ ತೂಕ ಸುಮಾರು 32 ಆದ್ದರಿಂದ ಒಂದು ಮೋಲ್ ಎಂದರೆ ಇಲ್ಲಿ 32 ಗ್ರಾಂ. ಅವೊಗಾಡ್ರೊ ಸಂಖ್ಯೆ ಅವೊಗಾಡ್ರೊ ಸಂಖ್ಯೆ ಪ್ರಾಯೋಗಿಕವಾಗಿ ನಿರ್ದರಿತವಾದ ಸಂಖ್ಯೆ.
ರಸಾಯನಿಕ ಪದಾರ್ಥಗಳು ಹಲವು ಸ್ಥಿತಿಗಳಲ್ಲಿ ಇರಬಲ್ಲವು. ಸಾಮಾನ್ಯವಾಗಿ ಗುರುತಿಸಲಾಗುವ ಸ್ಥಿತಿಗಳು ಘನ, ದ್ರವ ಮತ್ತು ಅನಿಲ. ಘನ ಸ್ಥಿತಿಯಲ್ಲಿ ಪದಾರ್ಥಗಳು ಹೆಚ್ಚು ಒತ್ತಾಗಿ ವ್ಯವಸ್ಥಿತವಾಗಿರುತ್ತವೆ. ಅವುಗಳ ಚಲನಶಕ್ತಿ ತೀರ ಕಡಿಮೆ ಇರುತ್ತದೆ. ಅವುಗಳಿಗೆ ನಿರ್ದಿಷ್ಟ ಘನಗಾತ್ರವಿರುತ್ತದೆ ಮತ್ತು ಅವು ತಾವು ಇರುವ ಪಾತ್ರೆಯ ಸ್ವರೂಪ ಪಡೆಯುವುದಿಲ್ಲ. ದ್ರವರೂಪದ ಪದಾರ್ಥಗಳು ಕಡಿಮೆ ಒತ್ತಾಗಿ ವ್ಯಸ್ಥಿತಗೊಂಡಿರುತ್ತವೆ ಮತ್ತು ಅವುಗಳಲ್ಲಿನ ಚಲನಶಕ್ತಿ ಘನ ಪದಾರ್ಥಗಳಿಗಿಂತ ಹೆಚ್ಚು ಇರುತ್ತದೆ. ಅವುಗಳಿಗೆ ಘನಗಾತ್ರ ಇರುತ್ತದೆ. ಅವು ಹರಿಯಬಲ್ಲವು ಮತ್ತು ಅವು ಯಾವ ಪಾತ್ರೆಗಳಲ್ಲಿರುತ್ತವೆಯೊ ಅದರ ಆಕಾರ ಪಡೆಯುತ್ತವೆ. ಅನಿಲಗಳ ಕಣಗಳ ನಡುವೆ ದೊಡ್ಡ ಸ್ಥಳವಿರುತ್ತದೆ. ಅನಿಲ ಕಣಗಳು ಅಣುಗಳ ನಡುವಿನ ಸೆಳೆತದ ಶಕ್ತಿಯನ್ನು ಮೀರುವಷ್ಟು ಚಲನಶಕ್ತಿ ಪಡೆದಿರುತ್ತವೆ. ಹೀಗಾಗಿ ಅವಕ್ಕೆ ನಿರ್ದಿಷ್ಟ ಘನಗಾತ್ರವಾಗಲಿ ಅಥವಾ ಆಕಾರವಾಗಲಿ ಇರುವುದಿಲ್ಲ. ಅಷ್ಟೇನು ಪರಿಚಿತವಲ್ಲದ ಪ್ಲಾಸ್ಮ, ಬೋಸ್-ಐನ್ಸ್ಟೀನ್ ಘನೀಕರಣ ಮುಂತಾದ ದ್ರವ್ಯರಾಶಿಯ ಸ್ಥಿತಿಗಳೂ ಇವೆ.
ಈ ಸ್ಥಿತಿಗಳು ತಾಪಮಾನ ಮತ್ತು ಒತ್ತಡಗಳು ಬದಲಾದಂತೆ ಬದಲಾಗ ಬಲ್ಲವು. ಉದಾಹರಣೆ ನೀರು ಮಂಜುಗಡ್ಡೆಯಾಗಿ ಘನ ರೂಪದಲ್ಲೂ, ನೀರಾಗಿ ದ್ರವ ರೂಪದಲ್ಲಿಯೂ ಮತ್ತು ಆವಿಯಾಗಿ ಅನಿಲ ರೂಪದಲ್ಲಿಯೂ ಇರುತ್ತದೆ. ಮಂಜುಗಡ್ಡೆ ನೀರಾಗುವುದನ್ನು ಕರಗುವಿಕೆ ಮತ್ತು ಅದರ ವಿರುದ್ಧ ಪ್ರಕ್ರಿಯೆ ನೀರು ಮಂಜುಗಡ್ಡೆಯಾಗುವುದನ್ನು ಘನೀಕರಿಸುವುದು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಹಾಗೆಯೇ ನೀರು ಆವಿಯಾಗುವುದು ಅಥವಾ ದ್ರವ ಅನಿಲವಾಗುವುದನ್ನು ಆವೀಕರಣ ಅಥವಾ ಅನಿಲವಾಗಿಸುವಿಕೆ ಎನ್ನುತ್ತಾರೆ. ಕೆಲವು ಸಂದರ್ಭಗಳಲ್ಲಿ (ಉದಾಹರಣೆಗೆ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ನಲ್ಲಿ) ಘನ ರೂಪವು ನೇರವಾಗಿ ಅನಿಲವಾಗುತ್ತದೆ. ಇದನ್ನು ಉತ್ಪತನ (ಸಬ್ಲಿಮೇಶನ್) ಎನ್ನುತ್ತಾರೆ.

ರಾಸಾಯನಿಕ ಬಂಧದ ಸಾಮಾನ್ಯ ನಿಯಮದ ಪ್ರಕಾರ ಪರಮಾಣುಗಳು ಇಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು (ಎಲೆಕ್ಟ್ರಾನ್) ಗಳಿಸುವ ಅಥವಾ ಕಳೆದುಕೊಳ್ಳುವ ಮೂಲಕ ಅಥವಾ ಹಂಚಿಕೊಳ್ಳುವ ಮೂಲಕ ತಮ್ಮ ಹೊರ ಇಲೆಕ್ಟ್ರಾನ್ ಕವಚದಲ್ಲಿ ಎರಡು ಅಥವಾ ಎಂಟು ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಜಡಾನಿಲದ ಎಲೆಕ್ಟ್ರಾನ್ ವಿನ್ಯಾಸ ಪಡೆಯುತ್ತವೆ. ಇದನ್ನು ಕೆಲವೊಮ್ಮೆ ಅಷ್ಟಕ ನಿಯಮ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಸಾಮಾನ್ಯ ಬಂಧಗಳು ಅಯಾನಿಕ್ ಬಂಧ, ಸಹವೇಲೆನ್ಸಿ ಬಂಧ ಮತ್ತು ಹೈಡ್ರೊಜನ್ ಬಂಧಗಳೆಂದು ವಿಭಜಿಸ ಬಹುದು. ಅಯಾನಿಕ್ ಬಂಧದಲ್ಲಿ ಎರಡು ಪರಮಾಣುಗಳು ಎಲೆಕ್ಟ್ರಾನ್ ಪಡೆದು ಅಥವಾ ಕಳೆದುಕೊಂಡು ಅಯಾನುಗಳಾಗುತ್ತವೆ ಜೊತೆಗೆ ಜಡ ಅನಿಲಗಳ ಹೊರ ಎಲೆಕ್ಟ್ರಾನ್ ಕವಚ ಹೋಲುವ ಕವಚ ಪಡೆಯುತ್ತವೆ. ಇದು ಅವುಗಳ ನಡುವೆ ಅಯಾನಿಕ್ ಬಂಧ ಏರ್ಪಡಲು ಕಾರಣವಾಗುತ್ತದೆ. ಸೋಡಿಯಂ ಕ್ಲೋರೈಡ್ ಇದಕ್ಕೆ ಒಳ್ಳೆಯ ಉದಾಹರಣೆ.

ಸಹವೇಲೆನ್ಸಿ ಬಂಧದಲ್ಲಿ ಪರಮಾಣುಗಳು ಎಲೆಕ್ಟ್ರಾನ್ಗಳನ್ನು ಹಂಚಿಕೊಳ್ಳುವ ಮೂಲಕ ಜಡ ಅನಿಲಗಳ ಹೊರ ಕವಚದ ಎಲೆಕ್ಟ್ರಾನ್ ವಿನ್ಯಾಸ ಪಡೆಯುತ್ತವೆ. ಮೀಥೇನ್ನಲ್ಲಿನ ಇಂಗಾಲದ ಅತ್ಯಂತ ಹೊರ ಕವಚದಲ್ಲಿ ನಾಲ್ಕು ಇಲೆಕ್ಟ್ರಾನ್ಗಳು ಇರುತ್ತವೆ ಹೀಗಾಗಿ ಎಂಟಾಗಲು ನಾಲ್ಕು ಖಾಲಿ ಸ್ಥಳಗಳು ಇರುತ್ತವೆ. ನಾಲ್ಕು ಜಲಜನಕ (ಹೈಡ್ರೊಜನ್) ಪರಮಾಣುಗಳು ಒಂದೊಂದು ಇಲೆಕ್ಟ್ರಾನ್ ಹಂಚಿಕೊಳ್ಳುತ್ತವೆ. ಹೀಗೆ ಹಂಚಿಕೊಂಡಾಗ ಜಲಜನಕದ ಕವಚದಲ್ಲಿ ಎರಡು ಎಲೆಕ್ಟ್ರಾನ್ಗಳಾದರೆ ಇಂಗಾಲದ ಕವಚದಲ್ಲಿ ಎಂಟು ಎಲೆಕ್ಟ್ರಾನ್ಗಳಾಗುತ್ತವೆ (ಚಿತ್ರ ನೋಡಿ). ವಾಸ್ತವದಲ್ಲಿ ಜಲಜನಕ ಬಂಧವು ಒಳಅಣು ಆಕರ್ಷಣೆಯಲ್ಲಿ ಬದಲಿಗೆ ಹೊರಅಣು ಆಕರ್ಷಣೆ. ಕೆಲವೊಂದು ಸಹವೇಲೆನ್ಸಿ ಬಂಧಗಳಲ್ಲಿ ಲೋಹೇತರ ಪರಮಾಣುವಿನೊಂದಿಗೆ ಹೆಚ್ಚು ಇರುತ್ತದೆ ಮತ್ತು ಹೀಗಾಗಿ ಒಂದು ಪರಮಾಣು ಅಲ್ಪ ಧನಾವೇಶ ಮತ್ತು ಇನ್ನೊಂದು ಪರಮಾಣು ಅಲ್ಪ ರುಣಾವೇಶ (ಋಣಾವೇಶ) ಪಡೆಯುತ್ತವೆ. ಇಂತಹ ಬಂಧಗಳು ದ್ರುವೀಯ ಚಲನೆಯನ್ನು ತೋರುತ್ತವೆ. ಇಂತಹ ಸಂದರ್ಭದಲ್ಲಿ ಒಂದು ಅಣುವಿನ ಜಲಜನಕ ಪರಮಾಣು ಮತ್ತು ಇನ್ನೊಂದು ಅಣುನಿನ ಹೆಚ್ಚಿನ ಎಲೆಕ್ಟ್ರಾನ್ರುಣತ್ವ ಇರುವ ಸಣ್ಣ ಪರಮಾಣುಗಳ ನಡುವೆ ಆಕರ್ಷಣೆಯ ಬಂಧ ಏರ್ಪಡುತ್ತದೆ. ಹೀಗಾಗಿ ಇದು ಅಣುಗಳ ನಡುವಿನ ಆಕರ್ಷಣೆ ಮತ್ತು ಇದರ ಬಂಧನ ಸಾಮರ್ಥ್ಯವು ಸಹವೇಲೆನ್ಸಿ ಬಂಧದ ಶೇ 5 ರಿಂದ 10ರಷ್ಟು ಇರುತ್ತದೆ.
ಲೋಹಿಯ ಬಂಧವು (ಲೌಹಿಕ ಬಂಧ) ತೀರ ಒತ್ತಾಗಿ ಪೇರಿಸಲ್ಪಟ್ಟ ಲೋಹದ ಪರಮಾಣುಗಳನ್ನು ಹಿಡಿದಿಡುತ್ತದೆ. ಬಹಳಷ್ಟು ಸಲ ಲೋಹದ ಪ್ರತಿ ಪರಮಾಣುವಿನ ಅತ್ಯಂತ ಹೊರ ಎಲೆಕ್ಟ್ರಾನ್ ಕವಚ ಪಕ್ಕದ ಹಲವು ಇತರ ಪರಮಾಣುಗಳು ಹೊರ ಕವಚಗಳ ಮೇಲೆ ಚಾಚಿಕೊಂಡಿರುತ್ತದೆ. ಈ ಕಾರಣಕ್ಕೆ ವೇಲನ್ಸಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಯಾವುದೇ ನಿರ್ದಿಷ್ಟ ಪರಮಾಣುಗಳ ಜೋಡಿಗೆ ಸೀಮಿತವಾಗದೆ ಸತತವಾಗಿ ಒಂದು ಪರಮಾಣುವಿನಿಂದ ಇನ್ನೊಂದು ಪರಮಾಣುವಿಗೆ ಚಲಿಸುತ್ತಿರುತ್ತವೆ. ಹೀಗಾಗಿ ಸಹವೇಲೆನ್ಸಿ ಬಂಧದ ಪದಾರ್ಥಗಳಲ್ಲಿಯಂತೆ ಅಲ್ಲದೆ ಲೋಹಿಯ ಬಂಧದಲ್ಲಿ ಎಲೆಕ್ಟ್ರಾನ್ಗಳು ಸ್ಥಳೀಯವಾಗಿರದೆ ಸಾಪೇಕ್ಷಿಕವಾಗಿ ಮುಕ್ತವಾಗಿ ಚಲಿಸುತ್ತವೆ. ಇದನ್ನು ಲೋಹಿಯ ಧನ ಅಯಾನುಗಳನ್ನು ಸುತ್ತುವರೆದ ಎಲೆಕ್ಟ್ರಾನ್ಗಳ ಸಾಗರ ಎಂದು ನಾವು ಕಲ್ಪಿಸಿಕೊಳ್ಳ ಬಹದು. ಇದು ಅನೇಕ ಲೋಹದ ಗುಣಗಳನ್ನು ವಿವರಿಸುತ್ತದೆ.

ರಸಾಯನಿಕ ಕ್ರಿಯೆಯು ಕ್ರಿಯೆಯಲ್ಲಿ ಭಾಗಿಯಾಗುವ (ಪ್ರತಿವರ್ತಕ) ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಪದಾರ್ಥಗಳನ್ನು, ಉತ್ಪನ್ನಗಳು ಎಂದು ಕರೆಯಲಾಗುವ, ಒಂದು ಅಥವಾ ಹೆಚ್ಚು ಬೇರೆ ಪದಾರ್ಥಗಳನ್ನಾಗಿ ಪರಿವರ್ತಿಸುವ ಪ್ರಕ್ರಿಯೆ. ಪ್ರತಿವರ್ತಕ ಅಥವಾ ಉತ್ಪನ್ನ ಪದಾರ್ಥಗಳು ಮೂಲಧಾತುಗಳು ಅಥವಾ ಸಂಯುಕ್ತಗಳು ಆಗಿರಬಹುದು. ರಸಾಯನಿಕ ಕ್ರಿಯೆಗಳಲ್ಲಿ ರಸಾಯನಿಕ ಬಂಧನ ಏರ್ಪಡುತ್ತವೆ ಅಥವಾ/ಮತ್ತು ಮುರಿಯುತ್ತವೆ. ರಸಾಯನಿಕ ಕ್ರಿಯೆಗಳನ್ನು ಪ್ರಮುಖವಾಗಿ ರಸಾಯನಿಕ ಸಂಯೋಗ, ರಸಾಯನಿಕ ವಿಭಜನೆ, ರಸಾಯನಿಕ ಸ್ಥಾನಪಲ್ಲಟ ಮತ್ತು ರಸಾಯನಿಕ ವಿನಿಮಯ (ದ್ವಿ ವಿಭಜನೆ) ಎಂದು ವಿಂಗಡಿಸಲಾಗಿದೆ. ಅಲ್ಲದೆ ಇತರ ವಿಂಗಡನೆಗಳು ರಸಾಯನಿಕ ಒತ್ತರ, ಅನಿಲ ಜನಕ ಕ್ರಿಯೆ, ಆಮ್ಲ-ಪ್ರತ್ಯಾಮ್ಲ ತಟಸ್ಥೀಕರಣಗಳು.
ರಸಾಯನಿಕ ಕ್ರಿಯೆಯನ್ನು ಬರೆಯುವ ಸಂಪ್ರದಾಯದಲ್ಲಿ ಪ್ರತಿವರ್ತಕಗಳನ್ನು ಎಡಕ್ಕೂ ಮತ್ತು ಉತ್ಪನ್ನಗಳನ್ನು ಬಲಕ್ಕೂ ಬರೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ನಡುವಿನಲ್ಲಿ ಒಂದು ಬಾಣದ ಚಿಹ್ನೆ ಇರುತ್ತದೆ. ಇದನ್ನು ರಸಾಯನಿಕ ಸಮೀಕರಣ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಪ್ರತಿ ಧಾತು ಅಥವಾ ಸಂಯುಕ್ತದ ಚಿಹ್ನೆಯು ಅದರ ಮೋಲ್ ಪದಾರ್ಥವನ್ನು ಸೂಚಿಸುತ್ತದೆ (ಇದು ಧಾತುವಿನ ಪರಮಾಣು ತೂಕ ಅಥವಾ ಸಂಯುಕ್ತದ ಅಣುತೂಕವು ಗ್ರಾಂನಲ್ಲಿ ವ್ಯಕ್ತಪಡಿಸುತ್ತದೆ.). ಅಲ್ಲದೆ ಸಮೀಕರಣದಲ್ಲಿ ಪರಮಾಣುಗಳ ಸಂಖ್ಯೆಗಳನ್ನು ಎಡ ಮತ್ತು ಬಲಗಳೆರಡರಲ್ಲೂ ಸರಿದೂಗಿಸ ಬೇಕಾಗುತ್ತದೆ.
ಈ ಮೇಲಿನ ಸಮೀಕರಣದಲ್ಲಿ ಒಂದು ಮೋಲ್ ಮೀಥೇನ್ ಅಣು ಎರಡು ಮೂಲ್ ಆಮ್ಲಜನಕ ಅಣುವಿನೊಂದಿಗೆ ಸೇರಿ ಒಂದು ಮೋಲ್ ಇಂಗಾಲದ ಡೈಆಕ್ಸೈಡ್ ಅಣು ಮತ್ತು ಎರಡು ಮೋಲ್ ನೀರಿನ ಅಣು ಆಗುತ್ತವೆ. ಕೆಲವೊಮ್ಮೆ ಪದಾರ್ಥಗಳ ಸ್ಥಿತಿಗಳನ್ನು ಘನಕ್ಕೆ -"s", ದ್ರವಕ್ಕೆ -"l", ಅನಿಲಕ್ಕೆ -"g" ಮತ್ತು ಜಲೀಯ ದ್ರಾವಣಕ್ಕೆ-"aq" ಚಿಹ್ನೆಗಳ ಮೂಲಕ ತೋರಿಸಲಾಗುತ್ತದೆ.
ರಸಾಯನಿಕ ಕ್ರಿಯೆಯು ಪರಮಾಣುವಿನ, ಅಣ್ವಿಕ ಮತ್ತು ಒಟ್ಟಾರೆಯ ರಾಚನಿಕ ಬದಲಾವಣೆಗಳಿಗೆ ಕಾರಣವಾಗುತ್ತದೆ. ಇದೇ ಕಾರಣಕ್ಕೆ ರಸಾಯನಿಕ ಕ್ರಿಯೆಯು ಅದು ಒಳಗೊಂಡ ಪದಾರ್ಥಗಳ ಶಕ್ತಿಯಲ್ಲಿ ಏರುಪೇರಾಗುವುದನ್ನು ಒಳಗೊಂಡಿರುತ್ತದೆ. ಪರಿವರ್ತಕಗಳು ಮತ್ತು ಪರಿಸರದ ನಡುವೆ ಶಕ್ತಿಯ ಕೊಡುಕೊಳ್ಳುವಿಕೆ ಇರುತ್ತದೆ. ಈ ಶಕ್ತಿಯು ಉಷ್ಣ, ಬೆಳಕು, ವಿದ್ಯುತ್, ಅಥವಾ ಶ್ರವಣಾತೀತ ದನಿಯಂತಹ (ಆಲ್ಟ್ರಾಸೌಂಡ್) ಭೌತಿಕ ಶಕ್ತಿಯೂ ಆಗಿರಬಹುದು. ರಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು ಉಷ್ಣವನ್ನು ಹೊರಸೂಸಿದರೆ ಅವನ್ನು ಉಷ್ಣಕ್ಷೇಪಕ ಕ್ರಿಯೆಗಳು ಎಂದು ಮತ್ತು ಉಷ್ಣ ಹೀರಿಕೊಳ್ಳುತ್ತಿದ್ದರೆ ಉಷ್ಣಗ್ರಾಹಕ ಕ್ರಿಯೆಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಕೆಲವು ಕ್ರಿಯೆಗಳಲ್ಲಿ ಪ್ರತಿವರ್ತಕಗಳು ಶಕ್ತಿಯ ಅಡಚಣೆಯನ್ನು ಅಧಿಗಮಿಸಿದಾಗಲಷ್ಟೇ ಕ್ರಿಯೆ ಆರಂಭವಾಗುತ್ತದೆ. ಇದನ್ನು ಸಕ್ರಿಯಕಾರಕ ಶಕ್ತಿ ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಕೆಲವೊಮ್ಮೆ ನಿರ್ದಿಷ್ಟ ತಾಪಮಾನದಲ್ಲಿ ಸಕ್ರಿಯಕಾರಕ ಶಕ್ತಿಯು ಕ್ರಿಯೆಯ ವೇಗಕ್ಕೆ ಸಂಬಂಧಿಸಿರುತ್ತದೆ. ಕೆಲವೊಂದು ರಸಾಯನಿಕ ಕ್ರಿಯೆಗಳು ಪ್ರತಿವರ್ತಕಗಳಲ್ಲದೆ ಇತರ ಪದಾರ್ಥಗಳ ಇರುವಿಕೆಯಲ್ಲಿ ವೇಗವನ್ನು ಪಡೆದುಕೊಳ್ಳುತ್ತವೆ ಇದನ್ನು ವೇಗವರ್ಧನೆ (ಕೆಟಲೈಸಿಸ್) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಇಂತಹ ಹೆಚ್ಚುವರಿ ಆದರೆ ಕ್ರಿಯೆಯ ನಂತರ ಬದಲಾಗದ ಪದಾರ್ಥಕ್ಕೆ ವೇಗವರ್ಧಕ (ಕೆಟಾಲಿಸ್ಟ್) ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ.
ರೆಡಾಕ್ಸ್ ಆಕ್ಸಿಡೀಕರಣ (ಉತ್ಕರ್ಷಣೆ) ಮತ್ತು ರಿಡಕ್ಶನ್ (ಅಪಕರ್ಷಣೆ) ಎರಡನ್ನೂ ಒಳಗೊಳ್ಳುವ ರಸಾಯನಿಕ ಕ್ರಿಯೆ. ಇತರ ಪದಾರ್ಥಗಳನ್ನು ಆಕ್ಸಿಡೀಕರಣ ಮಾಡುವ ಪದಾರ್ಥಗಳನ್ನು ಆಕ್ಸಿಡಿಕಾರಕಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಆಕ್ಸಿಡಿಕಾರಕವು ಇನ್ನೊಂದು ಪದಾರ್ಥದಿಂದ ಎಲೆಕ್ಟ್ರಾನನ್ನು ತೆಗೆಯುತ್ತದೆ. ಹಾಗೆಯೇ ಇನ್ನೊಂದು ಪದಾರ್ಥವನ್ನು ರಿಡಕ್ಶಿಸುವ ಪದಾರ್ಥವನ್ನು ರಿಡಕ್ಶನೀಕಾರಕ ಎಂದು ಕರೆಯಲಾಗಿದೆ. ರಿಡಕ್ಶನೀಕಾರಕ ಇನ್ನೊಂದು ಪದಾರ್ಥಕ್ಕೆ ಎಲೆಕ್ಟ್ರಾನ್ "ದಾನ" ಮಾಡುತ್ತದೆ. ಹೀಗಾಗಿ ಅದನ್ನು ಎಲೆಕ್ಟ್ರಾನ್ ದಾನಿ ಎಂದು ಸಹ ಕರೆಯಲಾಗುತ್ತದೆ. ಐತಿಹಾಸಿಕವಾಗಿ ಆಕ್ಸಿಡೀಕರಣ ಪದವನ್ನು ಮೊದಲು ಲಾವೋಸೀಯರ್ ಆಮ್ಲಜನಕ ಒಳಗೊಳ್ಳುವ ಕ್ರಿಯೆಗೆ ಬಳಸಿದ. ನಂತರದಲ್ಲಿ ಆಕ್ಸಿಜನೀಕಣಗೊಂಡ ಪದಾರ್ಥಗಳು ಎಲೆಕ್ಟ್ರಾನ್ ಕಳೆದುಕೊಳ್ಳುತ್ತವೆ ಎಂದು ತಿಳಿದು ಬಂತು. ಹೀಗಾಗಿ ಆಕ್ಸಿಡೀಕರಣವನ್ನು ಎಲೆಕ್ಟ್ರಾನ್ ಕಳೆದುಕೊಳ್ಳುವ ಕ್ರಿಯೆಗೆ ಅನ್ವಯಿಸಲಾಯಿತು.
ಅಯಾನುಗಳು ಆವೇಶ (ವಿದ್ಯುದ್ದಾವೇಶ- ಚಾರ್ಜ್) ಪಡೆದ ಪರಮಾಣು ಅಥವಾ ಅಣುಗಳು. ಪರಮಾಣು ಅಥವಾ ಅಣುವಿನ ಪ್ರೋಟಾನುಗಳ ಸಂಖ್ಯೆಗೆ ಎಲೆಕ್ಟ್ರಾನುಗಳ ಸಂಖ್ಯೆ ಸಮವಾಗಿರದ ಕಾರಣಕ್ಕೆ ಅವು ಆವೇಶ ಪಡೆಯುತ್ತವೆ. ಅಣು ಅಥವಾ ಪರಮಾಣು ಅದರಲ್ಲಿನ ಪ್ರೋಟಾನುಗಳ ಸಂಖ್ಯೆ ಎಲೆಕ್ಟ್ರಾನುಗಳ ಸಂಖ್ಯೆಗಿಂತ ಹೆಚ್ಚು ಇದ್ದಾಗ ಧನ ಆವೇಶ ಮತ್ತು ಕಡಿಮೆ ಇದ್ದಾಗ ರುಣ (ಋಣ) ಆವೇಶ ಪಡೆಯುತ್ತದೆ. ಧನ ಆವೇಶ ಪಡೆದ ಅಯಾನನ್ನು ಧನ ಅಯಾನು ಮತ್ತು ರುಣ ಆವೇಶ ಪಡೆದ ಅಯಾನನ್ನು ರುಣ ಅಯಾನು ಎಂದು ಕರೆಯಲಾಗಿದೆ. ಅಯಾನು Na+ ನಲ್ಲಿದಂತೆ ಒಂದೇ ಪರಮಾಣು ಹೊಂದಿರ ಬಹುದು ಅಥವಾ OH-ನಂತೆ ಒಂದಕ್ಕಿಂತ ಹೆಚ್ಚು ಪರಮಾಣುಗಳನ್ನು ಹೊಂದಿರ ಬಹುದು.
ಆಮ್ಲಗಳು ನೀರಿನಲ್ಲಿ ಕರಗಿದಾಗ ಧನಾವೇಶ ಇರುವ H+ (ಜಲಜನಕ) ಅಯಾನು ಬಿಡುಗಡೆ ಮಾಡುತ್ತವೆ. ಆಮ್ಲಗಳು ಹೈಡ್ರೊಕ್ಲೋರಿಕ್ ಆಮ್ಲ (HCl), ಗಂಧಕಾಮ್ಲ ( H2SO4) ಗಳಂತೆ ಅಜೈವಿಕ ಆಮ್ಲಗಳಾಗಿರ ಬಹುದು ಅಥವಾ ಅಸಿಟಿಕ್ ಆಮ್ಲದಂತಹ (CH3CO2H) ಜೈವಿಕ ಆಮ್ಲಗಳಾಗಿರ ಬಹುದು. ಹಲವು ಆಮ್ಲಗಳು ನೀರಿನ ಇರುವಿಕೆಯಲ್ಲಿಯೇ ಆಮ್ಲೀಯ ಗುಣ ತೋರುತ್ತವೆ. ಆಮ್ಲಗಳು ಅವುಗಳ ತಿಂದುಹಾಕುವ (ಸಂಕ್ಷಾರಕತ್ವ ಅಥವಾ ಕೊರೊಸಿವ್) ಗುಣದ ಕಾರಣಕ್ಕೆ ಚರ್ಮವನ್ನು ಸುಡಬಲ್ಲವು, ಲೋಹವನ್ನು ಕರಗಿಸ ಬಲ್ಲವು. ಪ್ರತ್ಯಾಮ್ಲಗಳನ್ನು ನೀರಿನಲ್ಲಿ ಕರಗಿಸಿದಾಗ ರುಣಾವೇಶ ಇರುವ OH- (ಹೈಡ್ರಾಕ್ಸೈಡ್) ಅಯಾನು ಬಿಡುಗಡೆಯಾಗುತ್ತದೆ. ಪ್ರತ್ಯಾಮ್ಲಗಳು ಸಾಮಾನ್ಯವಾಗಿ ಲೋಹದ ಹೈಡ್ರಾಕ್ಸೈಡ್ಗಳು. ಸೋಡಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ (NaOH) ಮತ್ತು ಕ್ಯಾಲಿಸಿಯಂ ಹೈಡ್ರಾಕ್ಸೈಡ್ (Ca(OH)2) ಇದಕ್ಕೆ ಉದಾಹರಣೆಗಳು. ಇವು ನೀರನಲ್ಲಿ ಕರಗಿದಾಗ ಕ್ಷಾರಗಳು ಎಂದು ಕರೆಯಲಾಗುತ್ತದೆ. ಪ್ರತ್ಯಾಮ್ಲಗಳು ಮುಟ್ಟಿದರೆ ಸೋಪಿನಂತೆ ಭಾಸವಾಗುತ್ತದೆ ಮತ್ತು ಕೆಲವು ಕ್ಷಾರಗಳು ತಿಂದುಹಾಕುವ ಗುಣ ಹೊಂದಿವೆ.
ಆಮ್ಲೀಯತೆಯನ್ನು pH ಮೂಲಕ ಅಳೆಯಲಾಗುತ್ತದೆ ಮತ್ತು ಈ ಮಾನಕವು 1 ರಿಂದ 14ರವರೆಗೂ ಇದೆ. 1 pH ತೀರಾ ಹೆಚ್ಚಿನ ಆಮ್ಲತೆಯನ್ನು ಸೂಚಿಸುತ್ತವೆ. 7 pH ತಟಸ್ಥತೆಯನ್ನೂ ಮತ್ತು 14 pH ತೀರ ಹೆಚ್ಚು ಕ್ಷಾರತೆ (ಪ್ರತ್ಯಾಮ್ಲತೆ) ಸೂಚಿಸುತ್ತವೆ. ಕೆಲವು ರಸಾಯನಿಕಗಳು ಬೇರೆ ಬೇರೆ pH ಬೆಲೆಯಲ್ಲಿ ಬಣ್ಣ ಬದಲಿಸುತ್ತವೆ. ಅವುಗಳಲ್ಲಿ ಸಾಮಾನ್ಯವಾದುದು ಲಿಟ್ಮಸ್. ಇದು pH 7 ಕ್ಕಿಂತ ಕಡಿಮೆ (ಆಮ್ಲೀಯ) ಇದ್ದಲ್ಲಿ ಕೆಂಪು ಬಣ್ಣಕ್ಕೂ ಮತ್ತು pH 7ಕ್ಕಿಂತ ಹೆಚ್ಚು (ಪ್ರತ್ಯಾಮ್ಲೀಯ ಅಥವಾ ಕ್ಷಾರ) ಇದ್ದಲ್ಲಿ ನೀಲಿಗೂ ಬದಲಾಗುತ್ತದೆ. ಆಮ್ಲ ಮತ್ತು ಪ್ರತ್ಯಾಮ್ಲಗಳು ರಸಾಯನಿಕ ಕ್ರಿಯೆಗೆ ಒಳಗಾದಾಗ ಲವಣ ಉಂಟಾಗುತ್ತದೆ.
This article uses material from the Wikipedia ಕನ್ನಡ article ರಸಾಯನಶಾಸ್ತ್ರ, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). ವಿಶೇಷವಾಗಿ ಟಿಪ್ಪಣಿ ಮಾಡದಿದ್ದ ಹೊರತು ಪಠ್ಯ "CC BY-SA 4.0" ರಡಿ ಲಭ್ಯವಿದೆ. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki ಕನ್ನಡ (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.