Сірка: хімічний елемент з атомним номером 16
Сі́рка, су́льфур (лат.
sulfur, хімічний знак — ) — хімічний елемент з атомним номером 16, що належить до 16-ї групи, 3-го періоду періодичної системи хімічних елементів.
Проста речовина — сі́рка, неметал, жовта кристалічна речовина. Трапляється в природі в самородному стані та у вигляді сульфідів важких металів, піриту та інших. Сірку застосовують переважно у хімічній промисловості для виробництва сірчаної кислоти, синтетичного волокна, сірчистих барвників, димного пороху, у гумовій промисловості, також у сільському господарстві, фармацевтиці тощо.
Завдяки здатності створювати дисульфідні зв'язки, сірка виконує важливу роль у складі білків. Ртуть порушує ці зв'язки, тому вона є токсичною.
Історія
Елементарну природу сірки встановив Антуан Лавуазьє в своїх дослідах зі спалювання.
Загальна характеристика
Сірка має атомну масу 32,06. У природі існує 4 стабільних ізотопи з масовими числами 32-34 і 36. Науковцям вдалось отримати нестабільні ізотопи сірки з атомною масою 49.
Сірка належить до халькогенів, за новою класифікацією до 16-ї, а за старою до VI групи елементів періодичної таблиці. Сірка є неметалом.
Відомі кілька алотропних форм сірки. За звичайних умов стабільною є ромбічна сірка — блідо-жовтого кольору, з густиною 2070 кг/м³, tплав = 112,8 °С, tкип = 444,6 °С. У всіх рідких і твердих станах сірка діамагнітна. Термодинамічні та інші властивості сірки різко змінюються при 160 °C, що пов'язано зі зміною молекулярної будови рідкої сірки. В'язкість сірки з підвищенням температури сильно зростає (від 0,0065 Па•с при 155 °C до 93,3 Па•с при 187 °C), а потім падає (до 0,083 Па•с при 444,6 °C).
Сірка реагує майже з усіма металами.
Поширення в природі
Сірка — досить поширений елемент, на нього припадає близько 0,1 % маси земної кори. Середній вміст сірки в земній корі 4,7•10−2 мас. %, при цьому основна кількість природної сірки зосереджена в осадових гірських породах (0,3 мас. %). У інших гірських породах середній вміст сірки такий: дуніти, перидотити, піроксеніти — 0,01 %; базальти, габронорити, діабази — 0,03 %; діорити, андезити — 0,02 %.
В природі сірка зустрічається як у вільному стані — так звана самородна сірка, але значно частіше зустрічається в зв'язаному вигляді, тобто у вигляді різних сполук. Найважливіші з них — залізний колчедан, або пірит FeS2, цинкова обманка ZnS, свинцевий блиск PbS, мідний блиск Cu2S, гіпс CaSO4 · 2H2O, мірабіліт Na2SO4 ·10H2O тощо.
Сірка міститься в кам'яному вугіллі і нафті, а також в усіх рослинних і тваринних організмах, оскільки входить до складу білків.
Вміст сірки в нафті і природному газі оцінюється в 2•109 т, тобто більше, ніж запаси природної сірки. Сірка в нафті присутня у різній формі, від елементної сірки і сірководню до сірчистої органіки, що включає понад 120 сполук. Основні сірковмісні речовини вуглеводневої сировини — сірководень, меркаптани та інші сіркоорганічні сполуки. Сировинною базою для одержання сірки є, як правило, гази з вмістом сірководню не менше 0,1 %.
Зазвичай самородна сірка зустрічається суцільною масою, заповнюючи тріщини і порожнини в гірських породах, або у вигляді натічних, кулястих і гніздоподібних аґреґатів, сталактитів, сталагмітів, нальотів, вицвітів, землистих порошкуватих скупчень. Нерідко вона утворює кристали, які часто згруповуються в зростки, друзи, щітки.
Див. також Родовища самородної сірки.


Фізичні властивості


Сірка — кристалічна речовина жовтого кольору. Вона дуже крихка і легко розтирається в дрібнесенький порошок. Густина 2070 кг/м³. tплав = 112,8 °С, tкип = 444,6 °С. У всіх рідких і твердих станах сірка діамагнітна.
Зустрічається в трьох алотропних формах: дві кристалічні (ромбічна і моноклінна, за способом сполучення атомів у кристалі) і аморфна.
- α-S (ромбічна) кристалічна модифікація, tплав = 112,8 °C, стійка до 95,6 °C, лимонно-жовта;
- β-S кристалічна модифікація, tплав = 119 °C, стійка при 95,6-119 °C, медово-жовта. До 160 °C молекули 8-атомні, в парах — 2-атомні (парамагнітна сірка), 4-, 6-, і 8-атомні.
- Вище 160 °C утворюються спіральні ланцюги μ-S пластичної сірки.
Електричного струму і тепла сірка майже не проводить. Пари сірки при дуже швидкому охолодженні переходять у твердий стан у вигляді дуже тонкого порошку (сіркового цвіту), минаючи рідкий стан. У воді сірка не розчиняється і не змочується водою, але в бензолі C6H6 і особливо в сірковуглеці CS2 розчиняється добре.
Хімічні властивості
Маючи в зовнішньому шарі шість електронів: (+ 16), 2,8,6 — атоми сірки проявляють властивості окисника і, приєднуючи від атомів інших елементів два електрони, яких їм не вистачає до повністю заповненої зовнішньої оболонки, перетворюються в негативно двовалентні іони: S0 + 2е = S2-. Але сірка — менш активний окисник, ніж кисень, оскільки її валентні електрони віддаленіші від ядра атома і слабіше з ним зв'язані, ніж валентні електрони атомів кисню. На відміну від кисню сірка може проявляти властивості і відновника: S0 — 6e = S6+ або S0 — 4e = S4+. Відновні властивості сірки виявляються при взаємодії з сильнішим від нього окисником, тобто з речовинами, атоми яких мають більшу спорідненість до електрона.
Сірка може безпосередньо реагувати майже з усіма металами (за винятком благородних), але переважно при нагріванні. Так, якщо суміш порошків сірки й заліза нагріти хоч в одному місці, щоб почалася реакція, то далі вся суміш сама собою розжариться (за рахунок теплоти реакції) і перетвориться в чорну крихку речовину — моносульфід заліза:
- Fe + S = FeS
Суміш порошків сірки й цинку при підпаленні реагує дуже бурхливо, зі спалахом. Внаслідок реакції утворюється сульфід цинку:
- Zn + S = ZnS
Із ртуттю сірка реагує навіть при звичайній температурі. Так, при розтиранні ртуті з порошком сірки виникає чорна речовина — сульфід ртуті (ІІ):
- Hg + S = HgS
При високій температурі сірка реагує також з воднем з утворенням сірководню:
- H2 + S = H2S.
При взаємодії з металами і воднем сірка відіграє роль окисника, а сама відновлюється до іонів S2- Тому в усіх сульфідах сірка негативно двовалентний. Сірка порівняно легко реагує і з киснем. Так, підпалена сірка горить на повітрі з утворенням діоксиду сірки SO2 (сульфітного ангідриду) і в дуже незначній кількості триоксиду сірки SO3 (сульфатного ангідриду).
- S + O2 = SO2
- 2S + 3O2 = 2SO3
При цьому окисником є кисень, а сірка — відновником. У першій реакції атом сірки втрачає чотири, а в другій — шість валентних електронів, внаслідок чого сірки у сполуці SO2 позитивно чотиривалентний, а в SO3 — позитивно шестивалентний.
Сполуки сірки
Органічні похідні
Головними класами органічних похідних сірки є:
тіоли RSH, (їх ще називають меркаптанами),
тіоетери R-S-R',
сульфоксиди R-S(=O)-R',
похідні сульфатної кислоти R-O-SO2-O-R',
сірковмісні гетероциклічні сполуки.
- Приклади органічних сполук сірки
- (R)-Цистеїн, амінокислота що містить тіольну групу
- Метіонін, амінокислота що містить тіоетерну групу
- Дифеніл дисульфід, типова сполку з дисульфідним зв'язком
- Додецилсульфат натрію, детергент, що застосовується в багатьох мийних засобах
- Диметилсульфат, сильно канцерогенний метилюючий агент, приклад диестеру сульфурної кислоти
- Тозилхлорид, приклад сульфонілхлориду
- Диметилсульфоксид, полярний апротонний розчинник, приклад сульфоксиду
- Дибензотіофен, компонент сирої нафти, приклад сірковмісної ароматичної гетероциклічної сполуки
- Пеніцилін, антибіотик, приклад сірковмісної аліфатичної гетероциклічної сполуки
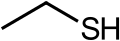
- Етантіол, сильнопахнуча речовина яку додають в природний газ для створення запаху
Сірка входить до складу білків, сірковмісних амінокислот (цистеїн, цистин, метионін), є складовою частиною сульфгідрильних груп (


Цистеїнвмісткі білки утворюють дисульфідні зв'язки, внаслідок чого змінюються їх конформація та біологічна функція. Для захисту таких білків у організмі існують та звані тіолові протектори: глутатіон 
Внаслідок великої спорідненості йонів срібла 

При процесах нагноєння рослинних й білкових речовин під дією мікроорганізмів утворюється сполука сірки — сірководень, який має запах гниючого білка й є дуже токсичним, оскільки є інгібітором ферменту цитохромоксидази (який переносить електрони у дихальному ланцюгу, зв'язуючи йони міді у її складі). Він блокує перенесення електронів з цитрохромоксидази на кисень. При вмісті у повітрі 
Одержання
Сірку одержують з самородних руд, а також у вигляді побічного продукту при переробці поліметалічних руд, з сульфатів при їх комплексній переробці, з природних газів і горючих копалин при їх очищенні. Частка сірки отримана з сірководню зростає. Для відокремлення сірки від сторонніх домішок її виплавляють в автоклавах. Автоклави — це залізні циліндри, в які завантажують руду і нагрівають перегрітим водяним паром до 150 °С під тиском 6 атмосфер. Розплавлена сірка стікає вниз, а пуста порода залишається. Виплавлена з руди сірка ще містить певну кількість домішок.
Цілком чисту сірку одержують перегонкою у спеціальних печах, сполучених з великими камерами. Пари сірки в холодній камері відразу переходять в твердий стан і осідають на стінках у вигляді дуже тонкого порошку ясно-жовтого кольору. Коли ж камера нагрівається до 120 °С, то пари сірки перетворюються в рідину. Розплавлену сірку розливають у дерев'яні циліндричні форми, де вона і застигає. Таку сірку називають черенковою.

Застосування
Сірка широко застосовується у різних галузях народного господарства, переважно у хімічній промисловості для виробництва сульфатної кислоти H2SO4 (майже половина сірки, що добувається в світі), сірковуглецю CS2, деяких барвників, і інших хімічних продуктів. Значні кількості сірки споживає гумова промисловість для вулканізації каучуку, тобто для перетворення каучуку в гуму.
Сірку використовують у хімічній промисловості при виробництві фосфорної, хлоридної та інших кислот, в ґумовій промисловості, виробництві барвників, димного пороху тощо. Самородну сірку використовують у сільському господарстві (інсектициди, мікродобрива, як дезінфекційний засіб у тваринництві).
Технічна сірка, що застосовується для виробництва сірчаної кислоти, повинна містити не менше 95 % сірки, арсену і селену не повинно бути зовсім, а вміст органічних речовин не повинен перевищувати 1 %. Виробництво штучного волокна (віскози) в хімічній промисловості є іншим споживачем сірки. У сільському господарстві сірку застосовують як засіб боротьби з шкідниками, частково як добриво, для дезінфекції при лікуванні тварин. У паперовому виробництві сірку у вигляді SO2 використовують при обробці деревної маси (бісульфатний метод). Сірка використовується при вулканізації гуми, у скляній, шкіряній промисловості. Незначні кількості сірки високої чистоти використовуються в хіміко-фармацевтичній промисловості. Сірку використовують також для виробництва ультрамарину. Текстильна, харчова, крохмальна і патокова галузі промисловості застосовують сірку або її сполуки для вибілювання і прояснення, при консервації фруктів, у холодильній справі.
Сірку використовують також у сірниковому виробництві, у піротехніці, у виробництві чорного пороху тощо. У медицині сірка йде для виготовлення сіркової мазі при лікуванні шкіряних хвороб. У сільському господарстві сірковий цвіт застосовують для боротьби зі шкідниками бавовнику й виноградної лози.
Безелектродний розряд у плазмі сірки випромінює потужне світло зі спектром, близьким до спектра сонячного світла, майже без інфрачервоної і ультрафіолетової складових. Це використовується в сірчаній лампі.
Вплив на людину
Сірчаний пил подразнює органи дихання, слизові оболонки. ГДК — 2 мг/м. куб. од
Див. також
Примітки
Література
- Глосарій термінів з хімії // Й. Опейда, О. Швайка. Ін-т фізико-органічної хімії та вуглехімії ім. Л. М. Литвиненка НАН України, Донецький національний університет. — Донецьк: Вебер, 2008. — 758 с. — ISBN 978-966-335-206-0
- Мала гірнича енциклопедія : у 3 т. / за ред. В. С. Білецького. — Д. : Східний видавничий дім, 2013. — Т. 3 : С — Я. — 644 с.
- Деркач Ф. А. Хімія. — Львів : Львівський університет, 1968. — 312 с.
Посилання
- Сірка // Універсальний словник-енциклопедія. — 4-те вид. — К. : Тека, 2006.
- СІРКА [Архівовано 3 серпня 2016 у Wayback Machine.] //Фармацевтична енциклопедія
- Сірка // Українська мала енциклопедія : 16 кн. : у 8 т. / проф. Є. Онацький. — Накладом Адміністратури УАПЦ в Аргентині. — Буенос-Айрес, 1965. — Т. 7, кн. XIV : Літери Сен — Сті. — С. 1748. — 1000 екз.
This article uses material from the Wikipedia Українська article Сірка, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Вміст доступний на умовах CC BY-SA 4.0, якщо не вказано інше. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Українська (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.