கந்தகம்: 16 ஆம் அணுவெண்ணைக் கொண்ட மூலகம்
கந்தகம் (ⓘ) (Sulphur) ஒரு தனிமம் ஆகும்.
இதன் குறியீடு S. இத்தனிமத்தின் அணு எண் 16. இது புவியில் மிகுந்து கிடைக்கும் சுவையற்ற அலோகம் ஆகும். கந்தகம் இயற்கையில் மஞ்சள் நிறப் படிகமாகக் கிடைக்கிறது. அழுகிய மணம் கொண்டது. இது இயற்கையில் தனிமம் ஆகவும் பல தனிமங்களோடு சேர்வதால் சல்பைடு, சல்பேட்டு கனிமங்களாகவும் கிடைக்கிறது. சாதாரண நிலையில் கந்தகம், S8 எனும் வேதி வாய்பாட்டையுடைய எண்ணணு வளைய சேர்மத்தை உண்டாக்குகிறது.
| கந்தகம் | |||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
16S | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| தோற்றம் | |||||||||||||||||||||||||||||||||||||
எலுமிச்சை மஞ்சள் நிறமான சிட்டங்கட்டப்பட்ட நுண்பளிங்குகள் கந்தகத்தின் நிறமாலைக்கோடுகள் | |||||||||||||||||||||||||||||||||||||
| பொதுப் பண்புகள் | |||||||||||||||||||||||||||||||||||||
| பெயர், குறியீடு, எண் | கந்தகம், S, 16 | ||||||||||||||||||||||||||||||||||||
| தனிம வகை | அலோகம் | ||||||||||||||||||||||||||||||||||||
| நெடுங்குழு, கிடை வரிசை, குழு | 16, 3, p | ||||||||||||||||||||||||||||||||||||
| நியம அணு நிறை (அணுத்திணிவு) | 32.065(5) | ||||||||||||||||||||||||||||||||||||
| இலத்திரன் அமைப்பு | [Ne] 3s2 3p4 2, 8, 6 | ||||||||||||||||||||||||||||||||||||
| வரலாறு | |||||||||||||||||||||||||||||||||||||
| கண்டுபிடிப்பு | சீனர் (Before 2000BC) | ||||||||||||||||||||||||||||||||||||
| Recognized as an element by | அந்துவான் இலவாசியே (1777) | ||||||||||||||||||||||||||||||||||||
| இயற்பியற் பண்புகள் | |||||||||||||||||||||||||||||||||||||
| நிலை | திண்மம் | ||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | (அல்பா) 2.07 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | (பீட்டா) 1.96 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| அடர்த்தி (அ.வெ.நிக்கு அருகில்) | (காம்மா) 1.92 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| திரவத்தின் அடர்த்தி உ.நி.யில் | 1.819 g·cm−3 | ||||||||||||||||||||||||||||||||||||
| உருகுநிலை | 388.36 K, 115.21 °C, 239.38 °F | ||||||||||||||||||||||||||||||||||||
| கொதிநிலை | 717.8 K, 444.6 °C, 832.3 °F | ||||||||||||||||||||||||||||||||||||
| மாறுநிலை | 1314 K, 20.7 MPa | ||||||||||||||||||||||||||||||||||||
| உருகலின் வெப்ப ஆற்றல் | (mono) 1.727 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||||||||
| வளிமமாக்கலின் வெப்ப ஆற்றல் | (mono) 45 கி.யூல்·மோல்−1 | ||||||||||||||||||||||||||||||||||||
| வெப்பக் கொண்மை | 22.75 யூல்.மோல்−1·K−1 | ||||||||||||||||||||||||||||||||||||
| ஆவி அழுத்தம் | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
| அணுப் பண்புகள் | |||||||||||||||||||||||||||||||||||||
| ஒக்சியேற்ற நிலைகள் | 6, 5, 4, 3, 2, 1, -1, -2 (வலுவான காடிய ஆக்சைடு) | ||||||||||||||||||||||||||||||||||||
| மின்னெதிர்த்தன்மை | 2.58 (பாலிங் அளவையில்) | ||||||||||||||||||||||||||||||||||||
| மின்மமாக்கும் ஆற்றல் (மேலும்) | 1வது: 999.6 kJ·mol−1 | ||||||||||||||||||||||||||||||||||||
| 2வது: 2252 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| 3வது: 3357 kJ·mol−1 | |||||||||||||||||||||||||||||||||||||
| பங்கீட்டு ஆரை | 105±3 pm | ||||||||||||||||||||||||||||||||||||
| வான்டர் வாலின் ஆரை | 180 பிமீ | ||||||||||||||||||||||||||||||||||||
| பிற பண்புகள் | |||||||||||||||||||||||||||||||||||||
| படிக அமைப்பு | orthorhombic | ||||||||||||||||||||||||||||||||||||
| காந்த சீரமைவு | diamagnetic | ||||||||||||||||||||||||||||||||||||
| மின்கடத்துதிறன் | (20 °C) (சீருறாத் திண்மம்) 2×1015 Ω·m | ||||||||||||||||||||||||||||||||||||
| வெப்ப கடத்துத் திறன் | (சீருறாத் திண்மம்) 0.205 W·m−1·K−1 | ||||||||||||||||||||||||||||||||||||
| பரும தகைமை | 7.7 GPa | ||||||||||||||||||||||||||||||||||||
| மோவின் கெட்டிமை (Mohs hardness) | 2.0 | ||||||||||||||||||||||||||||||||||||
| CAS எண் | 7704-34-9 | ||||||||||||||||||||||||||||||||||||
| மிக உறுதியான ஓரிடத்தான்கள் (சமதானிகள்) | |||||||||||||||||||||||||||||||||||||
| முதன்மைக் கட்டுரை: கந்தகம் இன் ஓரிடத்தான் | |||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||
கந்தகம் உயிர் வாழ்க்கைக்கு மிகவும் இன்றியமையாதது. அமினோ அமிலங்களிலும் இது காணப்படுகிறது. கந்தகம் தனிமமாக எரிமலைக் குழம்பு உறைந்த பாறைகளில் கிடைக்கிறது. வியாழனின் துணைக் கோளான அயோ(Io)வில் எரிமலையிலிருந்து வெளியேறிய கந்தகப் பொருட்கள் பல நூறு கிலோமீட்டர் தூரம் வரை உறைந்துள்ளது. அதனால் அது பிரகாசமான சிவப்பு, ஆரஞ்சு மற்றும் மஞ்சள் நிறத்திட்டுக்களைப் பெற்றுள்ளது. வெப்ப நீர் ஊற்றுக்களில் கந்தகம் சேர்ந்திருக்கிறது. பெட்ரோலிய எண்ணெய் மற்றும் எரி வளிமத்தோடு கலந்திருக்கிறது. இது வணிக நோக்கில், உரம், வெடிமருந்து, தீக்குச்சி, பூச்சிக் கொல்லி போன்றவற்றின் தயாரிப்பில் பயன்படுகிறது.
வரலாறு
கந்தகம் தனித்தும், சேர்மமாகவும் பூமியில் கிடைப்பதால் இதை வேதித் தனிமமாக அறிவதற்கு வெகு காலம் முன்பே மக்கள் இதைப் பயன்படுத்தத் தெரிந்திருந்தனர். கிரேக்கர்களும், ரோமர்களும் கந்தகத்தை புகை உண்டாக்கப் பயன்படுத்தினார்கள். வீட்டில் தொற்று நோய்க் கிருமிகளைக் கொல்ல இப்புகையை எழுப்பினார்கள். கார்பன் போல் வான வேடிக்கைப் பொருட்களில் இதைப் பயன்படுத்தியுள்ளனர். கந்தகம், கரித்தூள், சால்ட்பீட்டர்(Pottasium Nitrate) இவற்றை 1 :2 :6 என்ற விகிதத்தில் கலந்து துப்பாக்கிகளில் வெடிமருந்தாகப் பயன்படுத்தினர். இது இன்றைய சேர்மான விகிதத்திலிருந்து சிறிதே மாறுபட்டதாகும். கந்தகத்தின் தனித் தன்மையை அந்துவான் இலவாசியே தெரியப்படுத்தினார். சல்பர் என்ற பெயரின் மூலம் ‘சுல்வாரி’ என்ற வடமொழிச் சொல்லாகும். செம்பையும் கந்தகத்தையும் சேர்த்து சூடுபடுத்தும் போது செம்பு அழிகின்ற காரணத்தால் இதற்குச் 'செம்பின் எதிரி ' என்று பெயர் வைத்தனர். இது இலத்தீன் மொழியில் ‘சல்பூரியம்’ எனப் பெயர் மாற்றம் பெற்றது.
பண்புகள்

கந்தகம் , வெளிர் மஞ்சள் நிறம் கொண்ட, மணமற்ற, எளிதில் உடைந்து நொருங்கக் கூடிய திண்மமாகும். இது நீரில் கரைவதில்லை என்றாலும் கார்பன் டை சல்பைடில் கரைகிறது. S என்ற வேதிக் குறியீட்டுடன் கூடிய கந்தகத்தின் அணு எண் 16; அணு நிறை 32.06;அடர்த்தி 2070 கிகி/கமீ. இதன் உருகு நிலையும், கொதி நிலையும் முறையே 386 K(113 °C), 717.8 K(445 °C) ஆகும். கந்தகம் மின்சாரத்தையும், வெப்பத்தையும் மிகக் குறைவாகக் கடத்துகிறது. இது காற்று வெளியில் நீல நிற சுவாலையுடனும் ஆக்சிஜன் வெளியில் அவுரி நீல நிற சுவாலையுடனும் எரிந்து கந்தக டை ஆக்சைடு, கந்தக ட்ரை ஆக்சைடு போன்ற வளிமங்களை வெளியேற்றுகின்றது சூடு படுத்தினால் தங்கம், பிளாட்டினம் மற்றும் இருடியம் தவிர்த்த பிற உலோகங்களுடன் இணைகிறது. செம்பு, இரும்புடன் சேரும்போது சுடரொளி வீசுகிறது.
திண்ம, நீர்ம மற்றும் வளிம நிலைகளில் தனிமக் கந்தகம் பல வேற்றுருக்களைக் கொண்டுள்ளது. இது அதன் வடிவங்களில் பல்வேறு மாற்றங்களை ஏற்படுத்துவதற்குக் காரணமாக இருக்கிறது. சாய் சதுரமுகி அல்லது எண்முகி (Rhombic or octohedral) அல்லது ஆல்பா கந்தகம் என்ற வேற்றுருவைப் பெற கந்தகத்தைக் கார்பன் டை சல்பைடில் கரைத்து வடிகட்டி காற்றில் உலரவைத்துப் பெறுகின்றார்கள். இது வெளிர் மஞ்சள் நிறப் படிகமாகவும் 2060 கிகி/கமீ என்ற அளவில் அடர்த்தி கொண்டதாகவும் 112.8 °C உருகு நிலையும் கொண்டிருக்கிறது. இது அறை வெப்ப நிலையில் நிலையாக இருக்கிறது.
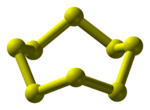
ஒற்றைச் சாய்வுடைய (monoclinic) அறுங்கோணமுகி (Prismatic) அல்லது பீட்டா கந்தகம் என்ற கந்தகத்தை அதன் உருகு நிலையில் உருக்கி புறப்பரப்பு உறையுமாறு குளிர்வித்து திண்மமாய் உறைந்த பகுதியில் ஒரு சிறிய துளையிட அதன் வழியாக வெளியேறுபடி செய்வார்கள். இது கொள்கலனின் சுவர்களில் ஊசிப் படிவுகளாகப் படியும். இதன் நிறம் சற்று அழுத்தமான மஞ்சளாக உள்ளது. அடர்த்தி சற்று குறைந்து 1960 கிகி/கமீ ஆகவும், உருகு நிலை சற்று அதிகரித்து 119.25 °C ஆகவும் உள்ளது.
நெகிழ்மக் கந்தகம் அல்லது காமாக் கந்தகம் இரப்பர் போன்ற தன்மையையும் ஒளி ஊடுருவிச் செல்லக் கூடிய தன்மையையும் கொண்டுள்ளது. கந்தகத்தை உயர் வெப்ப நிலைக்கு உருக்கி திடீரென்று குளிர் நீரில் குளிர்வித்து இதைப் பெறுகின்றார்கள். இதன் அடர்த்தி 1920 கிகி/கமீ. இது பிற கந்தக வேற்றுருக்களைப் போல கார்பன் டை சல்பைடில் கரைவதில்லை. நீண்ட நேர படு நிலைக்குப் பின் கந்தகம் ஒளிபுகாத, உடைந்து நொருங்கக் கூடிய வெளிர் மஞ்சள் நிறப் பொருளாக மாற்றமடைகின்றது. நெகிழ்மக் கந்தகம் கந்தகத்தின் உண்மையான வேற்றுரு இல்லை என்று சொல்வார்கள். படிக உருவமற்றவை(amorphous), மிதமக்கந்தகம்(colloidal) எனவும் கந்தகத்தை வேறுபடுத்தியுள்ளனர்.

கந்தகத்தின் சேர்மங்கள்
கந்தகம் பொதுவாக -2 முதல் +6 வரையிலான ஆக்சிசனேற்ற நிலைகளில் காணப்படுகிறது. மந்த வாயுக்களைத் தவிர மற்ற அனைத்து தனிமங்களுடனும் கந்தகம் நிலையான சேர்மங்களைக் கொடுக்கிறது. இலேசான ஆக்சிசனேற்றும் முகவர்கள் முன்னிலையில் கந்தகம் வலிமையான அமிலக் கரைசல்களுடன் வினைபுரிந்து பல கந்தக நேர்மின் அயனிகளை உற்பத்தி செய்கிறது. கந்தகத்தை ஒலியம் எனப்படும் புகையும் கந்தக அமிலத்தில் கரைத்தால் வண்ணக் கரைசல்கள் தோன்றுவதை 1804 ஆம் ஆண்டில் சி.எப். புச்சோல் கண்டறிந்து கூறினார். ஆனால் 1960 களின் பிற்பகுதியில் மட்டுமே சம்பந்தப்பட்ட பாலி கந்தக நேர்மின் அயனிகளின் நிறத்திற்கான காரணம் மற்றும் கட்டமைப்பு போன்றவை தீர்மானிக்கப்பட்டன. S82 + ஆழ்ந்த நீலம் என்றும் S42 + மஞ்சள் மற்றும் S162 + சிவப்பு என்றும் இறுதியாக்கப்பட்டன.
சல்பைடுகள்
கந்தகத்துடன் ஐதரசனை சேர்த்து வினைபுரியச் செய்தால் ஐதரசன் சல்பைடு தோன்றுகிறது. இது சற்று அமிலத்தன்மையை வெளிப்படுத்துகிறது.
- H2S
 HS− + H+
HS− + H+
ஐதரசன் சல்பைடு வாயுவும் ஐதரோசல்பைடு எதிர் மின்னயனியும் பாலூட்டிகளுக்கு அதிக நச்சுத்தன்மையை அளிப்பனவாக உள்ளன. ஏனெனில் இவை ஈமோகுளோபினின் ஆக்சிசன் கொண்டு செல்லும் திறனை தடை செய்கின்றன. இதே போல சயனைடுகளும் அசைடுகளும் சைட்டோகுரோம்களைத் தடை செய்கின்றன. தனிமநிலை கந்தகத்தை ஒடுக்குவதன் மூலம் பாலிசல்பைடுகள் உருவாகின்றன. இவை S− மையங்கள் நீக்கப்பட்ட கந்தக அணுக்களின் சங்கிலிகளைக் கொண்டுள்ளன.
- 2 Na + S8 → Na2S8
இவ்வினை கந்தகத்தின் தனிச் சிறப்புப் பண்பான தனக்குள் இணைந்து சங்கிலியாகும் பண்பை வெளிப்படுத்துகிறது. இப்பாலி சல்பைடுகளை புரோட்டானேற்றம் செய்வதால் பாலிசல்பேன்கள் தோன்றுகின்றன. H2Sx என்ற வாய்ப்பாடு கொண்ட இவற்றில் x = 2, 3, மற்றும் 4 என்ற மதிப்புகளைக் குறிக்கும். இறுதியில் கந்தகம் ஒடுக்கும் வினை மூலமாக சல்பைடு உப்புகளைக் கொடுக்கிறது.
- 16 Na + S8 → 8 Na2S
இந்த இனங்களின் இடையே நிகழும் இம்மாற்றம் சோடியம்-கந்தகம் மின்கலன்களில் பயன்படுத்தப்படுகிறது.
ஆக்சைடுகள், ஆக்சோ அமிலங்கள், ஆக்சோ எதிர்மின் அயனிகள்
கந்தகத்தை எரிப்பதால் முக்கியமான கந்தக ஆக்சைடுகள் தோன்றுகின்றன.
- S + O2 → SO2 (கந்தக டை ஆக்சைடு)
- 2 SO2 + O2 → 2 SO3 (கந்தக டிரை ஆக்சைடு)
கந்தகத்தின் பல ஆக்சைடுகள் அறியப்படுகின்றன. கந்தக மோனாக்சைடு, இருகந்தக மோனாக்சைடு, இருகந்தக ஈராக்சைடு மற்றும் உயர் ஆக்சைடுகளைக் கொண்டுள்ள பெராக்சோ குழுக்கள் உள்ளிட்டவை கந்தகத்தை மிகுதியாகக் கொண்ட ஆக்சைடுகள் ஆகும். கந்தக ஆக்சோ அமிலங்களாகவும் கந்தகம் உருவாகிறது. இவற்றில் சில அமிலங்களை தனித்துப் பிரிக்க இயலவில்லை. அவற்றை உப்புகளின் வழியாக மட்டுமே அறியமுடிகிறது. கந்தக டை ஆக்சைடும் சல்பேட்டுகளும் (SO2−3) கந்தச அமிலத்துடன் தொடர்பு கொண்டுள்ளன. கந்தக டிரை ஆக்சைடும் சல்பேட்டுகளும் (SO2−4) கந்தக அமிலத்துடன் தொடர்பு கொண்டுள்ளன. SO3 உடன் கந்தக அமிலம் சேர்ந்து ஒலியம் என்ப்படும் புகையிம் கந்தக அமிலம் உருவாகிறது. இது கந்தக அமிலத்தில் பைரோகந்தக அமிலம் (H2S2O7) கலந்த கரைசலாகும். கந்தகம் இரண்டு ஆக்சிசனேற்ற நிலைகளில் காணப்படும் தயோ சல்பேட்டு உப்புகள் சில சமயங்களில் ஐப்போசல்பைட்டுகள் எனப்படுகின்றன. இவை புகைப்படத் தொழிலில் நிலைநிறுத்திகளாகப் பயன்படுத்தப்படுகின்றன. சோடியம்டைதயோனேட்டில் (Na2S2O4) அதிகமாக ஒடுக்குகின்ற டை தயோனைட்டு (S2O2−4) எதிர்மின் அயனி இடம்பெற்றுள்ளது.
ஆலைடுகளும் ஆக்சி ஆலைடுகளும்
நவீன தொழிற்சாலைகளுக்கு கந்தக ஆலைடுகள் முக்கியமானவையாக உள்ளன. உயர் அழுத்த மின்மாற்றிகளில் கந்தக எக்சாபுளோரைடு மின்கடத்தா வாயுவாகப் பயன்படுத்தப்படுகிறது. மேலும், அழுத்தக் கொள்கலன்களிலும் இது வினைபுரியாப் பொருளாகவும் நச்சுத் தன்மை அற்ற உந்துபொருளாகவும் பயன்படுகிறது. கந்தக டெட்ரா புளோரைடு எனப்படும் உயர் நச்சு அரிதாகப் பயன்படுத்தப்படும் ஒரு கரிம முகவராகும். கந்தக டை குளோரைடும் இருகந்தக இருகுளோரைடும் முக்கியமான தொழிற்சாலை வேதிப் பொருட்களாகும். சல்பியூரைல் குளோரைடும் குளோரோகந்தக அமிலமும் கந்தக அமிலத்தினுடைய வழிப்பொருட்களாகும். தயோனைல் குளோரைடு (SOCl2) கரிமத் தொகுப்பு வினைகளில் ஒரு பொது முகவராகப் பயன்படுத்தப்படுகிறது.
நிக்நைட்டுகள்
முக்கியமான S–N சேர்மங்களில் ஒன்று டெட்ராகந்தக டெட்ரா நைட்ரைடு (S4N4) ஆகும். இச்சேர்மத்தை சூடாக்குவதால் கந்தக நைட்ரைடு ((SN)x) பலபடி தோன்றுகிறது. எந்த உலோக அணுக்களையும் கொண்டிருக்காவிட்டாலும் கூட இது உலோகப் பண்புகளைக் கொண்டுள்ளது. தயோசயனேட்டுகள் SCN− குழுவைக் கொண்டுள்ளன. தயோசயனேட்டை ஆக்சிசனேற்றம் செய்தால் NCS-SCN இணைப்புடனான தயோசயனோசன் (SCN)2 உருவாகிறது. பாசுபரசு சல்பைடுகளும் எண்ணற்ற அளவில் காணப்படுகின்றன. P4S10 மற்றும் P4S3 என்பவை இரண்டும் வணிக முக்கியத்துவம் கொண்டவையாகும்.
பயன்கள்


கந்தகம் துப்பாக்கி வெடி மருந்தாகவும், இயற்கை இரப்பரைக் கடினப்படுத்தும் வழி முறையில் ஒரு வேதிப் பொருளாகவும், புகைப் படலத்தை ஏற்படுத்தி போராட்டக் கும்பலைக் கலைக்கவும் பயன் படுகின்றது.
கந்தக அமிலம், சல்பேட் உரங்கள் தயாரிப்பில் கந்தகத்தின் பங்களிப்பு குறிப்பிடத்தக்கது. வறண்ட பழங்களை வெண்மையூட்டுவதற்கும், வானவேடிக்கைக்கான வெடி பொருட்களைத் தயாரிப்பதற்கும், தீக்குச்சிகளை உற்பத்தி செய்வதற்கும் பயன்படுகிறது.
கால்சியம் பை சல்பைட்டை மரக் கூழ்களை வெண்மையூட்டுவதற்குப் பயன்படுத்துகிறார்கள். பூஞ்சனம் படர்வதை கந்தகம் மட்டுப்படுத்துகிறது. அதனால் மருந்து தயாரிக்கும் வழி முறையில் இது பெரிதும் நன்மை பயக்கிறது.
மரத்தாலான பொருட்களைப் பாதுகாக்க மலிவான சாயங்களை கந்தகத்தைக் கொண்டு தயாரித்து பயன்படுத்துகிறார்கள்.
கந்தகம் உயிர்ப் பொருட்களின் வளர்ச்சிக்குத் தேவையானதாக உள்ளது. ஒவ்வொரு உயிர்ச் செல்லிலும் குறிப்பாக தோல், நகம் மற்றும் முடிகளில் கந்தகம் உள்ளது சைஸ்டைன்(cysteine)மற்றும் மெத்தியோனைன் (Methionine)போன்ற கந்தகம் அடங்கிய அமினோ அமிலங்கள் மூலமாக புரத உணவுப் பொருட்களிலிருந்து கந்தகத்தை உடல் பெறுகிறது.
பி வைட்டமின்களில் (தையமின், பண்டோதினிக் மற்றும் பயோட்டின்) கந்தகம் உள்ளடங்கி இருக்கிறது. வெங்காயம், வெள்ளைப் பூண்டில் கந்தகம் ஓரளவு அடங்கி இருக்கிறது.
கந்தகத்தின் முக்கியமானதொரு வர்த்தகப் பயன் இரப்பரை வலுவூட்டுவதாகும் (vulcanization ). இரப்பர் மூலக்கூறுகள் கந்தக அணுக்களைக் கவரும் தன்மை கொண்டன. இரப்பரின் கடினத் தன்மை அதில் சேர்க்கப்படும் கந்தகத்தின் அளவைப் பொறுத்தது. கூடுதல் வலிமையுடைய இரப்பர் மீள்திறன் மிக்கதாக இருப்பதால் பேருந்து, மகிழுந்து, விமானம், இராணுவ வண்டிகள், கனரக வண்டிகள் இவற்றிற்கான சக்கரங்கள் செய்யப் பயன்படுகிறது .
மேற்கோள்களும் குறிப்புகளும்
புற இணைப்புகள்
- Sulfur at The Periodic Table of Videos (University of Nottingham)
- Atomic Data for Sulfur, NIST Physical Measurement Laboratory
- Sulfur phase diagram பரணிடப்பட்டது 2010-02-23 at the வந்தவழி இயந்திரம், Introduction to Chemistry For Ages 13–17
- Crystalline, liquid and polymerization of sulfur on Vulcano Island, Italy
- Sulfur and its use as a pesticide
- The Sulphur Institute
- Nutrient Stewardship and The Sulphur Institute பரணிடப்பட்டது 2014-07-14 at the வந்தவழி இயந்திரம்
This article uses material from the Wikipedia தமிழ் article கந்தகம், which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). வேறுவகையாகக் குறிப்பிடப்பட்டிருந்தாலன்றி இவ்வுள்ளடக்கம் CC BY-SA 4.0 இல் கீழ் கிடைக்கும். Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki தமிழ் (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.