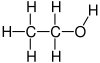
Етанол: вид алкохолно соединение
Етанол (скрат.
EtOH; исто така наречен етил алкохол, зрнест алкохол, алкохол за пиење, или едноставно алкохол) е органско соединение. Тоа е алкохол со хемиска формула C
2H
6O. Неговата формула може да се напише и како CH
3–CH
2–OH или C
2H
5OH (етил група поврзана со хидроксилна група). Етанолот е испарлива, запалива, безбојна течност со карактеристичен мирис на вино и лут вкус. Тоа е психоактивна рекреативна дрога и активна состојка во алкохолните пијалаци.
| |||
| |||
 | |||
Претпочитано име по МСЧПХ: Етанол | |||
Други називи апсолутен алкохол | |||
| Назнаки | |||
|---|---|---|---|
| 64-17-5 | |||
| 3DMet | B01253 | ||
| Бајлштајн | 1718733 | ||
| ChEBI | CHEBI:16236 | ||
| ChEMBL | ChEMBL545 | ||
| ChemSpider | 682 | ||
| DrugBank | DB00898 | ||
Гмелин | 787 | ||
IUPHAR/BPS | 2299 | ||
| 3Д-модел (Jmol) | Слика | ||
| KEGG | C00469 | ||
| PubChem | 702 | ||
| |||
| UNII | 3K9958V90M | ||
| ОН-бр. | UN 1170 | ||
| Својства | |||
| Хемиска формула | |||
| Моларна маса | 0 g mol−1 | ||
| Изглед | Безбојна течност | ||
| Мирис | како вино, остар | ||
| Густина | 0,78945 g/cm3 (at 20 °C) | ||
| Точка на топење | |||
| Точка на вриење | |||
| Miscible | |||
| log P | −0,18 | ||
| Парен притисок | 5,95 kPa (at 20 °C) | ||
| Киселост (pKa) | 15,9 (H2O), 29,8 (DMSO) | ||
Магнетна чувствителност (χ) | −33,60·10−6 cm3/mol | ||
| Показател на прекршување (nD) | 1,3611 | ||
| Вискозност | 1,2 mPa·s (at 20 °C), 1,074 mPa·s (at 25 °C) | ||
| Диполен момент | 1,69 D | ||
| Опасност | |||
| GHS-ознаки: | |||
Пиктограми |   | ||
Сигнални зборови | Опасност | ||
Изјави за опасност | H225, H319 | ||
Изјави за претпазливост | P210, P233, P240, P241, P242, P305+P351+P338 | ||
| NFPA 704 | |||
| Температура на запалување | {{{value}}} | ||
| Смртоносна доза или концентрација: | |||
LD50 (средна доза) | 7340 mg/kg (орално, стаорец) 7300 mg/kg (глушец) | ||
| NIOSH (здравствени граници во САД): | |||
PEL (дозволива) | TWA 1000 ppm (1900 mg/m3) | ||
REL (препорачана) | TWA 1000 ppm (1900 mg/m3) | ||
IDLH (непосредна опасност) | N.D. | ||
| Безбедносен лист | |||
| Дополнителни податоци | |||
| Освен ако не е поинаку укажано, податоците се однесуваат на материјалите во нивната стандардна состојба (25 °C, 100 kPa) | |||
| Наводи | |||
Етанолот природно се произведува со процесот на ферментација на шеќери со квасец или преку петрохемиски процеси како што е хидратација на етилен. Историски се користел како општ анестетик и има современи медицински примени како антисептик, средство за дезинфекција, растворувач за некои лекови и противотров за труење со метанол и труење со етилен гликол. Се користи како хемиски растворувач и во синтезата на органски соединенија и како извор на гориво. Етанолот, исто така, може да се дехидрира за да се направи етилен, важна хемиска суровина. Од 2006 година, светското производство на етанол беше 51 гигалитар, главно од Бразил и САД.
Етимологија
Етанол е систематско име дефинирано од страна на Меѓународната унија за чиста и применета хемија за соединение кое се состои од алкилна група со два јаглеродни атоми (префикс „ет-“), кои имаат единечна врска меѓу нив (инфикс „-ан-“) и приложена −OH функционална група (наставка „-ол“).
Префиксот „ет-“ и квалификаторот „етил“ во „етил алкохол“ првично потекнуваат од името „етил“ доделено во 1834 година на групата C2H5− од Јустус Либиг. Тој го измислил зборот од германското име Етер од соединението C2H5−O−C2H5 (на англиски најчесто се нарекува „етер“, поконкретно наречен „диетил етер“). Според Оксфордскиот англиски речник, етил е контракција на старогрчкиот αἰθήρ (aithḗr, „горен воздух“) и грчкиот збор ὕλη (hýlē, „супстанција“).
Името етанол е измислено како резултат на резолуцијата за именување на алкохоли и феноли која беше усвоена на Меѓународната конференција за хемиска номенклатура што се одржа во април 1892 година во Женева, Швајцарија.
Терминот алкохол сега се однесува на поширока класа на супстанции во номенклатурата на хемијата, но во вообичаениот јазик останува името на етанол. Тоа е средновековен заем од арапски ал-кухл, прашкаста руда на антимон што се користела уште од антиката како козметика и го задржала тоа значење на среднолатинскиот. Употребата на „алкохол“ за етанол (во целост, „алкохол од вино“) е модерна и за прв пат е забележана во 1753 година.
Употреба
Медицина
Анестетик
Етанолот е најстариот познат седатив, кој се користел како орален општ анестетик за време на операцијата во античка Месопотамија и во средниот век. Благата интоксикација започнува со концентрација на алкохол во крвта од 0,03 - 0,05 % и индуцира анестетичка кома на 0,4 %. Сепак, оваа употреба носеше висок ризик од смртоносна алкохолна интоксикација и пулмонална аспирација при повраќање, што доведе до употреба на алтернативи во антиката, како што се опиумот и канабисот, а подоцна и диетил етер почнувајќи од 1840-тите.
Антисептик
Етанолот се користи во медицински марамчиња и најчесто во антибактериски гелови за дезинфекција на раце како антисептик поради неговите бактерицидни и антигабични ефекти. Етанолот ги убива микроорганизмите со растворање на нивниот мембрански липиден двослој и денатурирање на нивните белковини и е ефикасен против повеќето бактерии, габи и вируси. Сепак, тој е неефикасен против бактериски спори, но тоа може да се ублажи со користење на водород пероксид. Растворот од 70 % етанол е поефикасен од чистиот етанол бидејќи етанолот се потпира на молекулите на водата за оптимална антимикробна активност. Апсолутниот етанол може да ги инактивира микробите без да ги уништи бидејќи алкохолот не може целосно да навлезе во мембраната на микробот. Етанолот може да се користи и како средство за дезинфекција и антисептик бидејќи предизвикува дехидрација на клетките со нарушување на осмотската рамнотежа низ клеточната мембрана, па водата ја напушта клетката што доведува до клеточна смрт.
Противотров
Етанолот може да се администрира како противотров за труење со етилен гликол и труење со метанол. Етанолот служи за овој процес со тоа што делува како конкурентен инхибитор против метанолот и етилен гликолот за алкохол дехидрогеназа. Иако има повеќе несакани ефекти, етанолот е поевтин и полесно достапен од фомепизолот, кој исто така се користи како противотров за труење со метанол и етилен гликол.
Медицински растворувач
Етанолот, често во високи концентрации, се користи за растворање на многу лекови нерастворливи во вода и сродни соединенија. Течните препарати од лекови против болки, лекови за кашлица и настинки и миење уста, на пример, може да содржат до 25 % етанол и можеби треба да се избегнуваат кај лица со несакани реакции на етанол, како што се респираторните реакции предизвикани од алкохол. Етанолот е присутен главно како антимикробен конзерванс во преку 700 течни препарати на лекови, вклучувајќи ацетаминофен, додатоци на железо, ранитидин, фуросемид, манитол, фенобарбитал, триметоприм/сулфаметоксазол и лекови против кашлица без рецепт.
Фармакологија
Кај цицачите, етанолот примарно се метаболизира во црниот дроб и желудникот преку ензимите на алкохол дехидрогеназа (ADH). Овие ензими ја катализираат оксидацијата на етанолот во ацеталдехид (етанал):
- CH3CH2OH + NAD+ → CH3CHO + NADH + H+
Кога е присутен во значителни концентрации, овој метаболизам на етанол е дополнително потпомогнат од ензимот CYP2E1 на цитохром P450 кај луѓето, додека трагите исто така се метаболизираат со каталаза.
Добиениот меѓупроизвод, ацеталдехид, е познат канцероген и претставува значително поголема токсичност кај луѓето од самиот етанол. Многу од симптомите типично поврзани со интоксикација со алкохол - како и многу од здравствените опасности типично поврзани со долгорочното консумирање на етанол - може да се припишат на токсичноста на ацеталдехид кај луѓето.
Последователната оксидација на ацеталдехидот во ацетат се изведува со ензими на алдехид дехидрогеназа (ALDH). Мутација во генот ALDH2 што кодира за неактивна или дисфункционална форма на овој ензим влијае на приближно 50 % од популациите во источна Азија, придонесувајќи за карактеристичната реакција на црвенило на алкохол што може да предизвика привремено црвенило на кожата, како и голем број сродни и често непријатни симптоми на токсичност од ацеталдехид. Оваа мутација е типично придружена со друга мутација на ензимот на алкохол дехидрогеназа ADH1B кај приближно 80 % од источните Азијци, што ја подобрува каталитичката ефикасност на конвертирањето на етанолот во ацеталдехид.
Рекреација
Како депресив на централниот нервен систем, етанолот е еден од најчесто консумираните психоактивни дроги.
И покрај психоактивните и канцерогени својства на алкохолот, тој е лесно достапен и легален за продажба во повеќето земји. Сепак, постојат закони кои ја регулираат продажбата, извозот/увозот, оданочувањето, производството, потрошувачката и поседувањето на алкохолни пијалоци. Највообичаена регулатива е забраната за малолетници.
Гориво

Моторно гориво
| Тип на гориво | MJ/L | MJ/kg | Истражување октански број |
|---|---|---|---|
| Суво дрво (20% влага) | ~19.5 | ||
| Метанол | 17.9 | 19.9 | 108.7 |
| Етанол | 21.2 | 26.8 | 108.6 |
| E85 (85% етанол, 15% бензин) | 25.2 | 33.2 | 105 |
| Течен природен гас | 25.3 | ~55 | |
| Автогас (ТНГ) (60% пропан + 40% бутан) | 26.8 | 50 | |
| Воздухопловен бензин (бензин со високи октани, не авионско гориво) | 33.5 | 46.8 | 100/130 (слаб/богат) |
| Гасохол (90% бензин + 10% етанол) | 33.7 | 47.1 | 93/94 |
| Обичен бензин | 34.8 | 44.4 | min. 91 |
| Премиум бензин | max. 104 | ||
| Дизел | 38.6 | 45.4 | 25 |
| Јаглен, екструдиран | 50 | 23 |
Најголемата поединечна употреба на етанол е како гориво на моторот и како додаток на горивото. Бразил особено се потпира на употребата на етанол како гориво за моторот, делумно поради неговата улога како еден од водечките светски производители на етанол. Бензинот што се продава во Бразил содржи најмалку 25 % безводен етанол. Водниот етанол (околу 95 % етанол и 5 % вода) може да се користи како гориво во повеќе од 90 % од новите автомобили на бензин што се продаваат во земјата.
САД и многу други земји првенствено користат Е10 (10 % етанол, понекогаш познат како газохол) и Е85 (85 % етанол) етанол/бензин мешавини. Со текот на времето, се верува дека материјалниот дел од ≈150 милијарди американски галони (570.000.000 m3) годишно за бензин ќе почне да се заменува со етанол за гориво.

Австралискиот закон ја ограничува употребата на чист етанол од отпадот од шеќерна трска на 10 % во автомобилите. Кај постарите автомобили (и старите автомобили дизајнирани да користат гориво што гори побавно) треба да ги надградат или заменат вентилите на моторот.
Според група за застапување во индустријата, етанолот како гориво ги намалува штетните емисии на јаглерод моноксид, честички, оксиди на азот и други загадувачи кои формираат озон. Националната лабораторија Argonne ги анализирала емисиите на стакленички гасови на многу различни комбинации на мотори и горива и открила дека мешавината на биодизел/петродизел (B20) покажала намалување од 8 %, конвенционалната мешавина од етанол E85 намалување од 17 % и целулозниот етанол за 64 %, во споредба со чистиот бензин. Етанолот има многу поголем истражувачки октански број (RON) од бензинот, што значи дека е помалку склон кон предзапалување, што овозможува подобро напредување на палењето што значи поголем вртежен момент и ефикасност покрај помалите емисии на јаглерод.
Согорувањето на етанол во мотор со внатрешно согорување дава многу производи од нецелосно согорување произведени од бензин и значително поголеми количества формалдехид и сродни видови како што е ацеталдехидот. Ова води до значително поголема фотохемиска реактивност и повеќе озон на нивото на земјата. Овие податоци се собрани во извештајот за чисти горива за споредба на емисиите на гориво и покажуваат дека издувните гасови од етанол создаваат 2,14 пати повеќе озон од издувните гасови на бензинот. Кога ова ќе се додаде во прилагодениот индекс на локализирано загадување (LPI) на Извештајот за чисти горива, локалното загадување со етанол (загадување кое придонесува за смог) е оценето со 1,7, каде што бензинот е 1,0, а повисоките бројки значат поголемо загадување. Одборот за воздушни ресурси на Калифорнија го формализираше ова прашање во 2008 година со признавање на контролните стандарди за формалдехидите како група за контрола на емисиите, слично како конвенционалните NOx и реактивни органски гасови (ROGs).
Повеќе од 20 % од бразилските автомобили можат да користат 100 % етанол како гориво, што вклучува мотори само со етанол и мотори со флексибилно гориво. Моторите со флекс гориво во Бразил можат да работат целосно со етанол, целосно со бензин или која било мешавина од двете. Во САД возилата со флексибилно гориво можат да работат на 0 % до 85 % етанол (15 % бензин), бидејќи мешавините со повисок етанол сè уште не се дозволени или ефикасни. Бразил ја поддржува оваа флота на автомобили што горат етанол со голема национална инфраструктура која произведува етанол од домашна шеќерна трска.
Високата спојливост на етанолот со вода го прави несоодветен за транспорт преку модерни цевководи како што се течните јаглеводороди. Механичарите забележале зголемени случаи на оштетување на малите мотори (особено, карбураторот) и штетата ја припишуваат на зголеменото задржување на водата од етанолот во горивото.
Ракетно гориво
Етанолот вообичаено се користел како гориво во раните бипропелантни ракетни возила (со течен погон), во врска со оксидатор како што е течниот кислород. Германската балистичка ракета А-4 од Втората светска војна (попозната по своето пропагандно име V-2), за која се смета дека го започнала вселенското доба, користела етанол како главен составен дел на B-Stoff. Според таквата номенклатура, етанолот се мешал со 25 % вода за да се намали температурата на комората за согорување. Дизајнерскиот тим на V-2 помогна да се развијат американски ракети по Втората светска војна, вклучувајќи ја и ракетата Редстоун со етанол, која го лансираше првиот американски сателит. Алкохолите паднаа во општа неупотреба бидејќи беа развиени повеќе енергетски густи ракетни горива, [63] иако етанолот моментално се користи во лесните тркачки авиони со ракетен погон.
Горивни ќелии
Комерцијалните горивни ќелии работат на реформиран природен гас, водород или метанол. Етанолот е атрактивна алтернатива поради неговата широка достапност, ниска цена, висока чистота и мала токсичност. Постои широк спектар на концепти за горивни ќелии кои се навлезени во испитувања, вклучувајќи горивни ќелии со директен етанол, системи со авто-термичко реформирање и термички интегрирани системи. Поголемиот дел од работата се спроведува на ниво на истражување, иако има голем број организации на почетокот на комерцијализацијата на горивни ќелии со етанол.
Греење и готвење на домаќинството
Камините со етанол може да се користат за затоплување на домот или за украсување. Етанолот може да се користи и како гориво за шпоретот за готвење.
Суровина
Етанолот е важна индустриска состојка. Има широка употреба како прекурсор за други органски соединенија како што се етил халиди, етил естри, диетил етер, оцетна киселина и етил амини.
Растворувач
Етанолот се смета за универзален растворувач, бидејќи неговата молекуларна структура овозможува растворање на поларни, хидрофилни и неполарни, хидрофобни соединенија. Бидејќи етанолот има и ниска точка на вриење, лесно се отстранува од растворот што се користел за растворање на други соединенија, што го прави популарно средство за екстракција за ботанички масла. Методите за екстракција на маслото од канабис често користат етанол како растворувач за екстракција и исто така како растворувач по обработката за отстранување на маслата, восоците и хлорофилот од растворот во процес познат како зимирање.
Етанолот се наоѓа во боите, тинктурите, маркерите и производите за лична нега, како што се средствата за плакнење на уста, парфемите и дезодорансите. Полисахаридите се таложат од воден раствор во присуство на алкохол, а таложењето со етанол се користи поради оваа причина за прочистување на ДНК и РНК.
Течност со ниска температура
Поради неговата ниска точка на замрзнување од -114 °C (-173 °F) и малата токсичност, етанолот понекогаш се користи во лаборатории (со сув мраз или други средства за ладење) како бања за ладење за да ги одржува садовите на температури под точката на замрзнување на водата. Од истата причина, се користи и како активна течност во алкохолните термометри.
Хемија
Хемиска формула
Етанолот е 2-јаглероден алкохол. Неговата молекулска формула е CH3CH2OH. Алтернативна ознака е CH3−CH2−OH,што покажува дека јаглеродот на метил групата (CH3−) е прикачен на јаглеродот на метиленската група (−CH2–), која е прикачена на кислородот од хидроксилната група (− OH). Тоа е конституционален изомер на диметил етер. Етанолот понекогаш се пишува скратено како EtOH, користејќи ја вообичаената ознака во органска хемија за претставување на етил групата (C2H5−) со Et.
Физички својства

Етанолот е испарлива, безбојна течност која има благ мирис. Гори со безчаден син пламен кој не е секогаш видлив при нормална светлина. Физичките својства на етанолот произлегуваат првенствено од присуството на неговата хидроксилна група и краткиот јаглероден синџир. Хидроксилната група на етанол е способна да учествува во водородното поврзување, што го прави повеќе вискозен и помалку испарлив од помалку поларните органски соединенија со слична молекуларна тежина, како што е пропанот.
Температурата на адијабатски пламен на етанолот за согорување во воздухот е 2082 °C или 3779 °F.
Етанолот е малку порефрактивен од водата, со индекс на рефракција од 1.36242 (на λ=589.3 nm и 18.35 °C (65.03 °F)). Тројната точка за етанолот е 150 K на притисок од 4.3 × 10−4 Pa.
Одлики на растворувач
Етанолот е разновиден растворувач, кој се меша со вода и со многу органски растворувачи, вклучувајќи оцетна киселина, ацетон, бензен, јаглерод тетрахлорид, хлороформ, диетил етер, етилен гликол, глицерол, нитрометан, пиридин и толуен. Неговата главна употреба како растворувач е во правењето тинктура од јод, сирупи за кашлица итн. Исто така, се меша со лесни алифатични јаглеводороди, како што се пентан и хексан, и со алифатични хлориди како што се трихлороетан и тетрахлороетилен.
Мешаливоста на етанолот со вода е во контраст со немешаливоста на алкохолите со подолг синџир (пет или повеќе јаглеродни атоми), чија мешливост со вода нагло се намалува како што се зголемува бројот на јаглероди. Мешаливоста на етанолот со алканите е ограничена на алкани до удекан: мешавините со додекан и повисоки алкани покажуваат јаз на мешање под одредена температура (околу 13 °C за додекан). Јазот за мешање има тенденција да станува поширок со повисоки алкани, а температурата за целосно мешање се зголемува.
Мешавините етанол-вода имаат помал волумен од збирот на нивните поединечни компоненти во дадените фракции. Мешањето на еднакви количини на етанол и вода резултира со само 1,92 зафатнинска смеса. Мешањето на етанол и вода е егзотермно, до 777 J/mol што се ослободува на 298 K.
Мешавините на етанол и вода формираат азеотроп на околу 89 % етанол (количествен удел) и 11 % вода (количествен удел) или мешавина од 95,6% етанол (масен удел) или околу 97% алкохол (зафатнински удел) при нормален притисок, која врие на 351 K (78 °C). Овој азеотропен состав е силно зависен од температурата и притисокот и исчезнува на температури под 303 K.

Водородното поврзување предизвикува чистиот етанол да биде хигроскопен до степен до кој лесно ја апсорбира водата од воздухот. Поларната природа на хидроксилната група предизвикува етанолот да раствори многу јонски соединенија, особено натриум и калиум хидроксид, магнезиум хлорид, калциум хлорид, амониум хлорид, амониум бромид и натриум бромид. Натриум и калиум хлоридот се малку растворливи во етанол. Бидејќи молекулата на етанол има и неполарен крај, таа исто така ќе раствори неполарни супстанции, вклучувајќи ги повеќето есенцијални масла и бројни ароми, бои и лековити средства.
Додавањето дури и неколку проценти етанол во водата нагло го намалува површинскиот напон на водата. Ова својство делумно го објаснува феноменот „солзи од вино“. Кога виното се врти во чаша, етанолот брзо испарува од тенкиот слој вино на ѕидот на чашата. Како што се намалува содржината на етанол во виното, неговата површинска напнатост се зголемува и тенкиот слој се „збива“ и поминува низ чашата во канали наместо како мазен лист.
Запаливост
Растворот на етанол-вода ќе се запали ако се загрее над температура наречена точка на палење и потоа се примени извор на пламен на него. За 20 % алкохол масен удел (околу 25 % зафатнински удел), тоа ќе се случи на околу 25 °C (77 °F). Точката на палење на чистиот етанол е 13 °C (55 °F), но може да биде многу мало под влијание на атмосферскиот состав како што се притисокот и влажноста. Етанолните смеси може да запалат под просечна собна температура. Етанолот се смета за запалива течност (опасен материјал од класа 3) во концентрации над 2,35 %масен удел (3,0% волуменси удел).
| Етанол масен удел, % | Температура | |
|---|---|---|
| °C | °F | |
| 1 | 84.5 | 184.1 |
| 2 | 64 | 147 |
| 2.35 | 60 | 140 |
| 3 | 51.5 | 124.7 |
| 5 | 43 | 109 |
| 6 | 39.5 | 103.1 |
| 10 | 31 | 88 |
| 20 | 25 | 77 |
| 30 | 24 | 75 |
| 40 | 21.9 | 71.4[се бара извор] |
| 50 | 20 | 68 |
| 60 | 17.9 | 64.2[се бара извор] |
| 70 | 16 | 61 |
| 80 | 15.8 | 60.4 |
| 90 | 14 | 57 |
| 100 | 12.5 | 54.5 |
Јадењата кои користат запален алкохол за кулинарски ефекти се нарекуваат flambé.
Природна појава
Етанолот е нуспроизвод на метаболичкиот процес на квасецот. Како таков, етанолот ќе биде присутен во секое живеалиште на квасецот. Етанолот најчесто може да се најде во презреено овошје. Етанолот произведен од симбиотски квасец може да се најде во бертамските палми. И покрај тоа што некои животински видови, како што е шушкава, покажуваат однесувања кои бараат етанол, повеќето не покажуваат интерес или избегнуваат извори на храна што содржат етанол. Етанолот се произведува и при `ртење на многу растенија како резултат на природна анаеробиоза. Етанолот е откриен во вселената, формирајќи ледена обвивка околу зрната прашина во меѓуѕвездените облаци. Минутни количини (просечни 196 ppb) на ендоген етанол и ацеталдехид беа пронајдени во издишениот здив на здрави доброволци. Синдромот на авто-пиварница, исто така познат како синдром на цревна ферментација, е ретка медицинска состојба во која опојните количини на етанол се произведуваат преку ендогена ферментација во дигестивниот систем.
Производство

Етанолот се произведува и како петрохемија, преку хидратација на етилен и преку биолошки процеси, со ферментирање на шеќери со квасец. Кој процес е поекономичен зависи од преовладувачките цени на резервите на нафта и житна храна.
Извори
Светското производство на етанол во 2006 година беше 51 гигалитар, со 69 % од светската понуда која доаѓа од Бразил и САД. Бразилскиот етанол се произведува од шеќерна трска, која има релативно високи приноси (830 % повеќе гориво од фосилните горива што се користат за негово производство) во споредба со некои други енергетски култури. Шеќерната трска не само што има поголема концентрација на сахароза од пченката (за околу 30 %), туку и многу полесно се вади. Багасот генериран од процесот не се фрла, туку се согорува од електраните за производство на електрична енергија. Согорувањето на багасот сочинува околу 9 % од електричната енергија произведена во Бразил.
Во 1970-тите, повеќето индустриски етанол во САД се произведувале како петрохемиски производи, но во 1980-тите САД воведоа субвенции за етанол базиран на пченка. Според Здружението за обновливи горива, од 30 октомври 2007 година, 131 биорафинерија за етанол во САД имаат капацитет да произведуваат 7×109 US gal (26.000.000 m3) етанол годишно. Дополнителни 72 градежни проекти што се во тек (во САД) можат да додадат 6,4 милијарди американски галони (24.000.000 m3) нов капацитет во следните 18 месеци.
Во Индија етанолот се прави од шеќерна трска. Слаткиот сорго е уште еден потенцијален извор на етанол и е погоден за одгледување во суви услови. Меѓународниот институт за истражување на култури за полусуви тропски предели ја истражува можноста за одгледување сорго како извор на гориво, храна и добиточна храна во сушните делови на Азија и Африка. Слаткиот сорго има една третина од потребата за вода од шеќерната трска во истиот временски период. Исто така бара околу 22 % помалку вода од пченката. Првата светска дестилерија за етанол за сладок сорго започна со комерцијално производство во 2007 година во Андра Прадеш, Индија.
Хидратација
Етанолот може да се произведува од петрохемиските резерви на храна, првенствено со кисело катализирана хидратација на етилен. Често се нарекува синтетички етанол..
Катализаторот е најчесто фосфорна киселина, се адсорбира на порозна потпора како што е силика гел или дијатомејска земја. Овој катализатор првпат беше користен за производство на етанол во големи размери од компанијата Shell Oil во 1947 година. Реакцијата се изведува во присуство на пареа со висок притисок на 300 °C (572 °F) каде што се одржува сооднос 5:3 етилен и пареа. Овој процес беше користен на индустриско ниво од страна на Union Carbide Corporation и други. Повеќе не се практикува во САД бидејќи етанолот од ферментација произведен од пченка е поекономичен.
Во еден постар процес, првпат практикуван на индустриско ниво во 1930 година од страна на Union Carbide, но сега речиси целосно застарен, етиленот се хидрираше индиректно со негова реакција со концентрирана сулфурна киселина за да се произведе етил сулфат, кој беше хидролизиран за да се добие етанол и да се регенерира сулфурната киселина:
Од јаглерод диоксид
Етанолот е произведен во лабораторија со конвертирање на јаглерод диоксид преку биолошки и електрохемиски реакции.
Ферментација
Етанолот во алкохолните пијалоци и горивото се произведува со ферментација. Одредени видови квасец (на пример, Saccharomyces cerevisiae) го метаболизираат шеќерот, произведувајќи етанол и јаглерод диоксид. Хемиските равенки подолу ја сумираат конверзијата:
Ферментацијата е процес на одгледување квасец под поволни термички услови за производство на алкохол. Овој процес се изведува на околу 35 – 40 °C (95 – 104 °F). Токсичноста на етанолот кон квасецот ја ограничува концентрацијата на етанолот што се добива со подготовка; повисоки концентрации, според тоа, се добиваат со фортификација или дестилација. Најмногу толерантни на етанол видови квасец можат да преживеат до приближно 18 % етанол волумен удел.
За да се произведе етанол од скробни материјали како што се житарките, скробот мора прво да се претвори во шеќери. Во подготовката на пивото, ова традиционално се постигнува со дозволување на зрното да 'ртат, или слад, кој го произведува ензимот амилаза. Кога сладното зрно се пасира, амилазата ги претвора преостанатиот скроб во шеќери.
Целулоза
Шеќери за ферментација на етанол може да се добијат од целулоза. Употребата на оваа технологија би можела да претвори голем број земјоделски нуспроизводи кои содржат целулоза, како што се пченкари, слама и струготини, во обновливи извори на енергија. Други земјоделски остатоци, како што е багасот од шеќерна трска и енергетски култури, како што е тревата, исто така може да бидат ферментирачки извори на шеќер.
Тестирање


Пиварниците и постројките за биогориво користат два методи за мерење на концентрацијата на етанол. Инфрацрвените сензори за етанол ја мерат вибрациската фреквенција на растворениот етанол користејќи го опсегот C−H на 2900 cm−1. Овој метод користи релативно евтин сензор за цврста состојба кој го споредува опсегот C−H со референтната лента за да ја пресмета содржината на етанол. Пресметката го користи Ламберт-Беровиот закон. Алтернативно, со мерење на густината на почетниот материјал и густината на производот, со помош на хидрометар, промената на специфичната тежина за време на ферментацијата ја покажува содржината на алкохол. Овој евтин и индиректен метод има долга историја во индустријата за производство на пиво.
Прочистување
Дестилација
Етиленската хидратација или варењето произведува смеса од етанол-вода. За повеќето индустриски и горивни употреби, етанолот мора да се прочисти. Фракционата дестилација при атмосферски притисок може да концентрира етанол до 95,6% масен удел (89,5 количествен удел). Оваа смеса е азеотроп со точка на вриење од 78,1 °C (172,6 °F) и не може дополнително да се прочисти со дестилација. Додавањето на агенс за внесување, како што се бензен, циклохексан или хептан, овозможува да се формира нов тринарен азеотроп кој содржи етанол, вода и средство за внесување. Овој тринарен азеотроп со пониска температура на вриење се отстранува преференцијално, што доведува до етанол без вода.
Молекуларни сита и средства за сушење
Освен со дестилација, етанолот може да се суши со додавање на средство за сушење, како што се молекуларните сита, целулозата или пченкарното брашно. Средствата за сушење може да се сушат и повторно да се користат. Молекуларните сита може да се користат за селективно апсорпција на водата од 95,6% раствор на етанол. Молекуларните сита со големина на пора од 3 Å, еден вид зеолит, ефикасно ги одземаат молекулите на водата додека ги пропуштаат молекулите на етанол. Загревањето на влажните сита ја исфрла водата, овозможувајќи регенерација на нивната способност за сушење.
Мембрани и обратна осмоза
Мембраните може да се користат и за одвојување на етанолот и водата. Раздвојувањата базирани на мембрана не подлежат на ограничувањата на азеотропот вода-етанол бидејќи раздвојувањата не се засноваат на рамнотежа на пареа-течност. Мембраните често се користат во таканаречениот процес на дестилација со хибридна мембрана. Овој процес користи предконцентрациска дестилирана колона како прв чекор за одвојување. Понатамошното одвојување потоа се постигнува со мембрана која работи или во режим на пропустливост на пареа или во режим на первапорација. Пропустливоста на пареата користи напојување од мембрана на пареа, а первапорацијата користи течна мембрана.
Други техники
Различни други техники се дискутирани, вклучувајќи ги и следниве:
- Солењето со употреба на калиум карбонат за да се искористи неговата нерастворливост ќе предизвика фазно одвојување со етанол и вода. Ова нуди многу мала нечистотија на калиум карбонат на алкохолот што може да се отстрани со дестилација. Овој метод е многу корисен за прочистување на етанолот со дестилација, бидејќи етанолот формира азеотроп со вода.
- Директна електрохемиска редукција на јаглерод диоксид до етанол во амбиентални услови со користење на бакарни наночестички на јаглероден наноспајк филм како катализатор;
- Екстракција на етанол од каша од жито со суперкритичен јаглерод диоксид;
- Первапорација;
- Фракционо замрзнување се користи и за концентрирање на ферментирани алкохолни раствори, како што е традиционално направен Applejack (пијалак);
- Адсорпција на нишање под притисокот.
Чистота на етанол
Денатуриран алкохол
Чистиот етанол и алкохолните пијалоци се многу оданочени како психоактивни дроги, но етанолот има многу намени кои не вклучуваат негова потрошувачка. За да се олесни даночното оптоварување за овие намени, повеќето јурисдикции се откажуваат од данокот кога средството е додадено во етанолот за да го направи несоодветно за пиење. Тие вклучуваат горчливи агенси како денатониум бензоат и токсини како што се метанол, нафта и пиридин. Производите од овој вид се нарекуваат денатуриран алкохол.
Апсолутен алкохол
Апсолутен или безводен алкохол се однесува на етанол со мала содржина на вода. Постојат различни степени со максимална содржина на вода која се движи од 1% до неколку делови на милион (ppm). Ако се користи азеотропна дестилација за отстранување на водата, таа ќе содржи траги од средството за сепарација на материјалот (на пр. бензен). Апсолутен алкохол не е наменет за човечка исхрана. Апсолутниот етанол се користи како растворувач за лабораториски и индустриски апликации, каде што водата ќе реагира со други хемикалии и како алкохол за гориво. Спектроскопски етанол е апсолутен етанол со мала апсорпција во ултравиолетова и видлива светлина, погоден за употреба како растворувач во ултравиолетово-видливата спектроскопија.
Чистиот етанол е класифициран како 200 доказ во САД, што е еквивалентно на 175 степени доказ во системот на ОК.
Шпиритус
Наместо безводен етанол за различни намени се користи ректификуван алкохол, азеотропен состав од 96% етанол кој содржи 4% вода. Духовите на виното се околу 94% етанол (188 доказ). Нечистотиите се различни од оние во 95% (190 доказ) лабораториски етанол.
Реакции
Етанолот е класифициран како примарен алкохол, што значи дека јаглеродот на кој се прикачува неговата хидроксилна група има два водородни атоми исто така прикачени на него. Многу реакции на етанол се случуваат во неговата хидроксилна група.
Формирање на естер
Во присуство на киселински катализатори, етанолот реагира со карбоксилни киселини за да произведе етил естри и вода:
- RCOOH + HOCH2CH3 → RCOOCH2CH3 + H2O
Оваа реакција, која се спроведува во големи размери индустриски, бара отстранување на водата од реакционата смеса додека се формира. Естерите реагираат во присуство на киселина или база за да го вратат алкохолот и солта. Оваа реакција е позната како сапонификација бидејќи се користи за подготовка на сапун. Етанолот може да формира и естри со неоргански киселини. Диетил сулфат и триетил фосфат се подготвуваат со третирање на етанол со сулфур триоксид и фосфор пентооксид соодветно. Диетил сулфатот е корисен етилирачки агенс во органската синтеза. Етил нитрит, подготвен од реакција на етанол со натриум нитрит и сулфурна киселина, порано се користел како диуретик.
Дехидрација
Во присуство на кисели катализатори, алкохолите може да се претворат во алкени како што е етанолот во етилен. Вообичаено се користат цврсти киселини како што е алумина.
- CH3CH2OH → H2C=CH2 + H2O
Бидејќи водата се отстранува од истата молекула, реакцијата е позната како интрамолекуларна дехидрација. Интрамолекуларната дехидрација на алкохол бара висока температура и присуство на кисел катализатор како што е сулфурна киселина.
Етилен произведен од етанол добиен од шеќер (првенствено во Бразил) се натпреварува со етилен произведен од петрохемиски суровини како нафта и етан.
На пониска температура од онаа на интрамолекуларната дехидрација, интермолекуларната дехидрација на алкохол може и да произведува симетричен етер. Ова е реакција на кондензација. Во следниот пример, диетил етер се произведува од етанол:
- 2 CH3CH2OH → CH3CH2OCH2CH3 + H2O
Согорување
Целосното согорување на етанол формира јаглерод диоксид и вода:
- C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (l); −ΔHc = 1371 kJ/mol = 29.8 kJ/g = 327 kcal/mol = 7.1 kcal/g
- C2H5OH (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2O (g); −ΔHc = 1236 kJ/mol = 26.8 kJ/g = 295.4 kcal/mol = 6.41 kcal/g
Специфична топлина = 2.44 kJ/(kg·K)
Киселинско-базна хемија
Етанолот е неутрална молекула и pH на растворот на етанол во вода е скоро 7,00. Етанолот може квантитативно да се претвори во неговата конјугирана база, етоксидниот јон (CH3CH2O−), со реакција со алкален метал како што е натриумот:
- 2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2
или многу силна база како натриум хидрид:
- CH3CH2OH + NaH → CH3CH2ONa + H2
Киселоста на водата и етанолот се скоро исти, како што е наведено со нивната pKa од 15,7 и 16 соодветно. Така, натриум етоксид и натриум хидроксид постојат во рамнотежа која е тесно избалансирана:
- CH3CH2OH + NaOH
 CH3CH2ONa + H2O
CH3CH2ONa + H2O
Халогенирање
Етанолот не се користи индустриски како прекурсор на етил халидите, но реакциите се илустративни. Етанолот реагира со водородни халиди за да произведе етил халиди како што се етил хлорид и етил бромид преку SN2 реакција:
- CH3CH2OH + HCl → CH3CH2Cl + H2O
HCl бара катализатор како што е цинк хлорид. HBr бара рефлуксирање со катализатор на сулфурна киселина. Етил халидите, во принцип, може да се произведуваат и со третирање на етанол со поспецијализирани средства за халогенирање, како што се тионил хлорид или фосфор трибромид.
- CH3CH2OH + SOCl2 → CH3CH2Cl + SO2 + HCl
При третман со халогени во присуство на база, етанолот го дава соодветниот халоформ (CHX3, каде X = Cl, Br, I). Оваа конверзија се нарекува халоформна реакција. Посредник во реакцијата со хлор е алдехидот наречен хлорал, кој формира хлорал хидрат при реакција со вода:
- 4 Cl2 + CH3CH2OH → CCl3CHO + 5 HCl
- CCl3CHO + H2O → CCl3C(OH)2H
Оксидација
Етанолот може да се оксидира до ацеталдехид и понатаму да се оксидира до оцетна киселина, во зависност од реагенсите и условите. Оваа оксидација не е од индустриска важност, но во човечкото тело, овие реакции на оксидација се катализираат од ензимот на црниот дроб алкохол дехидрогеназа. Производот на оксидација на етанолот, оцетна киселина, е хранлива материја за луѓето, како прекурсор на ацетил CoA, каде што ацетил групата може да се троши како енергија или да се користи за биосинтеза.
Метаболизам
Етанолот е сличен на макронутриентите како што се белковините, мастите и јаглехидратите по тоа што обезбедува калории. Кога се консумира и метаболизира, придонесува со 7 килокалории по грам преку метаболизмот на етанол.
Биохемија
Етанолот е мала молекула и затоа поседува истовремено хидрофилни и липофилни одлики. Тоа му овозможува на етанолот лесно да ја помине плазма мембраната на клетката (пасивна дифузија), па затоа неговата концентрација вонклеточно и внатреклеточно е слична. Околу 95 % проценти од внесениот етанол се разградува во црниот дроб, а 5 % се излачува непроменет преку урината, потта и дишењето. Катаболизмот на етанол не е регулиран и е иреверзибилен - висока конзумација на етанол го намалува NAD+/NADH соодносот, што резултира со длабоки промени во метаболизмот.
Црниот дроб има централна улога во метаболизмот на етанолот. Тука се експримираат со најголема концентрација ензимите оксидацијата на етанолот. Главниот механизам преку кој етанолот се метаболизира опфаќа три ензими: алкохол дехидрогеназа, алдехид дехидрогеназа и ацетил-КоА синтетаза. Во првите два чекори се врши оксидација на молекулата на етанолот (алкохол > алдехид > карбонска киселина), каде акцептор на ослободените електрони е NAD+. Во првиот чекор се одвива во цитозолот, каде под каталитичко дејство на алкохол дехидрогеназата етанолот се оксидира до ацеталдехид. Вториот чекор се одвива во матрицата на митохондриите каде ензимот алдехид дехидрогеназа катализира оксидација на ацеталдехидот до ацетат (оцетна киселина). Притоа се генерираат 2 молекули NADH. Ацетатот во третиот чекор се претвора во ацетил-КоА (активирана оцетна киселина). Ацеталдехидот е реактивно соедниение и формира аддукти со најразлични структурни и функционални белковини при што ја нарушува нивната функција.
Во случај на хронично конзумирање на алкохол се индуцира вториот алтернативен механизам за разградба на етанолот: Микрозомалниот етанол оксидирачки систем (МЕОС) во мазниот ендоплазмичен ретикулум. Индуцирањето на МЕОС е основен механизам за развој на толеранција кон оваа супстанца. Овој пат е цитохром-P450 зависен и користи NADPH како коензим. Уделот во разградбата на етанолот изнесува околу 10-20 %. Ензимот значаен за оваа реакција (CYP2E1) им припаѓа на цитохром P450 монооксигеназите. Во реакцијата која овие ензими ја катализираат, ослободените протони и електрони при оксидација на супстратот се пренесуваат врз кислород. Овој ензим покрај етанолот метаболизира над 80 други супстанци (ксенобиотици) и е високо индуцибилен. МЕОС системот е локализиран главно во перивенозната метаболна зона 3 на црниот дроб, местото каде се јавува рана локализација на алкохолно оштетување на црниот дроб поради ацеталдехидот.
Ефекти на хронична конзумација на алкохол врз метаболизмот
| Ефект | Причинител | Механизам |
|---|---|---|
| Закочување на цитратниот циклус | пораст на NADH и ATP | NADH е алостеричен инхибитор на клучните ензими во цитратниот циклус. |
| Зголемена продукција на лактат | Пируват се редуцира до лактат, а дарител на електрони е NADH. Со тоа се овозможува регенерирање на NAD+ молекули за да се овозможи одвивање на гликолизата. | |
| Закочување на гликонеогенезата | -Опаѓање на количината на достапен пируват како супстрат за de-novo синтеза на оксалацетат при гликонеогенезата. -Намалување на активноста на еден од клучните ензими во гликонеогенезата, пируват карбоксилаза, како резултат на намалена концентрација на пируват. | |
| Намалена оксидација на масните киселини | намалена количина на NAD+ | -Намалена достапност на NAD+ како кофактор во оксидацијата на масните киселини. -Инхибиција на трансферот на масните киселини од цитозолот во митохондриите преку инхибиција на карнитин-ацил трансферазата. |
| Зголемена синтеза на триацилглицериди во црниот дроб | -Зголемено преземање на масни киселини преку крвотокот, настанати преку зголемена липолиза во адипоцитите. -Зголемена синтеза на масни киселини. -Зголемена достапност на глицерол-3-фосфат. | |
| Зголемена синтеза на кетонски тела | пораст на Ацетил-КоА | Ацетил-КоА ја стимулира кетогенезата. |
| Зголемена синтеза на масни киселини во црниот дроб | -Зголемена продукција на ацетил-КоА од ацетат настанат со оксидација на ацеталдехидот. -Намалена активност на AMP-зависната киназа поради зголемена количина на ATP (>намалена на AMP), ја намалува инхибицјата на ацетил-КоА карбоксилазата што доведува до засилена активност, а со тоа и зголемена продукција на претходникот во синтезата на масните киселини малонил-КоА. | |
| Зголемена липолиза во адипоцитите | -Комплексни механизми (предмет на истражување): намалени масти во адипозното ткиво се поврзани со зголемена акумулација на масти во црниот дроб (хепатоцитна стеатоза). |
Безбедност
Етанолот е многу запалив и не треба да се користи околу отворен пламен.
Чистиот етанол ќе ги иритира кожата и очите. Гадење, повраќање и интоксикација се симптоми на голтање. Долготрајната употреба со голтање може да резултира со сериозно оштетување на црниот дроб. Атмосферските концентрации над еден промил се над границите за професионална изложеност на Европската унија.
Историја
Ферментацијата на шеќер во етанол е една од најраните биотехнологии користени од луѓето. Етанолот е историски различно идентификуван како вински дух или жестоки духови, и како aqua vitae или аква вита. Опојните ефекти од неговото консумирање се познати уште од античко време. Етанолот луѓето го користат уште од праисторијата како опојна состојка на алкохолните пијалоци. Исушените остатоци на керамиката стара 9.000 години пронајдена во Кина укажуваат на тоа дека луѓето од неолитот консумирале алкохолни пијалоци.
Запалливата природа на издишувањето на виното веќе им била позната на античките природни филозофи како Аристотел (384–322 п.н.е.), Теофраст (о. 371–287 п.н.е.) и Плиниј Постариот (23/24–79 н.е.). Сепак, ова не доведе веднаш до изолација на етанолот, дури и покрај развојот на понапредни техники за дестилација во римскиот Египет од вториот и третиот век. Важно признание, за прв пат пронајдено во едно од записите што му се припишуваат на Џабир ибн Хајан (IX век н.е.), е дека со додавање сол на зовриеното вино, што ја зголемува релативната испарливост на виното, запаливоста на добиените пареи може да се зголеми. Дестилацијата на вино е потврдена во арапските дела што му се припишуваат на ал-Кинди (о. 801-873 н.е.) и на ал-Фараби (о. 872-950) и во 28-та книга на ал-Захрави (латински: Abulcasis, 936 г. –1013) Китаб ал-Ташриф (подоцна преведена на латински како Liber servatoris). Во дванаесеттиот век, рецептите за производство на аква ардени („запалена вода“, т.е. етанол) со дестилирање на вино со сол почнаа да се појавуваат во голем број латински дела, а до крајот на тринаесеттиот век стана широко позната супстанција меѓу западноевропските хемичари.
Работите на Тадео Алдероти (1223-1296) опишуваат метод за концентрирање на етанол кој вклучува повторена фракциона дестилација преку водено ладење, со што може да се добие чистота на етанол од 90%. Медицинските својства на етанолот ги проучувале Арналд од Виланова (1240–1311 н.е.) и Јован од Рупешиса (о. 1310–1366), од кои вториот го сметал за супстанца која го зачувува животот способна да ги спречи сите болести (аква витае или „вода на животот“, исто така наречена од Џон квинтесенција на виното).
Во Кина, археолошките докази покажуваат дека вистинската дестилација на алкохол започнала за време на династиите Џин (1115–1234) или Јужна Сонг (1127–1279). На археолошко наоѓалиште во Кинглонг, Хебеј, пронајдена е кабина која датира од 12 век. Во Индија, вистинската дестилација на алкохол беше воведена од Блискиот Исток и беше во широка употреба во Султанатот Делхи до 14 век.
Во 1796 година, германско-рускиот хемичар Јохан Тобијас Ловиц добил чист етанол со мешање делумно прочистен етанол (азеотроп од алкохол-вода) со вишок на безводен алкал и потоа дестилирање на смесата на тивок оган. Францускиот хемичар Антоан Лавоазие го опишал етанолот како соединение од јаглерод, водород и кислород, а во 1807 година Николас-Теодор де Сосир ја одредил хемиската формула на етанолот. Педесет години подоцна, Арчибалд Скот Купер ја објавил структурната формула на етанолот. Тоа беше една од првите утврдени структурни формули.
Етанолот првпат бил подготвен синтетички во 1825 година од Мајкл Фарадеј. Тој откри дека сулфурната киселина може да апсорбира големи количини јаглен гас. Добиениот раствор му го дал на Хенри Хенел, британски хемичар, кој во 1826 година открил дека содржи „сулфовинска киселина“ (етил водород сулфат). Во 1828 година, Хенел и францускиот хемичар Жорж-Симон Серулас независно откриле дека сулфовинската киселина може да се разложи во етанол. Така, во 1825 година Фарадеј несвесно открил дека етанолот може да се произведе од етилен (компонента на јагленот гас) со хидратација катализирана со киселина, процес сличен на сегашната индустриска синтеза на етанол.
Етанолот се користел како гориво за светилки во САД уште во 1840 година, но данокот наметнат на индустриски алкохол за време на Граѓанската војна ја направил оваа употреба неекономична. Данокот бил укинат во 1906 година. Употребата како автомобилско гориво датира од 1908 година, при што Ford Model T може да работи на бензин или етанол. Тој се користи и кај шпиртни ламби.
Етанолот наменет за индустриска употреба често се произведува од етилен. Етанолот има широко распространета употреба како растворувач на супстанции наменети за човечки контакт или конзумирање, вклучувајќи мириси, ароми, бои и лекови. Во хемијата, тој е и растворувач и суровина за синтеза на други производи. Има долга историја како гориво за топлина и светлина, а од неодамна и како гориво за мотори со внатрешно согорување.
Галерија
- Горење на испарен етанол во затворен простор
- Горење на испарен етанол во затворен простор
Поврзано
- 1-Пропанол
- Бутанол
- Изопропанол
- tert-Бутил алкохол
Наводи
Понатамошно читање
Надворешни врски
| „Етанол“ на Ризницата ? |
- Alcohol (Ethanol) at The Periodic Table of Videos (University of Nottingham)
- International Labour Organization ethanol safety information
- National Pollutant Inventory – Ethanol Fact Sheet
- CDC – NIOSH Pocket Guide to Chemical Hazards – Ethyl Alcohol
- National Institute of Standards and Technology chemical data on ethanol
- Chicago Board of Trade news and market data on ethanol futures
- Calculation of vapor pressure, liquid density, dynamic liquid viscosity, surface tension of ethanol
- Ethanol History A look into the history of ethanol
- ChemSub Online: Ethyl alcohol
- Industrial ethanol production process flow diagram using ethylene and sulphuric acid
This article uses material from the Wikipedia Македонски article Етанол, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Содржината е достапна под CC BY-SA 4.0 освен ако не е поинаку наведено. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Македонски (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.