Etanol: Composto químico
O etanol, ou alcohol etílico, é un composto químico orgánico alifático cun grupo funcional hidroxilo que forma parte da familia dos alcohois.
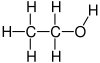
O etanol é o máis común dos alcois. Os alcois son compostos que teñen grupos hidroxilo unidos a átomos de carbono sp3 (é dicir, cadeas de carbono saturadas). A súa fórmula química é CH3-CH2-OH e o seu peso molecular é de 46.0684. En condicións normais de presión e temperatura preséntase como un líquido incoloro cun olor acedo parecido ao do vinagre e é moi inflamable, cun punto de ebulición de 78 °C. Ao mesturarse con auga en calquera proporción, dá unha mestura azeotrópica. Poden considerarse derivados orgánicos da auga nos que un dos hidróxenos foi substituído por un grupo orgánico.
| Etanol | |
|---|---|
 | |
 |  |
etanol | |
Outros nomes Alcohol absoluto, alcohol, alcohol etílico, monóxido de etano, EtOH, hidrato etílico, etil hidróxido, etilol, hidroxietano, metilcarbinol | |
| Identificadores | |
| Número CAS | 64-17-5 |
| PubChem | 702 |
| ChemSpider | 682 |
| Ligando IUPHAR | 2299 |
| Imaxes 3D Jmol | Image 1 |
| |
| |
| Propiedades | |
| Fórmula molecular | C2H6O |
| Masa molar | 46,07 g mol−1 |
| Aspecto | Líquido incoloro |
| Densidade | 0,789 g/cm3 (a 20 °C) |
| Punto de fusión | −114 °C; −173 °F; 159 K |
| Punto de ebulición | 7 837 °C; 14 139 °F; 8 110 K |
| log P | -0,18 |
| Presión de vapor | 5,95 kPa (a 20 °C) |
| Acidez (pKa) | 15.9 (H2O), 29.8 (DMSO) |
| Basicidade (pKb) | -1,9 |
| Índice de refracción (nD) | 1,361 |
| Viscosidade | 0,0012 Pa s (a 20 °C), 0.001074 Pa s (a 25 °C) |
| Momento dipolar | 1.69 D |
Se non se indica outra cousa, os datos están tomados en condicións estándar de 25 °C e 100 kPa. | |
O etanol é unha substancia orgánica obtida a partir da fermentación de azucres, a hidratación do etileno ou a redución do acetaldehído, atópase en bebidas como cervexa, viño e licores, así como na industria do perfume.
O etanol obtívose desde a antigüidade por medio de procesos fermentativos de azucres simples, podendo ser inxerido e comportándose fisioloxicamente como unha substancia psicoactiva. Máis tarde, no século XIX, fenómenos como a industrialización ampliaron aínda máis este mercado, que alcanzou un protagonismo definitivo, ao mesmo ritmo que o desenvolvemento da sociedade de consumo no século XX. O seu uso é moi amplo: en bebidas alcohólicas, na industria farmacéutica, como disolvente químico, como combustible ou mesmo como antídoto.
O etanol é moi importante no ámbito médico, onde se utiliza, como outros alcois tamén, no exterminio da vida microbiana nociva, que podería empeorar o estado dos pacientes xa que o etanol mata os organismos denaturalizando as súas proteínas e disolvendo lípidos sendo eficaz contra a maioría de bacterias, fungos e varios tipos de virus, pero é ineficaz contra as esporas bacterianas. e conservación de líquidos. Tamén se utiliza na produción de biodiésel, onde reacciona co aceite de rícino.
É o principal produto das bebidas alcohólicas, como o viño (con arredor dun 13 % V/V), a cervexa (entre un 5 % V/V e un 8 % V/V), os licores (ata un 50 % V/V) o as augardentes (ata un 70 % V/V).
Etimoloxía
Etanol é o nome sistemático definido pola Unión Internacional de Química Pura e Aplicada (IUPAC) para unha molécula con dous átomos de carbono (prefixo "et-") que ten un único vínculo entre eles (sufixo "-ano") e un grupo hidroxilo unido -OH (sufijo "-ol").
O prefixo "et-" foi cuñado en 1834 polo químico alemán Justus von Liebig. Etilo é unha contracción da palabra francesa éter (calquera substancia que se evapora ou sublima facilmente a temperatura ambiente) e a palabra grega ύλη ( hylé, substancia).
O termo "etanol" foi cuñado como resultado dunha resolución adoptada na Conferencia Internacional sobre Nomenclatura Química que se celebrou en abril de 1892 en Xenebra, Suíza.
Historia
- Véxase tamén: Licor.

A fermentación do azucre en etanol é unha das primeiras biotecnoloxías empregadas polo ser humano. Historicamente, o etanol identificouse de diversas formas como augardente de viño ou augardente para queimar, e como aqua vitae ou aqua vita. Os efectos embriagadores do seu consumo coñécense desde a antigüidade. O etanol foi utilizado polos humanos desde a prehistoria como ingrediente embriagador de bebidas alcohólicas. Residuos secos en cerámicas de hai 9.000 anos atopadas na China suxiren que os pobos do Neolítico consumían bebidas alcohólicas.
A natureza inflamable das exhalaciones do viño xa era coñecida por antigos filósofos como Aristóteles (384-322 a.C.), Teofrasto (c. 371-287 a.C.) e Plinio o Vello (23/24-79 d.C.). Con todo, isto non conduciu inmediatamente ao illamento do etanol, mesmo a pesar do desenvolvemento de técnicas de destilación máis avanzadas no Exipto romano dos séculos II e III. Un recoñecemento importante, atopado por primeira vez nun dos escritos atribuídos a Jābir ibn Ḥayyān (século IX d. C.), foi que ao engadir sal ao viño fervendo, o que aumenta a volatilidade relativa do viño, pódese mellorar a inflamabilidade dos vapores resultantes. A destilación do viño está testemuñada en obras árabes atribuídas a al-Kindī (c. 801-873 EC) e a al-Fārābī (c. 872-950), e no libro 28 de Abulcasis's (Latín: Abulcasis, 936-1013) Kitāb al-Taṣrīf (traducido posteriormente ao latín como Liber servatoris). No século XII, empezaron a aparecer en varias obras latinas receitas para a produción de aqua ardens ("auga ardente", é dicir, etanol) mediante a destilación de viño con sal, e a finais do século XIII converteuse nunha substancia amplamente coñecida entre os químicos de Europa occidental.
Os traballos de Taddeo Alderotti (1223-1296) describen un método para concentrar o etanol que consiste na destilación fraccionada repetida a través dun alambique refrixerado por auga, mediante o cal se podía obter unha pureza do etanol do 90%. As propiedades medicinais do etanol foron estudadas por Arnau de Vilanova (1240-1311 d.C.) e Jean de Roquetaillade (c. 1310-1366), quen o consideraba unha substancia vital capaz de previr todas as enfermidades (o aqua vitae ou "auga da vida", tamén chamada por Jean o quintessence do viño).
Na China, as probas arqueolóxicas indican que a verdadeira destilación do alcol comezou durante as dinastías Jin (1115-1234) ou Song do Sur (1127-1279). Atopouse un alambique nun xacemento arqueolóxico de Qinglong, Hebei, que data do século XII. Na India, a verdadeira destilación do alcol introduciuse desde Oriente Medio e utilizábase amplamente no Sultanato de Delhi no século XIV.
En 1796, o químico xermano-ruso Johann Tobias Lowitz obtivo etanol puro mesturando etanol parcialmente purificado (o azeótropo alcol-auga) cun exceso de álcali anhidro e destilando despois a mestura a fogo lento. O químico francés Antoine Lavoisier describiu o etanol como un composto de carbono, hidróxeno e osíxeno, e en 1807 Nicolas-Théodore de Saussure determinou a fórmula química do etanol. Cincuenta anos máis tarde, Archibald Scott Couper publicou a fórmula estrutural do etanol. Foi unha das primeiras fórmulas estruturais determinadas.
O etanol foi preparado sintéticamente por primeira vez en 1825 por Michael Faraday. Descubriu que o ácido sulfúrico podía absorber grandes volumes de gas de hulla. Deulle a solución resultante a Henry Hennell, un químico británico, que descubriu en 1826 que contiña "ácido sulfovínico" (sulfato de hidróxeno de etilo). En 1828, Hennell e o químico francés Georges-Simon Serullas descubriron de forma independente que o ácido sulfovínico podía descompoñerse en etanol. Así, en 1825 Faraday descubrira sen sabelo que se podía producir etanol a partir de etileno (un compoñente do gas de hulla) mediante hidratación catalizada por ácido, un proceso similar á actual síntese industrial de etanol.
O etanol utilizábase como combustible para lámpadas nos Estados Unidos xa en 1840, pero un imposto aplicado ao alcol industrial durante a Guerra Civil fixo que este uso resultase antieconómico. O imposto derrogouse en 1906. O seu uso como combustible de automoción remóntase a 1908, cando o Ford T podía funcionar con gasolina ou etanol. Así mesmo alimenta algún queimador de alcohol.
O etanol destinado a usos industriais adoita producirse a partir do etileno. O etanol ten un uso moi estendido como disolvente de substancias destinadas ao contacto ou consumo humano, como aromas, saborizantes, colorantes e medicamentos. En química, é tanto un disolvente como unha materia prima para a síntese doutros produtos. Ten unha longa historia como combustible para calor e luz, e máis recentemente como combustible para motores de combustión interna.
Outras constantes
- Densidade óptica: nD20 = 1,361
- Concentración máxima permitida no aire pola Unión Europea: 1.000 ppm
- LD50: 7.060 mg/kg (vía oral)
Síntese
O alcohol é un líquido incoloro e volátil que está presente en diversas bebidas fermentadas. Desde a antigüidade obtíñase o etanol por fermentación anaeróbica dunha disolución con contido en azucre e con lévedo e posterior destilación.
Dependendo do xénero de Bebida alcohólica que o conteña, o alcohol aparece acompañado de distintos elementos químicos que o dotan de cor, sabor, cheiro, entre outras características.
Destilación
Para obter etanol libre de auga aplícase a destilación azeotrópica nunha mestura con benceno ou ciclohexano. Destas mesturas destílase a temperaturas máis baixas o azeótropo, formado polo disolvente auxiliar coa auga, mentres que o etanol quédase retido. Outro método de purificación moi utilizado actualmente é a absorción física mediante barutos moleculares.
A escala de laboratorio tamén se poden utilizar disecantes como o magnesio, que reacciona coa auga formando hidróxeno e óxido de magnesio.
Outro xeito de sintetizalo é mesturar hidruro de osíxeno e etano. Isto é debido a que o etanol é etano en que se substituíu un átomo de hidróxeno por un de hidróxeno e osíxeno (é dicir, un ión hidróxido).
Aplicacións

Xerais
Ademais de usarse con fins culinarios (bebida alcohólica), o etanol utilízase amplamente en moitos sectores industriais e no sector farmacéutico, como principio activo dalgúns medicamentos e cosméticos (é o caso do alcohol antiséptico 70º GL e na elaboración de ambientadores e perfumes).
Médico
Anestésico
O etanol é o sedante máis antigo que se coñece, utilizado como anestésico xeral oral durante a cirurxía na antiga Mesopotamia e na época medieval. A intoxicación leve comeza a partir dunha concentración de alcol en sangue do 0,03-0,05% e induce o coma anestésico ao 0,4%. Con todo, este uso implicaba o alto risco dunha mortal intoxicación etílica e dunha aspiración pulmonar no vómito, o que levou a utilizar alternativas na antigüidade, como o opio e o cánnabis, e máis tarde o éter dietílico a partir da década de 1840.
É un bo disolvente, e pode utilizarse como anticonxelante. Tamén é un bo desinfectante. O seu maior potencial bactericida obtense a unha concentración de aproximadamente o 70 %, xa que se reduce a tensión superficial da célula bacteriana, facilitando o proceso de desnaturalización proteica.
Para o seu uso como antiséptico tópico adoita mesturarse con aditivos como o alcanfor ou o cloruro de benzalconio para evitar a súa inxestión, e por ese motivo véndese como "alcohol etílico desnaturalizado". Con ese mesmo fin tamén se emprega o alcohol isopropílico, que non é potable.
Antiséptico
O etanol utilízase en toalliñas médicas e, sobre todo, en xeles desinfectantes de mans antibacterianos como antiséptico polos seus efectos bactericidas e antifúngicos. O etanol mata microorganismos disolvendo a súa membrana bicapa lipídica e denaturalizando as súas proteínas, e é eficaz contra a maioría de bacterias, fungos e virus. Con todo, é ineficaz contra as esporas bacterianas, pero iso pode paliarse utilizando peróxido de hidróxeno.
Unha solución de etanol ao 70% é máis eficaz que o etanol puro porque o etanol depende das moléculas da auga para unha actividade antimicrobiana óptima. O etanol absoluto pode inactivar os microbios sen destruílos porque o alcol é incapaz de penetrar completamente na membrana do microbio.. O etanol tamén pode utilizarse como desinfectante e antiséptico, xa que provoca a deshidratación celular ao alterar o equilibrio osmótico a través da membrana celular, polo que a auga abandona a célula e provoca a súa morte..
Antídoto
O etanol pode administrarse como antídoto para a intoxicación por etilenglicol e intoxicación por metanol. O etanol serve a este proceso actuando como inhibidor competitivo fronte ao metanol e o etilenglicol para a alcol deshidrogenasa. Aínda que ten máis efectos secundarios, o etanol é menos caro e máis fácil de conseguir que o fomepizol, que tamén se utiliza como antídoto para a intoxicación por metanol e etilenglicol.
Disolvente medicinal
O etanol, a miúdo en altas concentracións, utilízase para disolver moitos medicamentos insolubles en auga e compostos relacionados. As preparacións líquidas de medicamentos para a dor, medicamentos para a tose e o arrefriado e enxaugues bucais, por exemplo, poden conter até un 25% de etanol, e pode ser necesario evitalo en persoas con reaccións adversas ao etanol, como reaccións respiratorias inducidas polo alcol. O etanol está presente principalmente como conservante antimicrobiano en máis de 700 preparados líquidos de medicamentos, como paracetamol, suplementos de ferro, ranitidina, furosemida, manitol, fenobarbital, Trimetoprim-sulfametoxazol e medicamentos de venda libre. antitusíxeno.
Farmacoloxía
Nos mamíferos, o etanol é principalmente metabolizado no fígado e no estómago polas enzimas alcohol deshidroxenase (ADH). Estas enzimas catalizan a oxidación do etanol en acetaldehido (etanal):
- CH3CH2OH + NAD+ → CH3CHO + NADH + H+
Industria química
A industria química emprégao como composto de partida na síntese de diversos produtos, como o acetato de etilo (disolvente para pegamentos, pinturas etc.), ou o éter dietílico. Tamén se aproveitan as súas propiedades desinfectantes.
Combustible
- Artigo principal: Etanol (combustible).
Emprégase como combustible industrial e doméstico. No uso doméstico, emprégase o alcohol de queimar. Este ademais contén compostos como a piridina ou o metanol ou outras substancias denominadas desnaturalizantes, que impiden o seu uso como alimento, xa que o alcohol para consumo adoita levar impostos especiais. Nalgúns países, no canto de etanol utilízase metanol como alcohol de queimar.
No Brasil engádese etanol á gasolina para baixar a importación de petróleo, dando lugar á alconafta. Este país é un dos principais produtores (con 18 mil millóns de litros anuais), con isto reducen un 40 % das súas importacións de cru. Esta última aplicación esténdese tamén cada vez máis noutros países para cumprir co protocolo de Kyoto. Estudos do Departamento de Enerxía dos USA din que o uso en automóbiles reduce a produción de gases de efecto invernadoiro nun 85%[Cómpre referencia]. En países como México existe a política do executivo federal de apoiar os proxectos para a produción integral de etanol e reducir a importación de gasolinas que xa alcanza o 60 %.
Toxicoloxía
- Artigo principal: Efectos do alcohol no corpo.
O etanol puro irrita os ollos e a pal.
O etanol actúa sobre os receptores ácido γ-aminobutírico de tipo A (GABAa) como modulador alostérico positivo aumentando o fluxo de ións transmembrana, o que induce a un estado de inhibición neuroquímica (efecto ralentizador). Produce efectos similares ás benzodiazepinas e aos barbitúricos, que actúan sobre o mesmo receptor aínda que en sitios distintos. Esta semellanza inclúe o potencial adictivo, que tamén é similar.
O etanol pode afectar ao sistema nervioso central, provocando estados de euforia, desinhibición, mareos, somnolencia, confusión, alucinacións (como o ver dobre ou pensar que todo se move de forma espontánea). Ao mesmo tempo, baixa os reflexos. Con concentracións máis altas ralentiza os movementos, impide a coordinación correcta dos membros, perda temporal da visión etc. En certos casos prodúcese un incremento na irritabilidade do suxeito intoxicado como tamén na agresividade; noutra certa cantidade de individuos vese afectada a zona que controla os impulsos, volvéndose impulsivamente descontrolados e frenéticos. Finalmente, conduce ao coma e pode provocar a morte. A toxicidade do etanol é causada en gran medida polo seu principal metabolito, o acetaldehído e o seu metabolito secundario, o ácido acético.
A dose letal mediana (DL50) do etanol en ratas é de 10.3 g/kg. Outros alcohois son significativamente máis tóxicos que o etanol, en parte porque tardan moito máis en seren metabolizados e en parte porque a súa metabolización produce substancias (metabolitos) que son aínda máis tóxicas. O metanol (alcohol de madeira), por exemplo, oxídase no fígado, co que se forma a substancia velenosa formaldehído pola encima alcohol deshidroxenasa; isto pode provocar cegueira ou a morte. Un tratamento eficaz para evitar a intoxicación por formaldehído tras inxerir metanol é administrar etanol. A encima alcohol deshidroxenasa ten unha maior afinidade polo etanol, evitando así que o metanol se una e sirva de substrato. Deste xeito, o resto de metanol terá tempo de ser excretado polos riles. O formaldehído que quede será convertido en ácido fórmico e despois excretado.
A resistencia ao alcohol parece aumentar nas persoas adultas, de maior peso e de menor altura, mentres que os nenos son especialmente vulnerables. Comunicáronse casos de bebés que morreron por intoxicación debida á inhalación de vapores de etanol tras aplicarlles panos embebidos en alcohol. A inxesta en nenos pode conducir a un retardo mental agravado ou a un subdesenvolvemento físico e mental. Tamén se realizaron estudos que demostran que se as nais inxerían alcohol durante o embarazo, os seus fillos podían ser máis propensos a ter a síndrome de alcohólico fetal.
Analítica
Un método de determinación da concentración aproximada de etanol no sangue aproveita o feito de que nos pulmóns se forma un equilibrio que relaciona esta concentración coa concentración de vapor de etanol no aire expirado. Este aire faise pasar por un tubo onde se acha xel de silicio impregnado cunha mestura de dicromato e de ácido sulfúrico. O dicromato, de cor vermella alaranxado, oxida o etanol a acetaldehido e é reducido, á súa vez, a cromo (III), de cor verde. A lonxitude da zona que cambiou de cor indica a cantidade de etanol presente no aire de se pasar un determinado volume polo tubo.
Notas
Véxase tamén
Wiki Commons ten máis contidos multimedia na categoría: Etanol  |
| A Galicitas posúe citas sobre: Etanol |
Bibliografía
- Boyce, John M; Pittet, Didier (2003). "Hand Hygiene in Healthcare Settings". Atlanta, Xeorxia: Centers for Disease Control.
- Onuki, Shinnosuke; Koziel, Jacek A.; van Leeuwen, Johannes; Jenks, William S.; Grewell, David; Cai, Lingshuang (xuño de 2008). Ethanol production, purification, and analysis techniques: a review. 2008 ASABE Annual International Meeting. Providence, RI. Consultado o 16 de febreiro de 2013.
- "Explanation of US denatured alcohol designations". Sci-toys.
- Lange, Norbert Adolph (1967). John Aurie Dean, ed. Lange's Handbook of Chemistry (10th ed.). McGraw-Hill.
Outros artigos
Ligazóns externas
- Alcohol (Ethanol) at The Periodic Table of Videos (University of Nottingham)
- Instituto Nacional de Seguridade e Higiene no Traballo de España: Ficha internacional de seguridade química do etanol (anhidro).
This article uses material from the Wikipedia Galego article Etanol, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Todo o contido está dispoñible baixo a licenza CC BY-SA 4.0, agás que se indique o contrario. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Galego (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.