კალიუმი
კალიუმი (ლათ.
| კალიუმი |
| 19K |
| 39.098 |
| 4s1 |
kalium; ქიმიური სიმბოლო — ) — ელემენტთა პერიოდული სისტემის მეოთხე პერიოდის, პირველი ჯგუფის (მოძველებული კლასიფიკაციით — პირველი ჯგუფის მთავარი ქვეჯგუფის, Iა) ქიმიური ელემენტი. მისი ატომური ნომერია 19, ატომური მასა — 39.098, tდნ — 63.5 °C, tდუღ — 757.64 °C, სიმკვრივე — 0.89 გ/სმ3. მოვერცხლისფრო-თეთრი, მსუბუქი, ძლიერ რბილი და ადვილადდნობადი ლითონი. ბუნებრივი კალიუმი შედგება ორი სტაბილური (93.258%), (6.73%) და ერთი სუსტადრადიოაქტიური (0.0120%) იზოტოპისაგან. კალიუმის ზოგიერთი ნაერთი ცნობილია უძველესი დროიდან. 1807 წელს ჰ. დეივიმ ოდნავ დანესტიანებული მყარი მწვავე კალის () ელექტროლიზით გამოყო და უწოდა მას პოტასიუმი. 1809 წელს ლ. გილბერტმა შემოიღო ტერმინი „კალიუმი“ (არაბულიდან ალ-კალი-პოტაში).
 | |||||||||||||||||||||||||||
| ზოგადი თვისებები | |||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| მარტივი ნივთიერების ვიზუალური აღწერა | მოვერცხლისფრო-თეთრი, მსუბუქი, ძლიერ რბილი და ადვილადდნობადი ლითონი | ||||||||||||||||||||||||||
| სტანდ. ატომური წონა Ar°(K) | 39.0983±0.0001 39.098±0.001 (დამრგავლებული) | ||||||||||||||||||||||||||
| კალიუმი პერიოდულ სისტემაში | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| ატომური ნომერი (Z) | 19 | ||||||||||||||||||||||||||
| ჯგუფი | 1 ჯგუფი (ტუტე ლითონები) | ||||||||||||||||||||||||||
| პერიოდი | 4 პერიოდი | ||||||||||||||||||||||||||
| ბლოკი | | ||||||||||||||||||||||||||
| ელექტრონული კონფიგურაცია | [Ar] 4s1 | ||||||||||||||||||||||||||
| ელექტრონი გარსზე | 2, 8, 8, 1 | ||||||||||||||||||||||||||
ელემენტის ატომის სქემა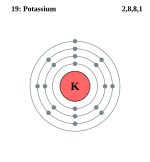 | |||||||||||||||||||||||||||
| ფიზიკური თვისებები | |||||||||||||||||||||||||||
| აგრეგეგატული მდგომ. ნსპ-ში | მყარი სხეული | ||||||||||||||||||||||||||
| დნობის ტემპერატურა | 63.5 °C (336.7 K, 146.3 °F) | ||||||||||||||||||||||||||
| დუღილის ტემპერატურა | 759 °C (1032 K, 1398 °F) | ||||||||||||||||||||||||||
| სიმკვრივე (ო.ტ.) | 0.89 გ/სმ3 | ||||||||||||||||||||||||||
| სიმკვრივე (ლ.წ.) | 0.82948 გ/სმ3 | ||||||||||||||||||||||||||
| კრიტიკული წერტილი | 2223 K, 16 მპა | ||||||||||||||||||||||||||
| დნობის კუთ. სითბო | 2.33 კჯ/მოლი | ||||||||||||||||||||||||||
| აორთქ. კუთ. სითბო | 76.9 კჯ/მოლი | ||||||||||||||||||||||||||
| მოლური თბოტევადობა | 29.6 ჯ/(მოლი·K) | ||||||||||||||||||||||||||
| ატომის თვისებები | |||||||||||||||||||||||||||
| ჟანგვის ხარისხი | −1, +1 | ||||||||||||||||||||||||||
| ელექტროდული პოტენციალი | 2.92 ვ | ||||||||||||||||||||||||||
| ელექტროუარყოფითობა | პოლინგის სკალა: 0.82 | ||||||||||||||||||||||||||
| იონიზაციის ენერგია |
| ||||||||||||||||||||||||||
| ატომის რადიუსი | ემპირიული: 227 პმ | ||||||||||||||||||||||||||
| კოვალენტური რადიუსი (rcov) | 203±12 პმ | ||||||||||||||||||||||||||
| იონური რადიუსი (rion) | 133 პმ | ||||||||||||||||||||||||||
| ვან-დერ-ვალსის რადიუსი | 275 პმ | ||||||||||||||||||||||||||
| მოლური მოცულობა | 45.3 სმ3/მოლი | ||||||||||||||||||||||||||
| კალიუმის სპექტრალური ზოლები | |||||||||||||||||||||||||||
| სხვა თვისებები | |||||||||||||||||||||||||||
| ბუნებაში გვხვდება | პირველადი ნუკლიდების სახით | ||||||||||||||||||||||||||
| მესრის სტრუქტურა | კუბური მოცულობაცენტრირებული  | ||||||||||||||||||||||||||
| მესრის პერიოდი | 5.332 Å | ||||||||||||||||||||||||||
| ბგერის სიჩქარე | 2000 მ/წმ (20 °C) | ||||||||||||||||||||||||||
| თერმული გაფართოება | 83.3 µმ/(მ·K) (25 °C) | ||||||||||||||||||||||||||
| ხვედრითი თბოტევადობა | 102.5 ჯ/(K·მოლ) | ||||||||||||||||||||||||||
| თბოგამტარობა | 79.0 ვტ/(მ·K) | ||||||||||||||||||||||||||
| მაგნეტიზმი | პარამაგნეტიკი | ||||||||||||||||||||||||||
| მაგნიტური ამთვისებლობა | +20.8×10−6 სმ3/მოლ | ||||||||||||||||||||||||||
| იუნგას მოდული | 3.53 გპა | ||||||||||||||||||||||||||
| წანაცვლების მოდული | 1.3 გპა | ||||||||||||||||||||||||||
| დრეკადობის მოდული | 3.1 გპა | ||||||||||||||||||||||||||
| მოოსის მეთოდი | 0.4 | ||||||||||||||||||||||||||
| ბრინელის მეთოდი | 0.363 მპა | ||||||||||||||||||||||||||
| CAS ნომერი | 7440-09-7 | ||||||||||||||||||||||||||
| ისტორია | |||||||||||||||||||||||||||
| აღმომჩენია | ჰამფრი დეივი (1807) | ||||||||||||||||||||||||||
| კალიუმის მთავარი იზოტოპები | |||||||||||||||||||||||||||
| |||||||||||||||||||||||||||
| • | |||||||||||||||||||||||||||
ფიზიკური თვისებები
მოვერცხლისფრო-თეთრი მეტალია. სიმკვრივე 0,86 გ/სმ3, ძალიან მსუბუქია, ადვილად იჭრება დანით. ბუნებრივი კალიუმი შედგება ორი სტაბილური 3919K (93,08 %) და 4119K (6,91 %) და ერთი რადიოაქტიური იზოტოპისაგან 4019K (0,01 %). ლღობის ტემპერატურა 100 °C-ზე დაბალია.
იზოტოპები
ბუნებრივი კალიუმი შედგება 3 იზოტოპისაგან. ორი მათგანი მდგრადი სტაბილურია: 39K (იზოტოპური გავრცობადობა 93,258 %) და 41K (6,730 %). მესამე იზოტოპია 40K (0,0117 %) წარმოადგენს ბეტა-აქტიურს ნახევრად დაშლის პერიოდია 1,251×109 წელი. ბუნებრივი კალიუმის ყოველ გრამში 1 წმ-ის განმავლობაში იშლება საშუალოდ 32 ბირთვი 40K, რის გამოც, მაგალითად ადამიანის 70 კგ. ორგანიზმში ყოველ წამში ხდება მიახლოებით 4000 რადიოაქტიული დაშლა. ითვლება რომ 40K არის გეოთერმული ენერგიის ერთ ერთი მთავარი წყარო მიწის წიაღში. კალიუმიან მინერალებში, თანდათანობით გროვდება 40Ar, კალიუმ-40 -ის დაშლის ერთ ერთი პროდუქტი, რაც საშუალებას იძლევა ქანების წლოვანების დადგენისა; კალიუმ-არგონის მეთოდი წარმოადგენს ბირთული გეოქრონოლოგიის ძირითად მეთოდს.
სტანდარტული ატომური მასა
კალიუმის სტანდარტულ ატომურ მასად მიღებულია — 39,098, რომელიც როგორც წესი იანგარიშება ბუნებაში არსებულ ყველა სტაბილურ იზოტოპტთა საშუალო შეწონილი მასით, მათი დედამიწის ქერქსა და ატმოსფეროში გავრცელების პროპორციულად.
| იზოტოპი | Z | N | ატომური მასა (მ.ა.ე.) | % ბუნებაში | საშუალო შეწონილი |
|---|---|---|---|---|---|
| 39K | 19 | 20 | 38,96370668 | 93,258 % | 36,336773 |
| 40K | 19 | 21 | 39,96399848 | 0,012 % | 0,004795 |
| 41K | 19 | 22 | 40,96182576 | 6,73 % | 2,756730 |
| Ar, სტან.(K) | 39,0983 |
ბუნებაში გავრცელება
ბუნებაში ტუტე მეტალები თავისუფალი სახით არ გვხვდებიან. კალიუმი შედის სხვადასხვა მინერალების და მთის ქანების-სილიკატების შედგენილობაში. მიწის ზედაპირის მყარ ქერქში ის ასზე მეტ მინერალს წარმოშობს, გარდა ამისა, მცირე რაოდენობით ის ასეულობით სხვა მინერალების შემადგენლობაშიც შედის. მისი საშუალო შემადგენლობა მიწის ქერქში 2,5 % უახლოვდება. ეს საკმაოდ დიდი რიცხვია და იმის მაჩვენებელია, რომ კალიუმი გაბატონებულ ელემენტთა რიცხვს ეკუთვნის. მიწაზე კალიუმის ატომების აკვანს გრანიტები და მჟავე ლავები წარმოადგენენ. ეს ქანები ადვილად იშლებიან მიწის ზედაპირზე-ჰაერის, წყლისა და ნახშირმჟავას მოქმედებით. როდესაც დედამიწის სიღრმეში ცივდება გამდნარი მაგმა და ცალკეული ელემენტები მასში მოძრაობის უნარის, მქროლადი გაზების ანდა, პირიქით, მოძრავ, ადვილად მდნადი ნაწილაკების წარმოქმნის მიდრეკილების მიხედვით ნაწილდებიან, კალიუმი სწორედ ამ უკანასკნელთ მიეკუთვნება. კალიუმი შავი და თეთრი ფერის ქარსების შემადგენლობაშიც შედის.ოკეანეთა ფსკერის ბაზალტურ ქანებში კი ის 0,3 %-ზე მეტი არ არის. ზღვის წყალში მის მხოლოდ უმნიშვნელო რაოდენობას ვხვდებით, დედა-ქანებში კალიუმის ყოველი 1000 ატომიდან ზღვის აუზს მხოლოდ 2 ატომი აღწევს, 998-ს კი ნიადაგის საფარი შთანთქავს და ამაშია ნიადაგის სასწაულებრივი ძალა. კალიუმის ატომები იმდენად თავისუფლად არიან შებმული ნიადაგთან, რომ მცენარის ყოველ უჯრედს თავისუფლად შეუძლია მათი შთანთქმა და თავის სასიცოცხლოდ გამოყენება. ამგვარად, თავისი მიგრაციის ერთ-ერთ ციკლს კალიუმი ნიადაგიდან იწყებს: ის შეიწოვება მცენარეთა ფესვებით, გროვდება მათ მკვდარ დანაგროვებში, ნაწილობრივ გადადის ცხოველისა და ადამიანის ორგანიზმებში და ისევ ლპობის შედეგად უბრუნდება ნიადაგს, საიდანაც ის ოდესღაც ცოცხალმა უჯრედმა ამოიტანა.

ქიმიური თვისებები
- კალიუმი ძლიერი აღმდგენია. ჰაერზე სწარაფად იჟანგება,მეტალის კრიალა ზედაპირი ჰაერზე მალე იფარება ოქსიდის ფენით, უფრო სწორედ კალიუმის პეროქსიდი ამიტომ ნავთში ინახავენ.
კალიუმის ოქსიდი კი მიიღება ჟანგბადით ღარიბ გარემოში ლითონის გახურებით, არაუმეტეს 180 °C
ან კალიუმის სუპეროქსიდის გახურებით კალიუმ ლითონთან ერთად
(კალიუმის ჰიპეროქსიდი).
- ზეჟანგებში კალიუმი ერთვალენტოვანია.
- ადვილად ურთიერთქმედებს ბევრ არამეტალთან, ენერგიულად რეაგირებს წყალთან და რეაქციის დროს გამოყოფილი სითბოს გამო მაშინვე აალდება. უფრო ენერგიულად მოქმედებს მჟავებთან. მაღალ ტემპერაურაზე უერთდება წყალბადს და წარმოიქმნება კალიუმის ჰიდრიდი KH, რომელიც თავისი ბუნებით მარილის მსგავსია. ამ ნაერთში კალიუმს აქვს დადებითი დაჟანგულობის ხარისხი, წყალბადს-უარყოფითი K+H- .
,
- კალიუმი აქტიურად რეაგირებს ჰალოგენებთან, რის შედეგადაც მიიღება მარილები
,
კალიუმი იწვის იისფერი ალით, მისი წვის შედეგად მიიღება ზეჟანგები ფხვნილის სახით
მიღება
კალიუმი ელექტროლიზური გზით მიიღება. მეტალურ კალიუმს იღებენ კალიუმის ქლორიდის ნალღობის ელექტროლიზით.
- მეტალური კალიუმი ადვილად მიიღება აგრეთვე გალღობილი კალიუმის ჰიდროქსიდის ელექტროლიზით. გალღობისას კალიუმის ტუტე მთლიანად იშლება იონებად
- კალიუმის მიღების ამ ხერხებმა ვერ ჰპოვა გავრცელება ტექნიკური სიძნელეების გამო (დაბალი გამოსავლიანობა დენის მიხედვით, ტექნიკის უსაფრთხოების უზრუნველყოფის სიძნელე). ამჟამად კალიუმის სამრეწველო მიღება დაფუძნებულია შემდეგ პროცესებზე. 800 °C-ზე გამდნარ კალიუმის ქლორიდზე ატარებენ ნატრიუმის ორთქლს, ხოლო გამოყოფილ კალიუმის ორთქლს აკონდენსირებენ.
გამდნარ კალიუმის ჰიდროქსიდსა და თხევად ნატრიუმს შორის ურთიერთქმედება ხორციელდება წინაღდგენით 440 0C-ზე ნიკელისაგან დამზადებულ სარეაქციო სვეტში.
კალიუმი ცოცხლ ორგანიზმებში აღსანიშნავია, რომ მხოლოდ მცენარეებისთვის კი არაა აუცილებელი კალიუმი, ის მნიშვნელოვანი რაოდენობით ცხოველთა ორგანიზმების შემადგენლობაშიც შედის. მაგალითად, ადამიანის კუნთებში კალიუმი სჭარბობს ნატრიუმს. განსაკუთრებით ბევრია კალიუმი ტვინში, ღვიძლში, გულსა და თირკმელებში. უნდა აღინიშნოს, რომ კალიუმი განსაკუთრებით მზარდი ორგანიზმისთვის არის მნიშვნელოვანი, ასაკოვან ადამიანს კი მოთხოვნილება კალიუმზე შესამჩნევად უმცირდება. კალიუმი ნივთიერებათა ცვლის პროცესებში აქტიურად მონაწილეობს. გარდა ამისა, იგი აუცილებელია გულის კუნთის მუშაობისთვის. ადამიანის ორგანიზმში კალიუმი გულის მუშაობის აღმგზნებია, ელემენტი ნატრიუმი კი პირიქით, გულის მოქმედებას ამშვიდებს. ამიტომაა, რომ ორგანიზმი ცდილობს სისხლში ყოველთვის გააჩნდეს მარილების მუდმივი კონცენტრაცია. ადამიანი ოფლთან და სხვა სახის გამონაყფთან ერთად დღეღამის განმავლობაში ზუსტად იმდენივე მარილს ჰკარგავს, რამდენსაც ჭამს. კალიუმის წყაროა ბოსტნეული კულტურები და ხილი, განსაკუთრებით მშრალი ხილი (ჭერმის ჩირი, ქიშმიში და სხვა). კალიუმი უხვადაა გარგარის ჩირში (კურაგაში), ლეღვში, ფორთოხალში, მანდარინში, კარტოფილში (500 გ კარტოფილი კალიუმის დღიურ მოთხოვნილებას მთლიანად აკმაყოფილებს.

კალიუმის მწვავე ტუტე
მწვავე ტუტე ეწოდება წყალში კარგად ხსნად ტუტე მეტალთა ჰიდროქსიდებს, მათგან მნიშვნელოვანია KOH. კალიუმის ჰიდროქსიდი თეთრი ფერის, არაგამჭვირვალე, მყარი კრისტალური ნივთიერებაა. წყალში კარგად იხსნება დიდი რაოდენობა სითბოს გამოყოფით. წყალხსნარებში ის მთლიანად დისოცირდება და წარმოადგენს ძლიერ ტუტეს. ამჟღავნებს ფუძის ყველა თვისებას, ჰაერზე შთანთქავს ტენსა და ნახშირბადის (IV) ოქსიდს, რის გამოც გაზების გასაშრობად ხმარობენ.
კალიუმოვანი სასუქები
კალიუმის მარილები უმთავრესად გამოიყენებიან სასუქებად. კალიუმის უკმარისობა ნიადაგში შესამჩნევად ამცირებს მოსავალს და მცენარეთა წინააღმდეგობას არაკეთილნაყოფიერი პირობების მიმართ. ამიტომ მოპოვებული კალიუმის მარილების 90%-მდე გამოიყენება კალიუმოვანი სასუქების სახით. მნიშვნელოვან კალიუმოვან სასუქებს წარმოადგენენ: ნედლი მარილები, რომლებიც წარმოადგენენ დაფქვილ ბუნებრივ მარილებს, უპირეტესად მინერალებს სილვინიტს NaCI•KCIდა კაინიტს MgSO4•KCI•3H2O. ბუნებრივი კალიუმის მარილების გადამუშავების შედეგად მიღებული კონცენტრირებული სასუქები-ესენია KCI და K2SO4. პოტაშის K2CO3 შემცველი მერქნისა და ტორფის ნაცარი. ქლორკალიუმი(KCI) მაღალპროცენტული თეთრი წვრილკრისტალური მარილია. მინარევების სახით შეიცავს ნარინჯისფერ და წითელ კრისტალებს. ფიზიოლოგიურად მჟავე სასუქია, ხასიათდება ჰიგროსკოპულობით. გამოიყენება ყველა კულტურაში. მიუხედავად იმისა, რომ ქლორს შეიცავს მცირე რაოდენობით, ქლორისადმი მგრძნობიარე კულტურებში(კარტოფილი, თამბაქო, ვაზი, ხახვი, კომბოსტო და სხვ.) მისი შეტანა სასურველია თესვის ან დარგვის წინ შემოდგომაზე ან გაზაფხულზე, რათა ამ პერიოდის ნალექების ზემოქმედებით ქლორი ჩაირეცხოს ქვედა ფენებში. კალიუმის გვარჯილა მოყვითალო რუხი ფერის კრისტალური, ნაკლებ ჰიგროსკოპული მარილია. გამოიყენება ყველა ტიპის ნიადაგზე ყველა კულტურაში. კალიუმთან ერთად სასუქში აზოტის შემცველობა ბევრად განაპირობებს მის მაღალ ეფექტს. კალიმაგნეზია კრისტალური მოთეთრო ფერის მარილია ყვითელი მინარევებით. ხასიათდება კარგი ფიზიკური თვისებებით, არის როგორც ფხვნილისებრი, ისე გრანულირებული. გამოიყენება ყველა კულტურაში. კალიუმ- მაგნეზიური კონცენტრატი რუხი ფერის გრანულირებული მარილია. ნაკლებ ჰიგროსკოპულია. ცეცხლ და ფეთქებად საშიშია, დაცული უნდა იქნეს შენახვის და უსაფრთხოების წესები. გამოიყენება ყველა კულტურაში, მათ შორის ქლორისადმი მგრძნობიარე კულტურებშიც. ნიტროფოსკა თეთრი მონაცრისფრო მარილია, არაჰიგროსკოპულია, ნორმალური შენახვის პირობებში არ იბელტება გამოიყენება ერთწლიან და მრავალწლიან კულტურებში.
ლიტერატურა
- ა. ე. ფერსმანი, „გეოქიმია“
- გ. პ. ხომჩენკო, „ქიმია“
- ვ. კოკოჩაშვილი, „ქიმია“
რესურსები ინტერნეტში
სქოლიო
This article uses material from the Wikipedia ქართული article კალიუმი, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). შინაარსი წარმოდგენილია შემდეგი ლიცენზიით (თუ სხვა არ არის მითითებული): CC BY-SA 4.0. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki ქართული (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.









