النِّيُون هو عنصر كيميائي له العدد الذرّي 10، والرمز Ne، وهو ينتمي إلى مجموعة الغازات النبيلة في الجدول الدوري.
يكون النيون في الشروط القياسية من الضغط ودرجة الحرارة على شكل غاز خامل أحادي الذرة وعديم اللون والرائحة، وهو أخفّ من الهواء، إذ أن قيمة كثافته تبلغ حوالي الثلثين من قيمة كثافة الهواء.
| |||||||||||||||||||||||||
| المظهر | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
غاز عديم اللون ذو وميض أحمر-برتقالي في حالة البلازما الخطوط الطيفية للنيون | |||||||||||||||||||||||||
| الخواص العامة | |||||||||||||||||||||||||
| الاسم، العدد، الرمز | نيون، 10، Ne | ||||||||||||||||||||||||
| تصنيف العنصر | غاز نبيل | ||||||||||||||||||||||||
| المجموعة، الدورة، المستوى الفرعي | 18، 2، p | ||||||||||||||||||||||||
| الكتلة الذرية | 20.1797 غ·مول−1 | ||||||||||||||||||||||||
| توزيع إلكتروني | 1s2 2s2 2p6 | ||||||||||||||||||||||||
| توزيع الإلكترونات لكل غلاف تكافؤ | 2, 8 (صورة) | ||||||||||||||||||||||||
| الخواص الفيزيائية | |||||||||||||||||||||||||
| الطور | غاز | ||||||||||||||||||||||||
| الكثافة | (0 °س، 101.325 كيلوباسكال) 0.9002 غ/ل | ||||||||||||||||||||||||
| كثافة السائل عند نقطة الغليان | 1.207 غ·سم−3 | ||||||||||||||||||||||||
| نقطة الانصهار | 24.56 ك، -248.59 °س | ||||||||||||||||||||||||
| نقطة الغليان | 27.07 ك، -246.08 °س | ||||||||||||||||||||||||
| نقطة ثلاثية | 24.5561 كلفن (-249°س)، 43 كيلوباسكال | ||||||||||||||||||||||||
| النقطة الحرجة | 44.4 ك، 2.76 ميغاباسكال | ||||||||||||||||||||||||
| حرارة الانصهار | 0.335 كيلوجول·مول−1 | ||||||||||||||||||||||||
| حرارة التبخر | 1.71 كيلوجول·مول−1 | ||||||||||||||||||||||||
| السعة الحرارية (عند 25 °س) | 20.786 جول·مول−1·كلفن−1 | ||||||||||||||||||||||||
| ضغط البخار | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| الخواص الذرية | |||||||||||||||||||||||||
| أرقام الأكسدة | لا بيانات | ||||||||||||||||||||||||
| طاقات التأين | الأول: 2080.7 كيلوجول·مول−1 | ||||||||||||||||||||||||
| الثاني: 3952.3 كيلوجول·مول−1 | |||||||||||||||||||||||||
| الثالث: 6122 كيلوجول·مول−1 | |||||||||||||||||||||||||
| نصف قطر تساهمي | 58 بيكومتر | ||||||||||||||||||||||||
| نصف قطر فان دير فالس | 154 بيكومتر | ||||||||||||||||||||||||
| خواص أخرى | |||||||||||||||||||||||||
| البنية البلورية | مكعب مركزي الوجه | ||||||||||||||||||||||||
| المغناطيسية | مغناطيسية معاكسة | ||||||||||||||||||||||||
| الناقلية الحرارية | 49.1x10-3 واط·متر−1·كلفن−1 (300 كلفن) | ||||||||||||||||||||||||
| سرعة الصوت | (غاز، 0 °س) 435 متر/ثانية | ||||||||||||||||||||||||
| معامل الحجم | 654 غيغاباسكال | ||||||||||||||||||||||||
| رقم CAS | 7440-01-9 | ||||||||||||||||||||||||
| النظائر الأكثر ثباتاً | |||||||||||||||||||||||||
| المقالة الرئيسية: نظائر النيون | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
اكتُشف غاز النيون مع غازي الكريبتون والزينون سنة 1898 كواحد من ثلاثة غازات نبيلة نادرة متبقية في عيّنة من الهواء الجاف، بعد إزالة غازات النتروجين والأكسجين والآرغون وثنائي أكسيد الكربون. كان النيون ثاني الغازات النادرة الثلاثة المكتشفة، وجرى التعرّف فوراً على أنه عنصر جديد من طيف الانبعاث (طيف الإصدار) الخاص به، والذي له لون أحمر برتقالي ساطع. النيون عنصر خامل كيميائياً، ولا يشكّل أي مركّب كيميائي معتدل بدون شحنة كهربائية.
خلال عملية التخليق النووي للعناصر تشكّلت كمّيّات كبيرة من النيون من عملية ألفا في النجوم. على الرغم من أنّ النيون عنصر شائع جداً في الكون وفي النظام الشمسي، إذ أنّه الخامس في الترتيب من حيث الوفرة الكونية (بعد الهيدروجين والهيليوم والأكسجين والكربون)، إلاّ أنّه نادر الوجود على الأرض، حيث يكون تركيزه في تركيب الهواء حوالي 18.2 جزء في المليون (ppm) حجماً، وتكون نسبته أقلّ في القشرة الأرضية، والذي يكون على شكل غاز محتجز داخل بعض أنواع الصخور. يعود السبب في ارتفاع تركيز النيون الكوني مقابل انخفاضه على الأرض إلى التطايرية العالية وخفّة وزنه بالمقارنة مع الهواء، إضافةً لعدم تشكيله أيّة مركّبات كيمائية تربطه بالأجسام الصلبة. بالتالي كنتيجة فإنّه تفلّت غالباً من الكواكب المصغرة تحت حرارة الشمس أثناء المراحل الأولية لولادة النظام الشمسي.
يعطي النيون توهّجاً مميّزاً ذا لون برتقالي محمّر في مصابيح النيون منخفضة الجهد، وكذلك الأمر في أنابيب التفريغ وفي لافتات النيون ذات الجهد العالي. يستخدم النيون في بعض أنابيب البلازما وله بعض التطبيقات كغاز مثلِّج، إلّا أنّ استخداماته في التطبيقات التجارية الأخرى قليلة. يستحصل على النيون تجارياً من التقطير التجزيئي للهواء المسيّل، وبما أنّ الهواء هو المصدر الوحيد فلذلك تكون أسعاره أغلى من الهيليوم.

اكتُشف عنصر النيون لأوّل مرّة سنة 1898 من قبل العالم وليام رامزي ومساعده موريس ترافرز. كان رامزي قد اكتشف سنة 1894 الغاز النبيل الأول وهو الآرغون، ثم استطاع فصل غاز الهيليوم؛ ونظراً لعلمه بقوانين الجدول الدوري للعناصر فقد فطن أنّه يوجد غاز نبيل بين الهيليوم والأرغون، وأنّ كتلته الذرية نحو 20 وحدة ذرية (u).
شرع رامزي ابتداءً من سنة 1896 بفحص معادن خام ومواد شهب عديدة، والتي تنبعث منها غازات عند تسخينها. وكان يساعده في ذلك تلميذه موريس ترافرز، وكان معظم ما يجدانِه هو غاز الهيليوم وبعده الأرغون. بعد ذلك قام العالمان بفصل نحو 15 لتر من غاز الأرغون (الخام) من الهواء السائل باستخدام طريقة التقطير المجزّأ، وكان أول ما ظهر لهما غاز الكريبتون وعرفاه من طيف انبعاثه. وفي يوم 13 يونيو 1898 نجح الاثنان في فصل عنصر أخفّ ذي درجة غليان أخفض من الأرغون الخام، فأطلقا عليه اسم «نيون» من الكلمة الإغريقية νέον، وهي الشكل المفرد الحيادي لغوياً من νέος (نيوس)، والتي تعني: جديد. كان اللون الأحمر-البرتقالي الساطع والمنبعث من عنصر النيون المثار إلكترونياً محطّ انتباه على الفور، وقام ترافيرز بتدوين ذلك لاحقاً: «أنبأنا الضوء الأحمر الساطع من الأنبوب بالقصّة وحده، وكان مشهداً حاضراً في البال لن ينسى.»
كانت ندرة النيون في البداية عائقاً أمام أيّة تطبيقات محتملة؛ إلى أن تمكّن جورج كلود من إنتاج كمّيّات وافرة منه في شركته إير ليكيد، والتي كانت تنتج النيون كمنتج ثانوي من عملية تسييل الهواء. كان أول استخدام للعنصر الجديد سنة 1910 حيث استخدمه العالم كلود في صناعة مصباح النيون. ملأ «كلود» أنبوبة زجاجية بغاز النيون وسلـّط عليه من الجانبين جهداً كهربائياً عالياً فجعله يضيء. عرض كلود مبدأ إضاءة النيون الحديثة في باريس على هيئة أنابيب نيون مغلقة، والتي حاول في البداية أن يبيعها كإنارة داخلية للبيوت، إلّا أنّها لم تلق استحساناً لدى الناس نظراً للونها. قام كلود بعد ذلك سنة 1912 ببيع أنابيب النيون كلافتات للدعاية والتي لاقت نجاحاً فورياً في أوروبا، ومنها انتقلت إلى أمريكا وساهمت في ازدهار قطاع الدعاية بسبب اللون الأحمر المتوهّج الأخّاذ.
لعب النيون دوراً في الفهم الأساسي لطبيعة الذرّات سنة 1913، عندما قام جوزيف جون طومسون وكجزء من تجاربه لفهم طبيعة تركيب أشعة القنال (أشعّة الأنود/أشعّة مصعدية) بإجراء تجربة تمرير حزم من أيونات النيون داخل حقل مغناطيسي وكهربائي، وقاس انحراف تلك الحزم على صفيحة فوتوغرافية ضوئية. لاحظ طومسون وجود بقعتين منفصلتين من اللطخات الضوئية على الصفيحة الفوتوغرافية، والتي تشير إلى مساري انحراف مختلفين للأيونات. خلص طومسون في النهاية إلى استنتاج أنّ بعض الذرّات في غاز النيون ذات كتلة أعلى من البقيّة. على الرغم من عدم المقدرة في عصر طومسون على تقديم تفسير لذلك، إلّا أن تلك التجربة كانت أول اكتشاف لنظائر مستقرّة بين العناصر، ومهّد الجهاز الذي صنعه طومسون الطريق لتطوير تقنية مطيافية الكتلة.
يعدّ النيون من العناصر الشائعة في الكون، فهو يأتي في المرتبة الخامسة من حيث وفرة العناصر الكيمائية في الكون من حيث الكتلة، وذلك بعد الهيدروجين والهيليوم والأكسجين والكربون. تنتج النظائر المستقرّة من النيون في النجوم، حيث يتشكّل النظير 20Ne من تفاعل اندماج الهيليوم والأكسجين في عملية ألفا، والتي تتطلّب درجات حرارة تفوق 100 ميغاكلفن.
تعادل وفرة النيون في الكون حوالي جزءاً واحداً في كل 750، أمّا في الشمس والسدم في النظام الشمسي فهي تبلغ افتراضياً جزءاً واحداً في كل 600. بيّنت عيّنات من الغلاف الجوّي لكوكب المشتري أُخذت بواسطة مسبار غاليليو أنّ تركيز النيون في الطبقات العليا منخفض، وهو يصل إلى مستوى جزء واحد في كل 6000 من حيث الكتلة، ممّا قد يشير إلى أن الكواكب المصغّرة الجليدية التي جلبت النيون إلى المشتري من خارج النظام الشمسي كانت قد تشكلّت في منطقة ذات درجات حرارة مرتفعة، بحيث لم تكن قادرة على استبقاء النيون كمكوّن للغلاف الجوي، مع العلم أنّ وفرة الغازات الخاملة الأثقل في المشتري هي أكبر بعدّة مرّات من التي في الشمس.
بناءً على دراسات أجريت سنة 2015 باستخدام مسبار مستكشف بيئة الغبار والغلاف الجوي القمري (LADEE) التابع لوكالة ناسا فقد اكتشف وجود عنصر النيون في غلاف إكسوسفير الخارجي للقمر.
يؤلّف النيون جزءاً واحداً من في كل من 55,000 جزء من غلاف الأرض الجوي، أو بتعبير آخر 18.2 جزء في المليون (ppm) حجماً، أو جزء في كل 79,000 جزء كتلةً. يوجد النيون بنسب ضئيلة في القشرة الأرضية على شكل غاز محتجز داخل بعض أنواع الصخور. على هذا الأساس ينتج النيون صناعياً فقط من التقطير التجزيئي للهواء المسيّل.
يعود سبب ندرة النيون على الأرض، كما هو الحال مع الهيليوم، إلى خفّته وتطايريّته العالية ولارتفاع ضغط البخار لديه عند درجات حرارة منخفضة، بالإضافة إلى خموله الكيميائي الذي يعيق تشكيل مركّبات كيميائية. كلّ تلك الخواص حالت دون احتجازه في الغاز المتكاثف وضمن سحب الغبار التي شكّلت الكواكب الصغيرة والحارّة مثل الأرض.
يستحصل على النيون كمنتج ثانوي من عمليّة فصل مكوّنات الهواء باستخدام عملية ليندة. بعد فصل كل من بخار الماء وثنائي أكسيد الكربون والأكسجين والغازات النبيلة ذات درجات الغليان الأعلى، وجزء كبير من النتروجين، يتبقّى مزيج غازي مكوّن من 35 % نيون بالإضافة إلى حوالي 50 % نتروجين؛ ونسبة كسر مولي متبقيّة من بخار الماء والهيليوم.
يمكن إتمام عملية الفصل بعدّة وسائل بحيث يتم الحصول في النهاية على غازات نقيّة من النيون والهيليوم. إحدى هذه الوسائل تتم من خلال التكثيف المتتالي عند درجات غليان متفاوتة والاستفادة من تأثير جول-طومسون في إجراء عملية الفصل. بعد فصل الهيدروجين بواسطة التفاعل مع الأكسجين بوجود حفاز وإزاحة الماء المتشكّل؛ يتمّ بعد ذلك إسالة النتروجين عند درجة حرارة تبلغ 66 كلفن وضغط 30 بار، ويفصل عن المزيج. تجري بعد ذلك عمليّة تنقية من النتروجين المتبقي بواسطة الامتزاز على على السيليكا جل (هلام السيليكا)، فيتبقّى مزيج غازي مكوّن من حوالي 76 % نيون و 24 % هيليوم، والذي يعرّض إلى ضغوط مرتفعة تصل إلى 180 بار عند درجة حرارة الغرفة في البداية، ثم تخفّض تدريجياً إلى 50 كلفن. يجري تخفيف الضغط والتمديد إلى 25 بار، حيث يتكاثف عندها النيون، ويبقى الهيليوم بالحالة الغازية؛ ثم يتم التأكّد من الفصل بشكل أدقّ باستخدام عمود تجزئة.
كطريقة أخرى يمكن إجراء عمليّة امتزاز، والتي تطبّق بعد فصل النتروجين؛ حيث يُمتزّ المزيج الغازي الحاوي على نسبة من النيون على مادة مازّة عند ضغط مقداره 5 بار ودرجة حرارة تصل إلى 67 كلفن. بتخفيف الضغط إلى 3 بار يتحرّر النيون مرّة أخرى (عملية انتزاز)، ويفصل بالتالي عن الهيليوم. من أجل الحصول على نقاوة أعلى تعاد عملية الامتزاز لمرّتين على التوالي.

هناك بالإجمال 18 نظيراً معروفاً للنيون، وتتراوح الكتل الذرّية لهذه النظائر بين 16Ne و 34Ne. من بين هذه النظائر هناك ثلاثة نظائر مستقرّة، وهي: 20Ne و 21Ne و 22Ne؛ وأكثرها وفرةً في الطبيعة هو النظير نيون-20 20Ne بنسبة 90.48 %؛ يليه النظير نيون-22 22Ne بنسبة 9.25 % ؛ ثمّ النظير نيون-21 21Ne بنسبة 0.27 %.
للنظيرين 21Ne و 22Ne أصل مختلط، فقسم منه عبارة عن نويدة ابتدائية أصلية منذ نشأة الكون والآخر نويدة مولَّدة ناتجة عن التفاعلات النووية للنويدات الأخرى مع النيوترونات أو الجسيمات الأخرى المحيطة. بالمقابل، فإنّ النويدة الأكثر وفرةً وهي 20Ne عبارة عن نويدة ابتدائية تشكّلت أثناء التخليق النووي النجمي، ولا تتولّد إلّا في حالات نادرة؛ لذلك فإنّ سبب التفاوت في نسبة 20Ne في الأرض هو محلّ خلاف بين العلماء. إنّ التفاعل النووي الأساسي الذي يعطي نظائر النيون الوليدة يبدأ من 24Mg و 25Mg، واللذان يعطيا 21Ne و 22Ne على الترتيب، وذلك من خلال اصطياد النيوترونات والإصدار الفوري لجسيمات ألفا. يتمّ الحصول على النيوترونات المصطادة من تفاعل تشظّي ثانوي ناتج عن سلسلة اضمحلال اليورانيوم.
نتيجة لتطاير النيون وفقدانه في الكون وبسبب تشكّله في التفاعلات النووية، فإنّ النسبة 20Ne/22Ne و 21Ne/22Ne من النيون المحتجز داخل الصخور، والمحجوب عن التماس مع الغلاف الجوي المحيط، هي نسبة غير واحدة وغير متساوية دوماً. تكون المحصّلة النهائية وجود ميل لانخفاض نسبة 20Ne/22Ne مقابل ارتفاع نسبة 21Ne/22Ne في الصخور الغنيّة ياليورانيوم. يمكن للنظير نيون-21 أن يتشكّل من تفاعلات نووية مولّدة له عندما يلتقط 20Ne نيوتروناً من مصادر طبيعية كونية، كما يتشكّل أيضاً من تفاعلات التشظي على المغنسيوم والصوديوم والسيليكون والألومنيوم. لذلك فإنّ نسبة النظائر المذكورة تعطي دلائل على مرحلة التكوّن؛ فالنيون المحتجز داخل الصخور والمتشكّل من تفاعلات تشظية الأشعة الكونية تكون لديه نسبة مرتفعة من 21Ne. أما نويدات النيون الابتدائية التي احتجزت داخل الصخور والأحجار الكريمة مثل الألماس قبل فقدان قسم كبير من النيون فهي ذات نسبة مرتفعة من 20Ne. من خلال تحليل نسب هذه النظائر الثلاثة يمكن بالتالي التمييز بين النيون القادم من مصدر محتجز داخل صهارة الأرض وبين النيون الكوني وبين النيون المولّد نووياً، كما تستخدم هذه النسب في تحديد زمن التعرّض الكوني للصخور والأحجار النيزكية.
أمّا باقي النظائر الأخرى فهي نظائر مشعة ذات عمر نصف قليل، يبلغ حدّه الأعظمي 3.38 دقيقة للنظير نيون-24 24Ne.
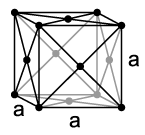
يكون النيون في الشروط القياسية من الضغط ودرجة الحرارة على شكل غاز أحادي الذرة عديم اللون والرائحة، ويبدأ بالتكاثف عند درجات حرارة تصل إلى 27 كلفن (− 246 °س)؛ ويتصلّب عند 24.57 كلفن (− 248.59 °س). بالتالي فلدى النيون أصغر مجال من درجات الحرارة في الحالة السائلة بالمقارنة مع باقي العناصر الكيميائية. كما هو الحال مع باقي الغازات النبيلة - عدا الهيليوم - يتبلور النيون الصلب وفق نظام بلوري مكعّب، وتبلغ قيمة ثابت الشبكة البلورية له a = 443 بيكومتر.

تبلغ كثافة النيون 0,9 كغ/م3 عند 0 °س و 1013 هيكتوباسكال، بالتالي فهو أخفّ من الهواء ويصعد إلى الأعلى. تقع النقطة الثلاثية في مخطط أطوار النيون عند 24.56 كلفن و 43.37 كيلوباسكال؛ أمّا النقطة الحرجة فتقع عند 44.4 كلفن و 265.4 كيلوباسكال؛ في حين أنّ الكثافة الحرجة يبلغ مقدارها 0.483 غ/سم3. للنيون انحلالية ضعيفة في الماء، حيث يمكن أن ينحلّ منه أعظمياً مجرّد 10.5 مل في ليتر واحد من الماء عند 20 °س.
يظهر النيون، كما هو الحال مع باقي الغازات النبيلة، عند تعريضه لتفريغ كهربائي خطوطاً طيفية مميّزة. تقع الخطوط الطيفية للنيون في المجال المرئي في الطرف الأحمر إلى الأصفر، لذلك يبدي غاز النيون في أنابيب التفريغ اللون الأحمر البرتقالي الساطع المميّز. يحوي طيف النيون أيضاً خطّاً قوّياً في المجال الأخضر، ولكنّه لا يظهر لطغيان اللون في المجال الأحمر، ولا يمكن مشاهدته إلا عند تفريق المكوّنات البصرية لللضوء بواسطة مطياف بصري.
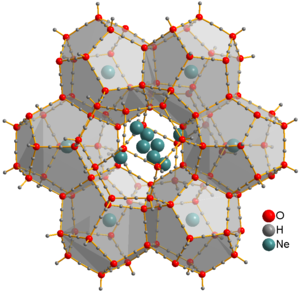
النيون كأحد الغازات النبيلة النمطية لا يقوم بأي نشاط كيميائي يذكر، فهو غاز خامل، وكما هو الحال مع الهيليوم، فليس لعنصر النيون أيّة مركّبات كيميائية معتدلة مستقرّة معروفة. يعود السبب في ذلك إلى اكتمال غلاف التكافؤ بالالكترونات (توزيع الغاز النبيل)، لذلك فهو يوجد بحالة غاز أحادي الذرة. يمكن الحصول على أيونات من النيون فقط باستخدام تقنية مطيافية الكتلة، ومن أمثلتها +Ne و +ArNe و +HeNe و +HNe؛ وذلك ضمن جو مفرغ من الغازات.
حسب الحسابات النظرية فإنّ النيون هو أكثر العناصر الكيميائية خمولاً، وذلك حتى بالمقارنة مع باقي الغازات النبيلة، إذ وجد أنّ إنتالبية التفكّك لمركّبات من النمط NgBeO، حيث يرتبط Ng (رمز يشير إلى الغاز النبيل) مع أكسيد البيريليوم BeO، تكون أقلّ ما يكون عند النيون. وحتى بالنسبة للهيليوم، إذ وجد نظرياً أنّ مركّب فلوروهيدريد الهيليوم HHeF هو أكثر ثباتاً واستقراراً من نظيره في النيون، ويعود ذلك إلى كبر المسافة بين الفلور والهيدروجين، ممّا يضعف بالتالي قوى التجاذب في أيون +HNe وذلك بالمقارنة مع نظيره في الهيليوم، أو يمكن أن تنسب إلى التآثر التنافري بين مدارات p-π في كاتيون النيون.
يمكن للنيون أن يشكّل ما يعرف باسم المركّبات القفصية (الكلاثيرات)، والتي تنشأ عندما تحتجز ذرّات النيون داخل تجويف مركّب كيميائي آخر، بحيث أنّ الترابط لا يكون كيميائياً، إنّما إحاطة فيزيائية بالمادة. يتمّ الحصول على هيدرات قفصية صلبة من الجليد والحاوية على غاز النيون المحتجز داخلها عند ضغوط كبيرة تتراوح بين 0.35 – 0.48 غيغاباسكال ودرجات حرارة منخفضة تصل إلى –30 °س. يستطيع النيون أن يتحرّر من هذه المركّبات بوضعها في حجرة تفريغ لعدّة أيام، مخلّفاً وراءه نوع من الجليد يعرف بالرمز ice XVI، وهو أخفّ أنواع بلورات الجليد كثافة.
يلعب النيون، وخاصة النظير 20Ne دوراً مهمّاً كناتج وسطي أثناء عملية التخليق النووي في النجوم. إنّ أوّل تشكّل للنظير النيون-20 يتم في عملية احتراق الكربون، في حين أنّه لا يتشكّل في عملية احتراق الهيليوم (تفاعل ألفا الثلاثي)، وذلك بسبب صغر قيمة مقطع التصادم لنوى 16O مع جسيمات ألفا α؛ في حين أنّه من الممكن فقط للنظائر 21Ne و 22Ne أن تتشكّل من النظير الأثقل للأكسجين 18O. عندما ترتفع درجة حرارة وكثافة النجم بعد استهلاك الهيليوم تأتي بعد ذلك مرحلة احتراق الكربون، والتي يتمّ فيها اندماج ذرتي كربون ليتشكّل بادئ الأمر نظير المغنسيوم 24Mg* ، والذي يتفكّك بدوره مطلقاً أشعة ألفا إلى النويدة 20Ne.

مع تزايد درجات الحرارة والضغط تصل الأمور إلى عملية احتراق النيون، والتي يتفكّك فيها النيون بإصدار أشعة ألفا إلى 16O.

وتحدث هذه العملية بسبب القابلية العالية لنوى 20Ne لأشعة غاما بالمقارنة مع نوى 16O الأخفّ، والتي يتوقّع أن تخوض هي ذلك التفاعل. بعد انتهاء عملية احتراق النيون تبدأ عملية احتراق الأكسجين، والتي تنتج العناصر الأثقل مثل السيليكون والكبريت والفوسفور.


نظراً لندرة غاز النيون وصعوبة عمليّة فصله واستخلاصه، والتي تترجم في ارتفاع ثمنه بالمقارنة بثمن الأرغون، فإنّ استخدمات النيون تكون بكمّيّات ضئيلة فقط وتطبيقاته محدودة. من هذه التطبيقات استخدامه في ملء أنابيب المهبط البارد ومصابيح النيون وكذلك في مصابيح الفلوريسنت أيضاً، والتي يحدث فيها عملية تفريغ كهربائي والتي تسبّب إشعاع ضوء برتقالي اللون مميّز للنيون؛ كما يستخدم كذلك في لمبات الوماض. عادة ما تكون مصابيح النيون صغيرة، ويتراوح جهد التشغيل لها بين 100 و 250 فولت؛ وكانت تستخدم كثيراً للدلالة على مرور التيار الكهربائي في الدارات، لكنها استبدلت حالياً بالصمامات الثنائية المضيئة (LED) الأوفر. أمّا لافتات النيون فيتمّ تشغيلها عادةً عند قيم جهد مرتفعة تتراوح بين 2 - 15 كيلوفولت، ويصل طول الأنابيب المضيئة إلى بضعة أمتار. تصاغ الأنابيب الزجاجية عادة على أشكال أو أحرف للإعلان والدعاية، بالإضافة إلى تطبيقات فنية وهندسية أخرى.
يمثّل ليزر هيليوم-نيون، والذي يستخدم فيه مزيج من هذين الغازين، أحد أهم أنواع الليزر. يحدث انقلاب الإشغال اللازم لهذا الليزر عن طريق إثارة غاز الهيليوم أوّلاً فتنطلق منه إلكترونات تعمل على إثارة ذرّات النيون. تحدث هذه الإثارة المحفّزة للنيون عند طول موجة مقدراه 632.8 نانومتر (طيف أحمر)؛ وعند 1152.3 و 3391 نانومتر (في نطاق الأشعة تحت الحمراء). كما يوجد نطاقين آخرين أحدهما في نطاق الضوء الأخضر عند طول موجة للأشعة 543.3 نانومتر.
يمكن استخدام النيون السائل كمادة مثلِّجة، إذ أنّ له قدرة تثليج أكبر بأربعين مرة من الهيليوم السائل، وبثلاث مرات من الهيدروجين، بالتالي فهو ينافس الهيليوم في هذا المجال من حيث الكفاءة بالنسبة للسعر. من التطبيقات الأخرى لغاز النيون استخدامه كأحد مكوّنات غاز التنفس مع الأكسجين عند الغوص لأعماق كبيرة (غاز نيوكس Neox)، إلّا أنّه يندر استخدامه وذلك لارتفاع ثمنه بالمقارنة مع الهيليوم من جهة، ولارتفاع مقاومته في الطرق التنفسية من جهة أخرى.
يعتبر غاز النيون من الغازات قليلة الضرر، وليس له أي تأثير حيوي على جسم الإنسان كما هو الحال مع باقي الغازات النبيلة، وهو غير سامّ.
عند وجود غاز النيون بتراكيز مرتفعة للغاية يمكن أن يسبّب خطر الاختناق وذلك عندما يحجب أكسجين التنفّس. عند ضغوط أعلى من 110 بار يكون لغاز النيون تأثير مخدّر.
| في كومنز صور وملفات عن: نيون |
This article uses material from the Wikipedia العربية article نيون, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). المحتوى متاح وفق CC BY-SA 4.0 ما لم يرد خلاف ذلك. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki العربية (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.