Nitroësuur: Chemiese verbinding
Nitroësuur (word soms salpeterigsuur genoem, molekulêre formule HNO2) is 'n swak en monoprotiese suur wat slegs in oplossing, in die gasfase en in die vorm van nitrietsoute (NO−2) bekend is.
Nitroësuur word gebruik om diasoniumsoute van uit amiene te maak. Die resulterende diasoniumsoute is reagense in aso-koppelingsreaksies om aso-kleurstowwe te vorm.
| Algemeen | |
|---|---|
| Naam | Nitroësuur |
| Sistematiese naam | Hidroksidooksidostikstof |
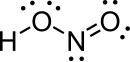 |  |
| Chemiese formule | HNO2 |
| Molêre massa | 47,013 g•mol-1 |
| CAS-nommer | 7782-77-6 |
| Voorkoms | Ligblou oplossing |
| Fasegedrag | |
| Smeltpunt | Slegs bekend in oplossing of as gas |
| Kookpunt | |
| Digtheid | 1 g•ml-1 |
| Oplosbaarheid | |
| Suur-basis eienskappe | |
| pKa | 3,15 |
| Veiligheid | |
| Flitspunt | nie flambaar |
| Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
- Moet nie met salpetersuur (HNO3) verwar word nie
Struktuur
In die gasfase rangskik die vier atome wat 'n molekule nitroësuur vorm hulself op 'n plat vlak. Binne daardie vlak het hulle twee moontlike konformasies. Die planêre nitroësuurmolekule kan beide 'n sin- en 'n anti-vorm aanneem. Die anti-vorm oorheers by kamertemperatuur, en infrarooispektroskopie-metings dui aan dat dit meer stabiel is met ongeveer 2,3 kJ/mol.
|
Voorbereiding
Nitroësuur word gewoonlik voorberei deur versuring van waterige oplossings van natriumnitriet met 'n minerale suur. Die versuring word gewoonlik by ystemperature uitgevoer. Omdat nitroësuur onstabiel is en vinning ontbind word dit gewoonlik in situ verbruik, dws soos dit voorberei word.
Nitroësuur kan ook geproduseer word deur distikstoftrioksied in water op te los volgens die vergelyking
Reaksies
Ontbinding
Sien ook: Distikstoftrioksied
Gasvormige nitroësuur ontbind om stikstofdioksied, stikstofoksied en water te vorm:
Stikstofdioksied breek op in waterige oplossing en vorm salpetersuur en nitroësuur:
In warm of gekonsentreerde oplossings kom die algehele reaksie neer op die produksie van salpetersuur, stikstofoksied en water:
Reduksie
Die reduksie-reaksie van nitroësuur word gebruik om baie produkte te skep, insluitend:
Met I−- en Fe2+-ione word stikstofoksied (NO) gevorm:
Met Sn2+-ione word distikstofmonoksied (N2O) gevorm:
Met swaweldioksied-gas (SO2) word hidroksilamien (NH2OH) gevorm:
Met hidrasinium (N2H+5) word ammoniak (HN3) gevorm en daarvan word stikstof-gas (N2) gevorm:
Atmosfeer van die Aarde
Nitroësuur is betrokke by die osoonreaksies van die onderste atmosfeer, die troposfeer. Die reaksie van stikstofoksied (NO) en water produseer nitroësuur. Wanneer hierdie reaksie op die oppervlak van atmosferiese deeltjies plaasvind, verander die produk maklik deur reaksie met lig tot hidroksielradikale. Hidroksielradikale is hoogs reaktief en ondergaan chemiese reaksies wat hulle kortstondig maak. Wanneer biologiese stelsels aan hidroksielradikale blootgestel word kan dit skade aan selle veroorsaak waar hulle met DNS, lipiede en proteïene kan reageer.
Die Aarde se naghemel word verlig deur verspreide lig wat luggloed genoem word. Dit word word deur stralingsoorgange van atome en molekules geproduseer. Van die mees intense sulke kenmerke wat in die Aarde se naghemel waargeneem is, is 'n groep infrarooi oorgange by golflengtes tussen 700 nanometer en 900 nanometer. In 1950 het Amerikaanse sterrekundige Aden Meinel gewys dat dit oorgange van die hidroksielmolekule was.
Kyk ook
Verwysings
This article uses material from the Wikipedia Afrikaans article Nitroësuur, which is released under the Creative Commons Attribution-ShareAlike 3.0 license ("CC BY-SA 3.0"); additional terms may apply (view authors). Inhoud is onderhewig aan CC BY-SA 4.0, tensy anders vermeld. Images, videos and audio are available under their respective licenses.
®Wikipedia is a registered trademark of the Wiki Foundation, Inc. Wiki Afrikaans (DUHOCTRUNGQUOC.VN) is an independent company and has no affiliation with Wiki Foundation.













